短日照诱导白花泡桐顶芽死亡过程相关基因的表达*
2022-05-11李顺福王慧敏房丽莎
李顺福 王慧敏 房丽莎 刘 震
(河南农业大学林学院 郑州 450002)
在秋季短日照和低温诱导下大多数温带多年生木本植物高生长停止,形成休眠芽抵抗冬季的寒冷和干燥,并经过低温解除休眠,在来年春季适时萌发进行又一轮的生长-休眠的季节生长发育周期(永田洋等, 1994; Jianetal., 1997; 劉震, 2000; Horvathetal., 2003; 简令成等, 2004; Olsen, 2010),休眠芽的发育决定着该树种的高度(Perry, 1971)。
泡桐属(Paulowina)树种作为我国优良的速生树种,横跨亚热带与暖温带,既能适应温暖湿润的亚热带气候又能适应冬季较寒冷干燥的暖温带气候,但其顶芽与多数树干通直圆满高大的树种如杨树(Populus)(Jianetal., 1997)、山桐子(Idesiapolycarpa)(刘震等, 2000)能够形成饱满的休眠芽不同,当年秋季死亡,翌年春季对生侧芽萌发形成假二叉分枝,导致“冠大干低”(刘震等, 2004)。从20世纪60年代开始,许多学者开展研究探求泡桐顶芽死亡的原因,提出如下原因: 一是冬季低温胁迫(竺肇华, 1981),或者低温到来时泡桐尚未封顶导致未完全木质化(蒋建平, 1990); 二是水分胁迫导致(侯元凯等, 2001); 三是冬季低温胁迫和水分胁迫共同作用的结果(叶金山等, 2009); 刘震等(2004)在研究泡桐顶侧芽休眠的温度特性时发现,在气温尚高的9—10月份就发生死亡,而且顶芽未发育成饱满的越冬休眠芽,更不能经历冬季低温,提出泡桐顶芽死亡是在长期进化过程中获得的一种生理生态适应的假说(刘震等, 2004)。为验证该假说,开展了泡桐高生长停止和死亡过程中顶芽环境因素调控、内外部形态、内源激素、细胞程序性死亡等方面的研究(王艳梅等, 2009; 2012; 2013; 2016; Wangetal., 2018; 王国霞等, 2017),得出18 ℃以上的短日照诱导能使泡桐高生长停止,顶芽不能形成越冬休眠芽而死亡; 顶芽内源激素从高生长停止到死亡过程中,ABA、GA、IAA、ZR 4种激素含量均呈下降趋势,其中ABA的变化明显不同于一般具有休眠芽的树种(王艳梅等, 2012)。ABA作为一种抗逆激素,在植物体的积累有助于提高植物的抗性,对多年生植物生长停止和芽的形成与休眠起着重要的调控作用(Rohdeetal., 2002)。像泡桐属一类的树种为什么不能形成越冬休眠芽,其基因如何调控顶端分生组织分化而导致顶芽死亡?Wang等(2019)通过短日照诱导毛泡桐20天(Paulowinatomentosa)的转录组分析,得出昼夜节律PIF3和PRR5基因上调表达和生长素信号上IAA、ARF和SAURs基因下调表达导致泡桐高生长的停止,但20天的短日照处理不能反映顶芽的死亡过程,其转录组结果也不能反映顶芽死亡发生过程中基因调控的变化。鉴于此,本研究通过延长短日照处理事件到42天,在高生长期、高生长停止期、顶芽死亡发生期3个时期进行转录组测序分析,确定泡桐顶芽死亡发生过程中差异表达基因,为探究泡桐顶芽死亡分子机制提供基础。
1 材料与方法
1.1 试验材料
2016年10月取白花泡桐(Paulowniafortunei)的种子于2017年3月播种在容器中(容器规格30 cm×28 cm),取生长状态近似的50株分2组于8月放入在河南省郑州市河南农业大学林学试验站(113°38′E,34°47′N)的人工气候室中恒温25 ℃下8 h光照/16 h黑暗条件处理,每隔7天对泡桐高生长变化进行测量,并在处理14天(高生长期SDa)、28天(高生长停止期SDb)、42天(顶芽死亡发生期SDc)进行采样; 每个时期随机采3株距顶端0.5 cm左右的泡桐顶芽,放入液氮中,储存于-80 ℃冰箱中分别用于转录组分析。
1.2 RNA提取及文库构建
样品在液氮中粉碎后提取RNA,用1%的琼脂糖电泳检测样品是否有降解及杂质,用K5500分光光度计(凯奥,北京)检测样品纯度,用安捷伦2100RNA Nano 6000Assay Kit(Agilent Technologies,CA,USA)检测样品的完整性和浓度。总RNA样本检测合格后,用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入片段缓冲液使其片断成为短片段,再以片断后的mRNA为模板,用六碱基随机引物合成cDNA第1链,并加入缓冲液、dNTPs、RNaseH和DNA Polymerase I继续合成cDNA第2链,经过QIAQuick PCR试剂盒纯化并加EB缓冲液洗脱,洗脱纯化后的双链cDNA再进行末端修复、加碱基A、加测序接头处理,然后经琼脂糖凝胶电泳回收目的大小片段并进行PCR扩增,完成整个文库制备。构建好的文库用Illumina平台进行测序。
1.3 转录组数据处理与组装
测序得到的原始序列raw reads去除接头污染和低质量的序列,去除未知碱基大于5%的序列得到数据为clean reads。利用Trinity软件对clean reads进行de novo拼接组装获得转录本序列,取每条基因中最长的转录本作为Unigene序列。
1.4 差异基因功能注释分类和代谢通路分析
Unigenes的表达量计算使用RPKM(reads per kilobase per millon mapped reads),即每百万reads 中来自于某基因每千碱基长度的reads数,利用DEGSeq2软件对3个样品间的Unigenes进行比较,并选取∣log2FoldChange∣≥1且校正P<0.05的基因作为显著差异表达基因,将差异基因与NR、NT、GO、EggNOG、KEGG、UniProt、Pfam数据库进行比对和功能注释,用校正P<0.05对差异基因进行GO和KEGG富集分析。
1.5 荧光定量qRT-PCR验证
为了验证转录组信息和差异基因分析结果的准确性,随机选择11个差异表达基因的Unigenes序列利用Premier 5设计引物,并以白花泡桐18 S核糖体RNA为内参基因(曹喜兵, 2014)。以各时期cDNA为模版进行qRT-PCR验证,引物合成由上海生工生物工程有限公司完成,将提取的RNA用M-MuLV反转录试剂盒(上海生工生物工程有限公司)合成cDNA的第1条链,稀释100倍后利用SYBRTM Select master Mix(Thermo Fisher公司)进行荧光定量PCR反应(ABI 7500 Fast荧光定量PCR仪)。qRT-PCR反应条件: 95 ℃预变性3 min; 95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸1 min,40个循环。生物学重复3次,技术重复3次,用2-△△Ct法计算相对表达量。结果用IBM SPSS Statistics 19 软件分析,OriginPro 9软件作图。
2 结果与分析
2.1 短日照对白花泡桐外部形态的影响
在25 ℃恒温的人工气候室中,用短日照(8 h光照/16 h黑暗)处理14天,株高不断增加,顶端和幼叶呈现嫩绿色,表面密生白色腺毛,处于高生长期(SDa); 处理28天,株高不再增加,顶端颜色由嫩绿色变为深绿色并不再萌发新的幼叶,处于高生长停止期(SDb); 处理42天,顶端幼叶脱落,顶芽萎缩变小变褐色,顶芽下端出现断痕,处于顶芽死亡发生期(SDc)(图1)。

图1 短日照处理下白花泡桐株高和顶芽状态
2.2 转录组数据组装及结果
用Illumina平台对SDa、SDb、SDc 3个时期(每个时期3个生物学重复)共9个样品进行转录组测序,共测得57.47 Gb的原始数据。过滤后的clean reads的Q30都在92.85%以上,GC含量约为42.25%,每组数据情况见表1。
2.3 差异基因分析
对3个时期测序结果进行比较,选取∣log2FoldChange∣ ≥1且校正P< 0.05的基因作为显著差异表达基因,共筛选出44 937个差异基因,其中有37 076条(83.51%)基因在7大数据库中被注释(表2)。SDb和SDa显著差异的基因为13 378条,其中上调表达9 923条,下调表达3 455条; SDc和SDb显著差异的基因为25 341条,其中上调表达16 879条,下调表达8 462条; SDc和SDa显著差异的基因33 056条,上调表达25 640条,下调表达7 416条; 3个时期差异基因共同上调的基因1 730条,共同下调的基因441条(图2)。

表1 短日照诱导白花泡桐顶芽3个时期reads 质量统计
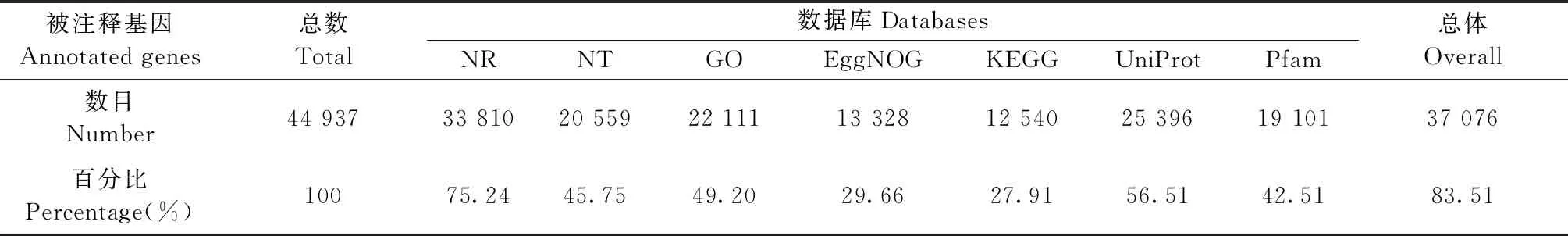
表2 差异基因功能注释结果统计

图2 短日照诱导下3个时期差异表达基因数(A)及分布情况(B)
2.4 差异基因GO功能富集分析
对3个时期的差异基因进行注释后,将注释成功的基因按照GO的3大类: 生物学过程(biological process)、细胞组分(cellular component)和分子功能(molecular function),进行分类。对分类中差异基因的数目进行超几何检验,用校正P<0.05找到差异表达基因中显著富集的GO条目(图3),发现3个时期富集到GO上的差异基因趋势基本一致,其中富集到细胞组分的差异基因最多的3个亚类是细胞成分、细胞器和细胞器组分; 富集到生物学过程的差异基因最多的3个亚类为细胞过程、代谢过程和生物调控; 富集到分子功能的差异基因最多的3个亚类为结合活性、催化活性和转录调控活性。

图3 不同时期差异表达基因GO聚类分析
2.5 差异基因的KEGG富集通路分析
将白花泡桐顶芽3个时期差异基因在KEGG数据库分析,以校正P<0.01为标准对代谢通路进行富集分析: 在短日照处理中其中SDb vs SDa涉及的代谢通路为134条,富集到的通路为8条,富集程度最高的3个通路分别为植物激素信号转导,角质、木栓质和蜡的合成及光合作用天线蛋白通路; SDc vs SDb涉及到的代谢通路为133条,其中富集到的通路为4条,富集程度最高的3个通路分别为植物激素信号转导、氨基酸合成、淀粉和蔗糖代谢通路; SDc vs SDa涉及到的代谢通路为135条,富集到的代谢通路为10条,富集程度最高的3个通路分别为植物激素信号转导、淀粉和蔗糖代谢及苯丙烷类合成通路(表3)。
2.6 植物激素调控通路的差异基因分析
通过对白花泡桐顶芽KEGG代谢通路的富集分析,得出植物激素信号转导通路在3个时期都有显著富集并且富集程度最高。在植物激素信号转导通路上共筛选出30个差异基因,其中在生长素(IAA)信号转导途径中生长素响应因子ARF、IAA、GH3和SAUR在SDb和SDc均下调表达; 细胞分裂素(CTK)信号转导途径中的ARR-B家族因子在SDb上调表达,在SDc下调表达; 赤霉素(GA)信号转导途径的DELLA有2个差异基因在SDb和SDc均为下调表达; ABA信号转导途径的相关的蛋白磷酸酶2C(PP2C)在SDb和SDc为上调表达,蔗糖非酵解型蛋白激酶SnRK2和ABF的3个差异基因在SDb均表现为上调表达,在SDc均出现下调表达; ETH转导通路的正调控因子EIN2和EIN3在SDb出现上调表达,在SDc下调表达; 反应元件结合蛋白ERF1的2个差异基因在SDb和SDc均上调表达; BR信号转导通路上的编码木葡聚糖内糖基转移酶的TCH4在SDc出现了上调表达,细胞周期蛋白CYCD3在SDb下调表达,在SDc上调表达(图4、表4)。
2.7 差异表达基因的qRT-PCR验证
为了验证转录组信息和差异基因分析结果的准确性,以白花泡桐18 S核糖体RNA为内参基因,选取激素信号转导通路和光合作用通路上的11个差异基因进行qRT-PCR(表5),用差异基因在不同样品间的差异倍数进行比较,发现这11个差异基因在不同样品中的结果与转录组测序的表达结果趋势基本一致(图5)。
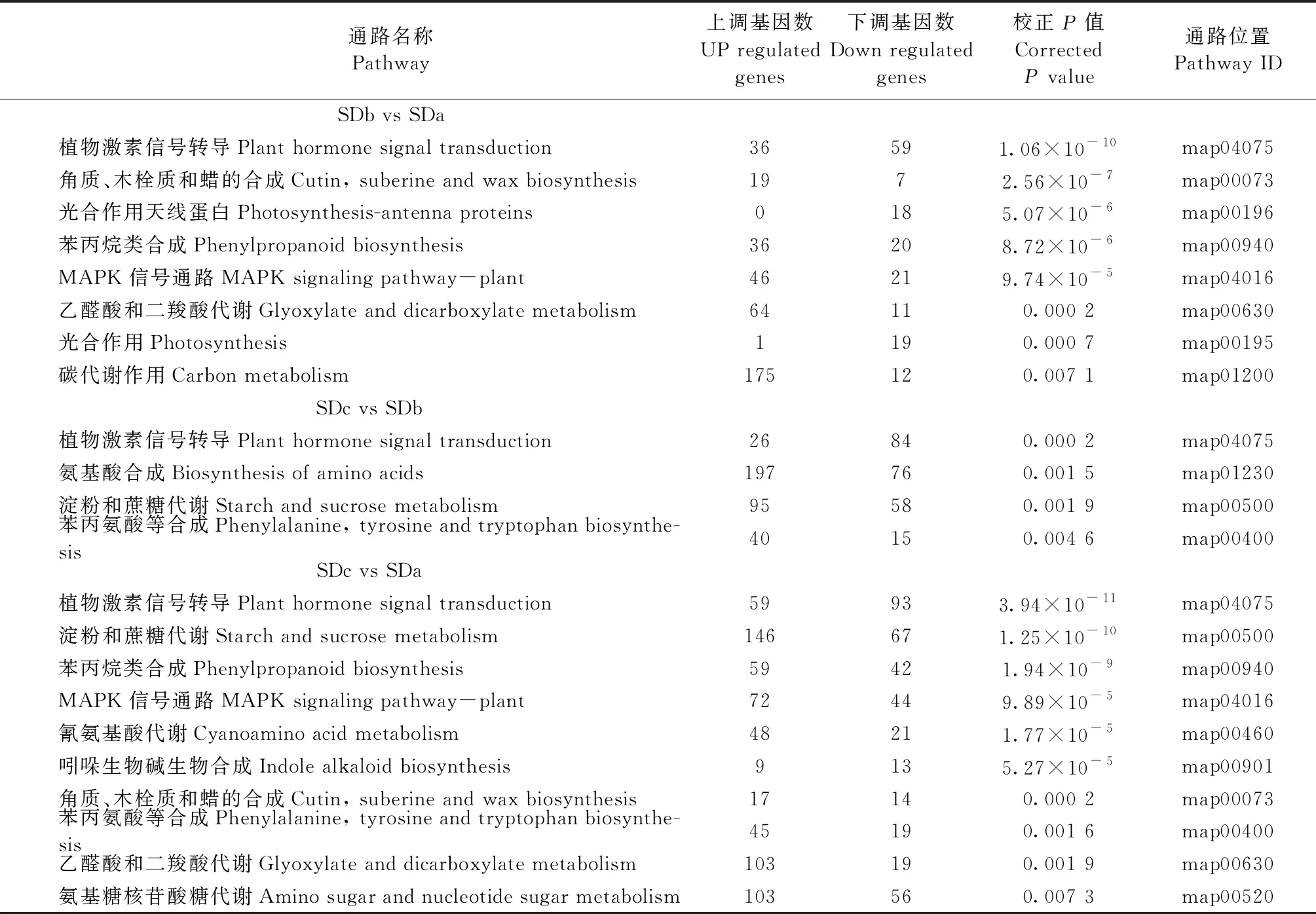
表3 差异表达基因KEGG富集通路分析

表4 富集到植物激素信号转导KEGG通路上差异基因及功能描述①
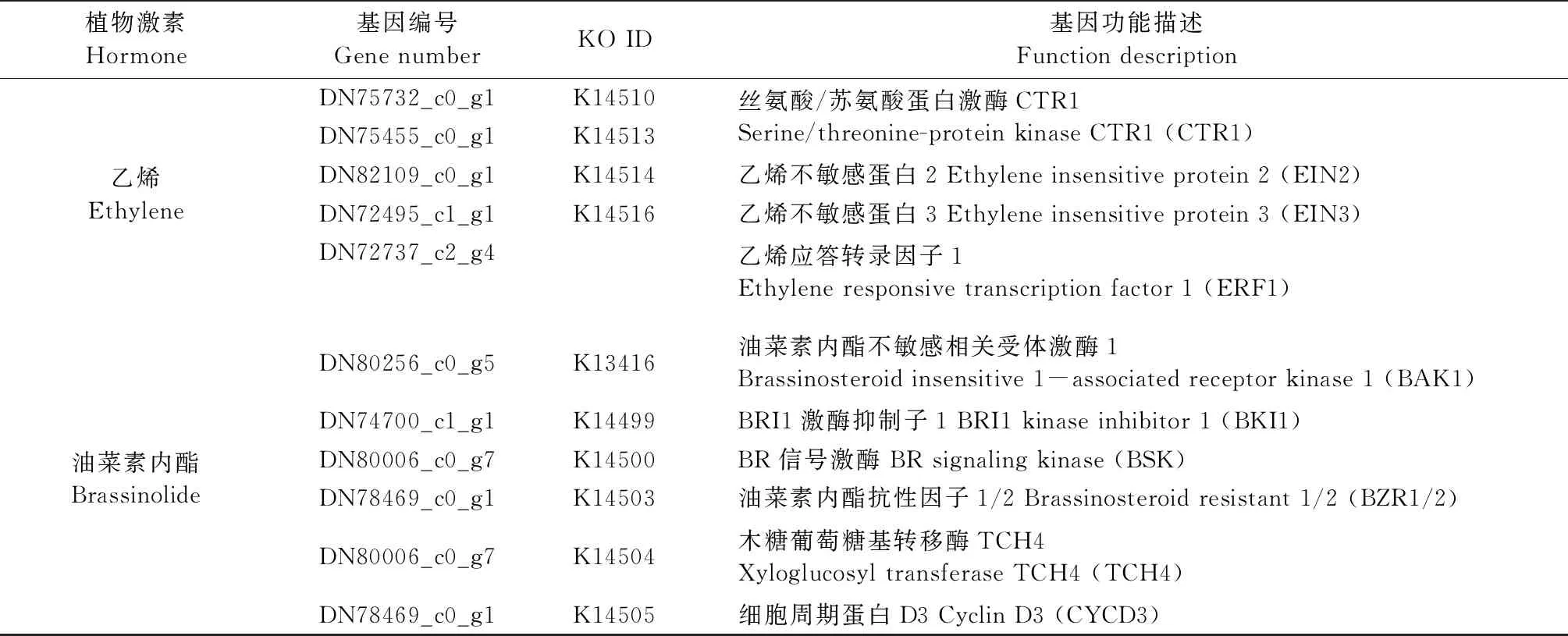
续表 Continued

图4 短日照诱导下激素转导KEGG通路及相关基因表达热图

表5 选取qRT-PCR验证的基因编号和引物序列
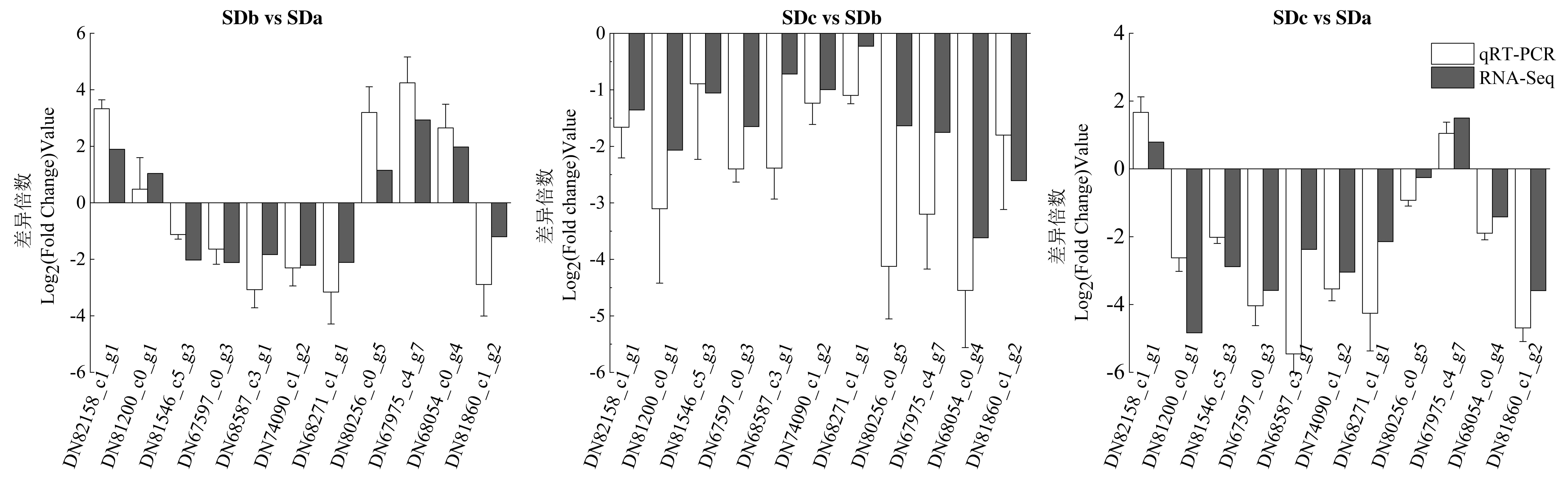
图5 qRT-PCR和RNA-Seq在3组样品间差异倍数的比对
3 讨论
通过对短日照诱导白花泡桐14天(SDa: 高生长期)、28天(SDb: 高生长停止期)、42天(SDc: 顶芽死亡发生期)的转录组分析,共筛选出44 937个差异基因,其中显著差异的基因25 341条,SDc vs SDb中涉及到的KEGG代谢通路为133条,富集的通路4条分别为植物激素信号转导、氨基酸合成、淀粉和蔗糖代谢和苯丙氨酸等合成通路,未发现Wang等(2019)短日照诱导毛泡桐中昼夜节律通路上差异基因的富集。植物芽休眠本质是茎端分生组织分裂活动的相对静止,植物激素起着重要的调控作用,不同的激素对休眠的影响不同(Cookeetal., 2012),SDc vs SDb的差异基因在KEGG上主要富集在植物激素信号转导通路,并从中筛选出30个差异基因进行分析。
ABA是植物芽休眠建立和维持的必需激素,在其信号转导过程中,ABA与受体PYL结合后与蛋白磷酸酶2C(PP2C)形成复合体抑制PP2C的功能,导致有活性的SnRK2蛋白水平增加,最终激活ABA响应基因的表达(Hubbarbetal., 2010)。在短日照诱导杨树(Ruttinketal., 2007)、沙梨(Pyruspyrifolia)(Lietal., 2018)等高生长停止和芽休眠过程中ABA含量升高,其响应因子ABF均上调表达来建立和维持休眠; 本研究白花泡桐在SDb中SnRK2和ABF为上调表达,但在SDc中SnRK2和ABF却为下调表达,SDc中相关的响应因子表达与杨树(Ruttinketal., 2007)和沙梨(Lietal., 2018)芽休眠过程中不同; 同时对泡桐1年生苗木的激素测定得出ABA的含量从高生长停止到死亡发生呈现上升后下降趋势(王艳梅等, 2012),这与SDc中的响应因子ABF表达趋势一致。因此白花泡桐在SDc中ABA响应因子ABF下调表达,可能是导致其高生长停止后无法形成和维持休眠芽而导致顶芽死亡的主要原因。
ETH对植物器官的成熟和衰老有重要的调节作用,是叶片脱落的重要物质(Johnsonetal., 1998)。在ETH激素信号转导途径中,ETH与受体ETR结合后与负调控因子CTR1相互作用,抑制EIN2转录元件激活后调控下游EIN3转录因子,从而结合ETH响应因子ERF启动子介导下游基因的表达(Lietal., 2015)。ETH的响应因子在植物休眠中也起一定的调节作用,在短日照诱导垂枝桦(Betulapendula)(Ruonalaetal., 2006)和杨树(Ruttinketal., 2007)高生长停止和休眠芽形成阶段ETH响应因子都出现短暂的上调表达,在白花泡桐SDb中EIN2、EIN3和ERF1也出现上调表达,此时高生长停止; 在杨树(Ruttinketal., 2007)芽休眠期ERF1为下调表达,而在白花泡桐SDc中ERF1出现上调表达,此时顶端分生组织分化的叶原基展开的幼叶先于成熟叶片脱落,无法形成芽鳞包裹叶原基的休眠芽,ERF1的上调表达可能导致白花泡桐无法形成具有保护组织的越冬休眠芽。
BR激素在细胞伸长和分裂中起着重要的调节作用(Wangetal., 2014)。在拟南芥(Arabidopsisthaliana)中BR激素信号转导通路上的TCH4基因编码木葡聚糖内糖基转移酶,影响细胞壁的形成和扩展从而导致细胞伸长(Xuetal., 1995); 但TCH4在白花泡桐SDc中出现了上调表达,其他时期不表达。CYCD3是调控细胞周期完成细胞分裂的重要元件,调控细胞分裂的G1-S期和G2-M期(Gutierrezetal., 2002; den Boeretal., 2000),在杨树休眠芽中细胞分裂停止在G1期(Rohdeetal., 1997),其顶端分生组织细胞分裂活动相对停滞,相应细胞周期也进入不活跃状态,CYCD3下调表达(Ruttinketal., 2007); 白花泡桐在高生长停止的SDb中CYCD3出现下调表达,但在SDc中却为上调表达,这表明白花泡桐顶端分生组织细胞在顶芽死亡发生期分裂活动仍在继续进行。TCH4和CYCD3上调表达导致白花泡桐顶端分生组织细胞的活跃从而不能形成正常的休眠芽。
IAA是植物生长必需激素,在植物芽休眠过程中含量急剧下降,白花泡桐在SDb和SDc中IAA响应因子ARF、IAA、GH3和SAUR均下调表达,这与Wang等(2019)在短日照诱导毛泡桐高生长停止期和Ruttink等(2007)诱导杨树休眠期的表达趋势一致; GA与芽休眠的解除有关,在芽休眠过程中含量下降,其中DELLA蛋白是GA信号转导传递的关键元件,白花泡桐在SDc中DELLA下调表达,这与沙梨在休眠期的DELLA表达趋势(刘杭等, 2016)一致。因此,得出白花泡桐在顶芽死亡发生期(SDc)IAA和GA信号转导通路上相关的响应因子的表达与杨树等木本植物休眠期的表达趋势一致,而ABA、ETH和BR上相关响应因子的表达趋势不同。
4 结论
短日照诱导白花泡桐高生长停止初期,ABA和ETH的响应因子出现上调表达,IAA、GA和BR信号转导通路上相关基因下调表达,促使高生长停止,但随着短日照诱导时期的延长,ABA的响应因子ABF却出现下调表达,BR信号转导通路上的TCH4和CYCD3上调表达,导致顶端分生组织细胞的分裂活动仍继续进行,同时ETH响应因子ERF1出现上调表达,可能导致分生组织分化的叶原基展开的幼叶脱落而无法形成芽鳞包裹,使白花泡桐顶芽不能向形成越冬休眠芽方向发展而死亡。
