脑挫裂伤灶周围水肿区大小的变化及其影响因素分析
2022-05-11刘海兵刘长春许伟明魏梁锋洪景芳薛亮王守森
刘海兵,刘长春,许伟明,魏梁锋,洪景芳,薛亮,王守森
据世界卫生组织称,到2020年创伤性脑损伤(traumatic brain injury,TBI)将成为儿童和年轻人致死和致残的主要原因。外伤性脑挫裂伤或外伤性脑实质内出血(traumatic intraparenchymal hemorrhages,tIPH)是TBI一种,可导致终生的认知障碍、身体和心理残疾[1],tIPH是直接和间接机制作用的结果,间接或继发性损伤涉及急性炎症反应的启动[2]。脑水肿及颅内压升高与TBI预后不良有关,脑水肿是TBI患者死亡的主要原因,脑水肿的潜在机制可能因原发性损伤不可改变的性质、患者特征和合并其他临床疾病而不同[3-4]。TBI早期脑水肿主要是血管源性和细胞毒性水肿,其变化取决于损伤机制、时间、参与分子过程、颅内损伤模式和个体差异,这些差异为靶向治疗的发展和管理策略提供了依据,但脑水肿的病理生理机制尚不完全清楚[5]。脑微循环障碍是颅脑损伤后重要的病理生理学变化,已被公认为脑水肿等继发性损害的主要环节和影响神经功能恢复的重要因素[6-7]。目前对于颅脑损伤后继发性损伤与颅内静脉的研究是非常少见的。因此,本研究回顾性分析福州第900医院神经外科2017年1月—2019年11月收治的113例颅脑损伤患者临床资料,旨在研究不同部位脑挫裂伤后周围脑水肿程度的区别,为脑挫裂伤后脑水肿的治疗提供理论基础。现报告如下。
1 资料与方法
1.1 一般资料 共113例颅脑损伤患者,其中男67例,女46例;年龄范围16~60岁,平均年龄(43.08±12.88)岁;车祸伤75例,摔伤25例,高处坠落伤10例,重物砸伤3例;外侧裂静脉区域16例,Labbé静脉区域25例,Trolard静脉区域6例,额叶32例,枕叶17例,小脑3例,白质区域14例。纳入标准:(1)入院时GCS评分10~15分;(2)明确头部外伤史,入院经头颅CT检查明确单纯局部脑挫裂伤,灰质及白质部位挫裂伤直径均应大于1 cm;(3)经头颅CTV或MRI检查证实脑挫裂伤与皮层静脉的关系;(4)生命体征平稳。排除标准:(1)已有明确手术指征[8];(2)有凹陷性骨折并影响静脉回流;(3)有脑血管疾病、脑肿瘤、脑出血及脑梗病史;(4)多发脑挫裂伤,多发伤及复合伤;(5)心肺肾严重疾病、血液相关疾病;(6)长期服用抗凝抗血小板药物;(7)既往有颅脑外伤或颅脑手术史;(8)资料不全。中止标准符合下列任意1项,予以退出:(1)患者脑挫裂伤进展达到手术指征,并接受手术治疗;(2)治疗过程中出现持续低钠血症;(3)新出现符合排除标准的疾病。本研究经福州第900医院伦理委员会审核批准,符合2013年修订的《赫尔辛基宣言》(www.wma.net/en/30publications/10policies/b3/index.html)。
1.2 方法 回顾性收集患者入院时的临床及影像资料,包括GCS评分、年龄、性别、外伤类型、影像图像、红细胞压积(hematocrit,Hct)、纤维蛋白原(fibrinogen,Fg)、D-二聚体(D-dimer,D-D)。将皮层脑挫裂伤累及或围绕外侧裂静脉、Labbé静脉、Trolard静脉主干作为静脉组,共47例;将其他部位脑挫裂伤患者66例作为非静脉组。入科后予绝对卧床,保持床头抬高30°,予甘露醇脱水、镇痛等对症处理,保持大小便通畅,密切观察神志、瞳孔变化。于入院后第6 h、1 d、3 d、5 d复查头颅CT(荷兰Philips Brilliance256层螺旋CT扫描仪),将头颅CT数据导入3D-Slicer软件计算脑损伤及水肿体积,并同时分别记录伤后6 h内和第5 d的Hct、Fg、D-D指标。
1.3 软件操作及血液检验 应用医学图像处理和三维可视化开源软件3D-Slicer测量患者挫裂伤灶、周围脑组织水肿体积,主要步骤:(1)导入Dicom格式的患者 CT 原始图像;(2)运行Editor模块,在二维视窗下分别选择合适的阈值范围(50~100 HU)、(20~33 HU),将脑挫裂伤灶、周围脑组织水肿分别完全染成色,自动识别并分别标记脑挫裂伤灶、周围脑组织水肿区域(图1、2)。深圳迈瑞公司生产的BC-5500型全自动血细胞分析仪;所用全自动血凝分析仪为CA7000(Sysmex,日本);D-D检测试剂盒、校准品和质控品均由西门子医疗诊断公司INNOVANCE@D-dimer提供。所采集患者的静脉血标本2 h内完成检测,所有操作严格按试剂和仪器操作说明书进行。
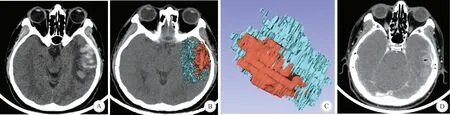
A:左侧Labbé静脉区域脑挫裂伤; B:将脑挫裂伤与周围水肿分别染色; C:应用3D-Slicer软件重建成3D模型; D:CTV示Labbé静脉(黑色箭头)位于脑挫裂伤灶区域
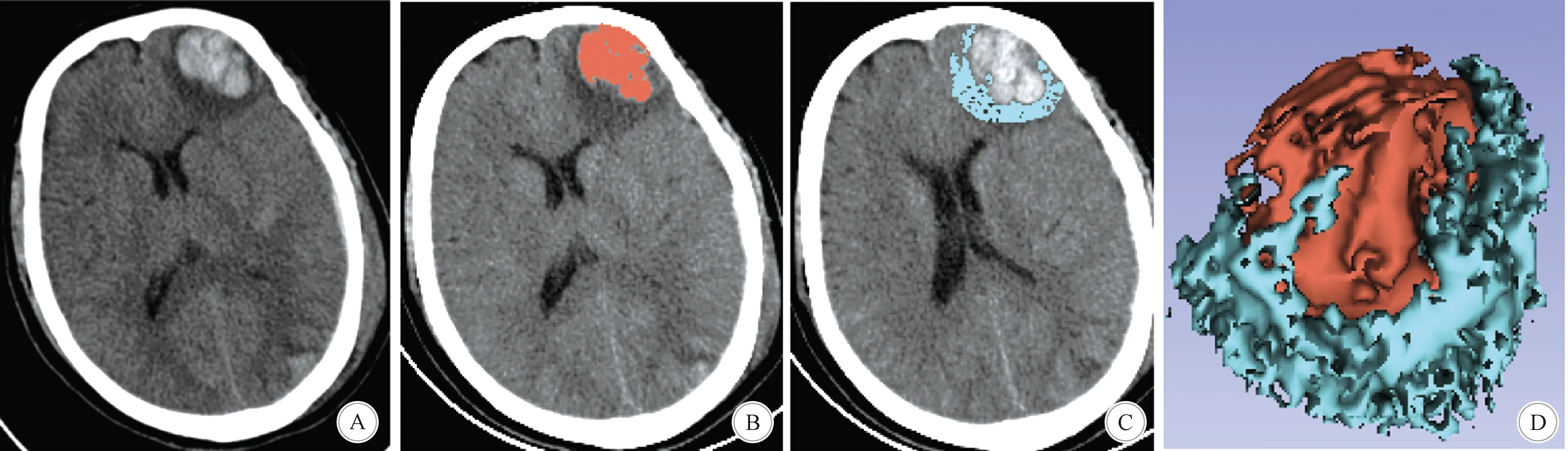
A:左侧额叶脑挫裂伤灶; B:血肿重建染成暗红色; C:周围水肿重建染成蓝色; D:将血肿与水肿重建出3D模型

2 结 果
2.1 脑挫裂伤灶周围脑组织水肿情况 应用3D-Slicer软件计算脑挫伤灶及周围脑组织水肿体积(图1、2)。伤后6 h内GCS评分、脑挫裂伤灶体积、Hct、Fg、D-D差异无统计学意义(表1);伤后第5 d周围脑组织水肿程度静脉组明显高于非静脉组,P=0.002(表2)。伤第5 d两组的Hct、Fg、D-D无统计差异(表2);但伤后6 h与第5 d的Fg、D-D有明显的统计差异性,Hct无明显差异(表3)。
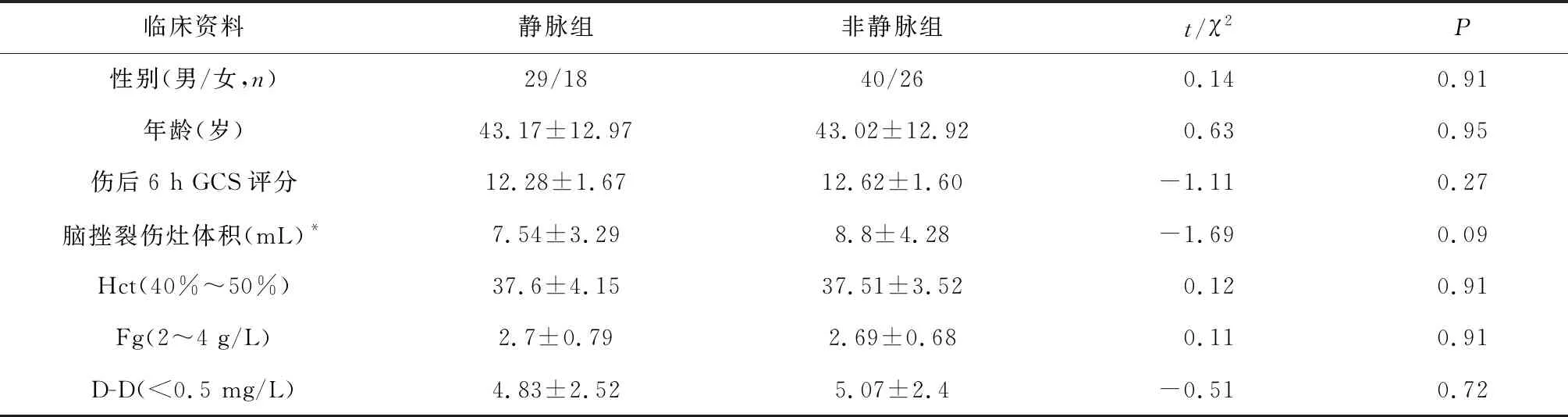
表1 两组病例的临床资料

表2 两组病例伤后第5 d相关资料

表3 两组病例伤后6 h内与第5 d检验结果比较
2.2 进展病例数 静脉组与非静脉组的进展病例数分别为12例和15例,差异无统计学意义(P=0.80);进展后手术例数分别为7例和11例,差异无统计学意义(P=0.73)(表2)。
3 讨 论
脑水肿和颅内高压是TBI致死和致残的主要原因,TBI后近期表现主要是中枢神经系统实质细胞的反应,损伤的脑组织进一步释放出缓激肽、脂肪酸、自由基、5-羟色胺、前列腺素、一氧化氮等介导血脑屏障(blood brain barrier,BBB)开放,血管通透性增加,大分子物质即从血管内渗出,导致血管源性水肿形成[9]。这种水肿主要是脑组织的间质性水肿,常并发脑梗死,进行性加重的脑水肿致脑容积增加、颅内压升高、脑血流量降低,Veenith等[10]联合应用O15及18F-FMISO标记的PET-CT技术,分别观测正常人与TBI患者的缺血性脑容积、缺氧性脑容积,结果发现TBI患者脑组织缺氧区域的氧扩散梯度增加。证实在大血管血流正常情况下,TBI后脑组织缺氧是由微血管缺血所致,这与外伤后广泛微血管塌陷、血管周围水肿及微血栓形成有关。两组病例中,静脉组水肿比例明显高于非静脉组,可见静脉回流障碍可能是脑损伤后局部脑水肿程度高低的重要因素。同时有许多研究表明血管生成可能有助于脑卒中、TBI和脊髓损伤后的恢复[11],血管新生是指在原有血管上以芽生形式形成新血管的过程,成年人的脉管系统在生理状况下极为稳定,但当遭受到譬如脑外伤等外来因素影响时,此过程则显得非常活跃[12-13]。成年血管重构包括成熟内皮细胞的血管生成和内皮祖细胞的血管生成,血管生成可能在TBI后的功能恢复中起重要作用[14-15]。
Sillesen等[16]用典型的脑液压创伤模型发现无论是脑损伤还是脑出血,血小板的激活和功能障碍都是在脑损伤后3 min就出现,相应的凝血因子反应,交感肾上腺系统及补体反应几乎同时出现,而内皮细胞障碍、炎症反应及血栓形成是相继发生的。影响微循环障碍的因素有:(1)微循环脑血流减少;(2)微血管收缩,而脑实质外的大血管不见收缩等变化;(3)微血栓形成[17-18]。而 Stein等[19]发现微血栓形成在颅脑损伤后2~3 h就开始出现,在 24 h可以形成60%的微血管闭塞,部位多位于同侧外伤区外围。所以,继发性脑损害的焦点是微血栓形成所致的脑微循环改变,患者的尸检报告同样证实了这一点[20]。根据两组对比水肿的差异性,静脉组脑挫裂伤后水肿比率明显高于非静脉组,进一步说明静脉回流障碍是脑水肿的关键因素之一。Hct是影响血液黏度的主要因素,随着Hct的增加,血液黏度迅速增高,反之则降低[21-22]。TBI的血液流变学研究表明,血细胞比容的降低并不被认为是有害的,它甚至可以改善局部微循环,优化血液流变学;然而,通过产生剪应力、维持供氧能力和激活代偿机制,维持血液粘度可能是微血管灌注的重要因素;所以,Hct可以作为判断颅脑损伤的实验室指标之一。研究观察中发现,Hct在轻、重度颅脑损伤患者组内不同时间内是有差异的,重度组检测值明显高于轻度组,在一定范围内与GCS评分呈负相关,差异有统计学意义[23]。本研究所有病例均为单纯TBI患者,且大部分为轻中型颅脑损伤,入院后6 h内与第5 d的值变化不大,且无统计意义。血清Fg水平是影响血浆粘滞度的重要因素,Fg增加能使血液中的细胞更容易聚集,是增加红细胞聚集性的重要指标之一。脑组织含有丰富的凝血酶,TBI后很多凝血类物质释放到血液中去,激发外源性凝血系统。Fg联合形成纤维蛋白,相应的纤容系统也同时被激活,使纤维蛋白降解,保持动态平衡,故血液中D-D浓度升高[24]。D-D是一种可溶性纤维蛋白降解产物,由纤维蛋白溶解系统对血栓进行有序分解而形成。D-D是纤维蛋白形成和降解的生物标志物,可以在全血或血浆中检测到。健康人血液中的D-D含量较低,而在血栓形成的情况下D-D含量较高。D-D还被用于确定静脉血栓患者抗凝的最佳持续时间,用于诊断和监测弥散性血管内凝血,以及确定静脉血栓高危患者[25]。本研究病例入科后6 h内的Fg值位于正常值的下线水平,D-D明显升高,第5 d的Fg值稍高于正常值,D-D较前明显下降,符合轻-中型颅脑损伤凝血功能变化规律[26]。
脑挫裂伤的出血性进展(hemorrhagic progression of contusions,HPCs)是TBI预后不良重要因素,发生率从18%~51%不等,蛛网膜下腔出血、硬膜下血肿及颅骨骨折是主要的风险因素,HPCs的定义标准也不一。本研究采用与初始CT相比,病灶体积相对增加≥30%,及脑挫裂伤灶体积绝对增加≥10 mL的标准[27]。本研究两组病例均有进展及达到手术指征的病例,但差异无统计学意义,可能与入组患者为轻-中型颅脑损伤有关。
本研究存在为单中心回顾性研究且样本量有限、纳入病例基本为轻-中型TBI、无法代表重型及特重型TBI等缺陷性,且无法很好地排除血压、血糖等因素的影像;将来,期待多中心大样本前瞻性研究,进一步分析脑挫裂伤后周围脑组织水肿的关键因素。总之,TBI的预后取决于原发伤及继发伤的程度,脑水肿是TBI必然发生的继发性损伤,引起脑水肿的因素众多,静脉循环障碍可能是决定脑水肿程度高低的关键因素之一。
利益冲突:所有作者均声明不存在利益冲突。
