响应性壳聚糖微球的研究
2022-05-10赵彤瑶常琳琳王莉娟刘亚洁曹金城宫玉梅
赵彤瑶,常琳琳,王莉娟,刘亚洁,曹金城,宫玉梅
(大连工业大学纺织与材料工程学院,辽宁 大连 116034)
1 前 言
响应性聚合物是近年发展的一类新型功能高分子材料[1],是一种对环境可感知且可响应的新材料[2]。响应性材料的存在形式有很多,包括纳米粒子、膜、凝胶、纤维、微胶囊、溶液等,其在药物控释材料、组织工程、吸附剂、化学和生物传感器、物质分离等多个领域有潜在的应用价值[3]。壳聚糖(Chitosan, CS)是甲壳类动物如虾、蟹外壳中甲壳素脱乙酰化的衍生物[4, 5],是自然界中广泛存在的唯一碱性多糖,生物相容性好、生物粘附性强、可生物降解,在利用价值和自然界储量方面被认为是仅次于纤维素的生物材料[6, 7],具有止血、抑菌、抗癌、抗氧化等多种生理功能[8, 9]。以壳聚糖为基体的响应性微球兼具壳聚糖优异的生物特性和特殊的响应性功能。本文综述了pH、温度、磁以及多重响应性壳聚糖微球的制备方法以及在不同领域的应用研究进展。
2 响应性壳聚糖微球
2.1 pH响应性壳聚糖微球
智能可控释放材料因具有多种潜在的用途而引起了人们广泛的关注和研究,其中具有pH响应性的智能材料被认为是较易获得并对外界环境刺激响应较敏感的一类智能响应性材料[10]。pH响应性壳聚糖微球是指壳聚糖微球的某些性能会随着周围介质pH值的改变而改变。壳聚糖分子中氨基(—NH2)和羧基(—COOH)的酸度系数分别约为6.5和2.9,表征发现在pH=2.5~6.6的介质中,壳聚糖分子上的—NH2会发生质子化而出现溶胀现象[11],具有包覆材料的性能,所以壳聚糖及其衍生物常被应用于pH响应的纳米载体[12-18]。pH响应性壳聚糖微球通常是在壳聚糖大分子骨架上连接可电离或者缔合的酸性基团或碱性基团[19],如—NH2、—COOH和酰胺(—CONH)等较弱的酸碱基团,能根据外界环境pH的变化做出溶解度、体积和链结构等不同程度的响应。
丙烯酸类物质的分子间作用力随pH值的变化而变化,从而造成物理结构的改变,由此可以对药物分子起到间接的物理包封和开关作用[20, 21]。林英等[22]以壳聚糖为模板引发丙烯酸进行自由基溶液聚合,随着转化率的提高,壳聚糖和聚丙烯酸可逐渐自组装形成带相反电荷的疏水聚电解质壳聚糖/聚丙烯酸(CS/PAA)。CS/PAA在水中收缩成核,表面由亲水性壳聚糖包裹成壳层,形成生物相容且具有降解性的CS/PAA纳米微球,并对CS/PAA纳米微球的结构和性质进行研究。如图1所示,当环境的pH值小于7时,CS/PAA纳米微球表面呈大量—COO-;而当环境的pH值大于8时,CS/PAA纳米微球表面呈大量—NH2,因此该纳米微球具有pH响应性并在较宽的范围内稳定。这些表面活性基团使CS/PAA纳米微球在污水处理方面具有潜在的应用价值。CS/PAA纳米微球上携带的—NH2和—OH可以通过孤对电子与Ni2+等重金属离子配位,而—COOH以静电配位的方式吸附Ni2+等重金属离子[23]。该方法制得的CS/PAA纳米微球用于净化污水时,是一种由—COOH主导、—NH2和—OH辅助的多位点高效吸附剂,纳米微球可以通过物理、化学作用与重金属离子结合,从而将其从水中去除,达到净化污水的目的。因此,在水处理方面,pH响应性壳聚糖微球的优点在于其纳米尺寸增加了其去除重金属离子的能力,其pH响应性扩大了其污水处理的环境范围。
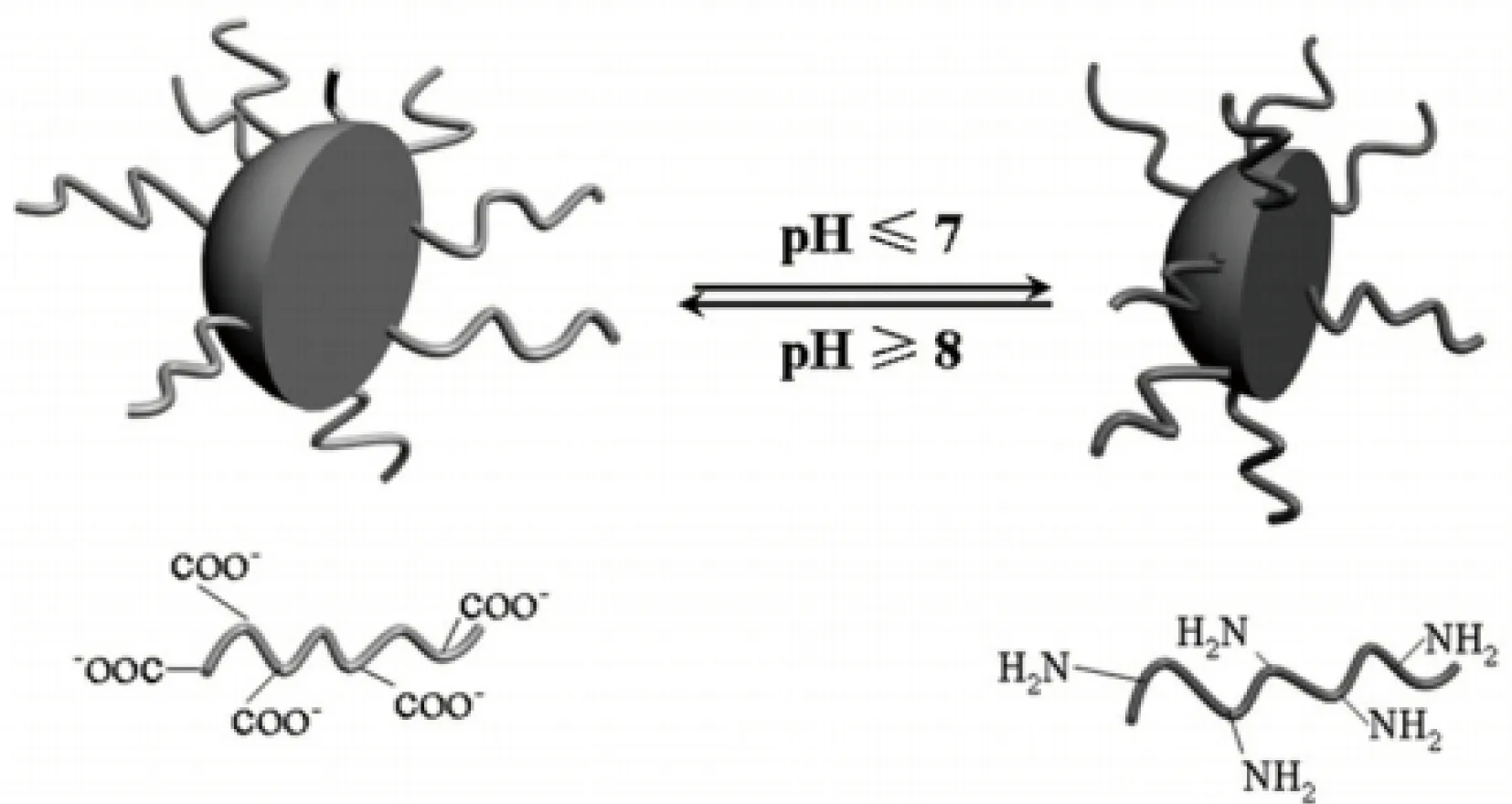
图1 pH值诱导的壳聚糖纳米微球表面结构转变[22]Fig.1 Surface structure transformation of pH-induced chitosan nanoparticle[22]
另外,γ-谷氨酸(γ-PGA)是一种天然存在的无毒无害的高分子材料,由革兰氏阳性细菌产生,由于其细胞具有亲和性良好、无毒无害、易降解的优点,已成功应用于食品和污水处理行业,此外在医药领域作为药物载体方面的研究尤为广泛[24-27]。任东雪等[28]利用γ-PGA与壳聚糖之间温和的静电作用力使其自组装制备了带正、负表面电荷的纳米载体壳聚糖/γ-PGA,并将其应用于包载药物分子阿莫西林,对2种表面分别带正、负电荷的载药纳米颗粒γ-PGA-CS-A(+)和γ-PGA-CS-A(-)在pH响应控释药物方面进行研究。如图2所示,微球粒径随pH值升高而增大,表现出典型的pH响应性。并测定了不同pH环境下载药的壳聚糖微球对牛血清蛋白(BSA)的吸附能力,如图3所示。当pH=2.5时,γ-PGA-CS-A(+)和γ-PGA-CS-A(-)的蛋白吸附率都接近于0,这是因为在酸性条件下,γ-PGA-CS-A(+)、γ-PGA-CS-A(-)和BSA都带正电荷,它们相互排斥使蛋白吸附率接近于0;当pH=7.4时,纳米粒子γ-PGA-CS-A(+)的蛋白吸附率平均达到25%,有利于载药纳米颗粒与肠道细胞膜结合。通过将壳聚糖纳米粒子的尺寸优势与pH敏感性对增强肽类药物口服给药的有益作用相结合,使载药后的pH响应性壳聚糖微球对肠道细菌的抑制效果比游离药物更好。

图2 γ-PGA-CS-A的粒径、电位和分散指数[28]:(a) γ-PGA-CS-A(+), (b) γ-PGA-CS-A(-)Fig.2 Particle size,potential and dispersion index of γ-PGA-CS-A[28]:(a) γ-PGA-CS-A(+), (b) γ-PGA-CS-A(-)

图3 不同pH环境下γ-PGA-CS-A的蛋白吸附率[28]:(a) γ-PGA-CS-A(+), (b) γ-PGA-CS-A(-)Fig.3 Protein adsorption rate of γ-PGA-CS-A under different pH conditions[28]:(a) γ-PGA-CS-A(+), (b) γ-PGA-CS-A(-)
Nakhlef等[29]将壳聚糖与羟丙基甲基纤维素邻苯二甲酸酯(HPMCP)进行离子交联,制备了一种可以用于胰岛素输送的pH响应性壳聚糖纳米颗粒CS/HPMCP NPs,体外结果显示,该纳米颗粒具有优异的酸稳定性,在有无胃蛋白酶的模拟酸性条件下,对胰岛素释放和降解都具有显著的控制能力。经口服给药后,载有胰岛素的CS/HPMCP NPs与口服胰岛素溶液和载有胰岛素的CS/三聚磷酸盐(TPP)NPs相比,降血糖作用分别提高了9.8和2.8倍以上。总之,由于pH响应性壳聚糖微球具有绿色环保、良好的生物相容性、能够作用于药物并提高药效、实现对人体用药的可控释放的优点,是一种有应用价值和研究意义的纳米药物微球。
2.2 温度响应性壳聚糖微球
温敏材料是指对温度刺激有响应的材料,主要分为天然温敏材料和合成温敏材料,合成的温敏材料一般都是由大分子主链和亲水、疏水基团组成[30]。壳聚糖本身并没有温敏特性,通过在其分子链上接枝温敏基团如N-异丙基丙烯酰胺(NIPAAm)等,即可就被赋予温度响应性能。
Chuang等[31]将壳聚糖和N-异丙基丙烯酰胺进行单体聚合,合成了壳聚糖-g-N-异丙基丙烯酰胺(CS-g-PNIPAAm)共聚物,其制备原理如图4所示。单体聚合后,在40 ℃下将CS-g-PNIPAAm共聚物自组装,使用交联剂增强结构制备出中空多孔结构的纳米粒子,并研究了纳米粒子的结构、形态、粒径、表面电荷、温度响应特性以及体外药物释放特性。如图5所示,随着温度的升高,PNIPAAm聚合物链中亲酸性链段间的亲质子性作用增强、氢键作用减弱,使得纳米粒子收缩导致粒径减小,即具有温度响应性。这种具有温度敏感性的多孔/空心颗粒有望应用于亲水性药物输送系统。

图4 CS-g-PNIPAAm共聚物的制备原理示意图[31]Fig.4 Schematic diagram of preparation of CS-g-PNIPAAm copolymer[31]

图5 在不同温度下浸入缓冲溶液后CS-PNIPAAm平均直径的变化[31]Fig.5 Average diameter change of the CS-PNIPAAm after being immersed in buffer solution at different temperatures[31]
郭旭虹等[32]发明了一种基于壳聚糖的温度响应性纳米粒子,利用疏水改性剂邻苯二甲酸酐对壳聚糖主链上的氨基进行化学改性,得到含有疏水基团的油溶性壳聚糖。再将温敏性聚合物单体乙烯基己内酰胺接枝到壳聚糖的主链上,该材料可以包覆油溶性物质再进行自组装,形成稳定胶束。因此,温度响应性壳聚糖微球能够有效负载疏水性药物,通过调控环境温度,实现负载于颗粒内部油溶性物质的可控释放,其在药物载体,尤其是药物的可控输送方面具有极大的开发前景和应用价值。
2.3 磁响应性壳聚糖微球
磁性高分子微球是由磁性颗粒和聚合物复合而成的一种新型复合功能高分子材料,由于其兼具高分子材料的特性和无机纳米颗粒的磁响应性,更具有“在外加磁场下定向运动”的特殊性能,在靶向给药、生物化学、固定化酶、细胞分离、电磁屏蔽、磁共振造影、吸波材料、水处理等诸多领域展现出广阔的应用前景[33-41]。
磁性壳聚糖具有优异的生物相容性、生物降解性和无毒性,不会引起过敏和排斥反应,而且不会损害药物的磁性靶向性,可以作为有效的药物传递体系。Unsoy等[42]利用壳聚糖包覆磁性纳米颗粒Fe3O4,在磁场下将药物阿霉素(DOX)靶向递送到肿瘤部位,探究载有DOX的纳米颗粒的最佳加载效率、稳定性和释放曲线。如图6所示,负载DOX的壳聚糖纳米颗粒(CS MNP)对DOX抗性MCF-7细胞的毒性,比游离DOX高13倍。这些结果证实了CS MNP负载和释放的DOX是活性的,并且磁性壳聚糖微球使MCF-7/DOX细胞克服了对DOX的抗性。

图6 DOX和载有DOX的CS MNP对MCF-7和MCF-7/DOX的功效比较[42]Fig.6 Comparison of the efficacy of DOX and DOX loaded CS MNP on MCF-7 and MCF-7/DOX[42]
壳聚糖上活泼的—OH和—NH2基团可以与许多金属离子或有机物结合,因此磁性壳聚糖微球也常被应用于污水处理。如Chang等[43]以Fe3O4纳米颗粒为核、羧甲基化壳聚糖为离子交换基团制备了一种磁性纳米吸附剂,该纳米吸附剂可快速吸附Cu2+、Co2+和酸性染料。如图7所示,微球的磁滞很弱,表示磁性纳米吸附剂的磁性很好,几乎为超顺磁性。图7内插图是磁化强度(M)和磁场强度(H)及其在原点附近的放大图,可以看到该磁性壳聚糖纳米颗粒的饱和磁化强度(Ms)、剩余磁化强度(Mr)、矫顽力(Hc)和矩形度(Sr=Mr/Ms)分别为62 emu/g、1.8 emu/g、6.0 Oe和0.029。
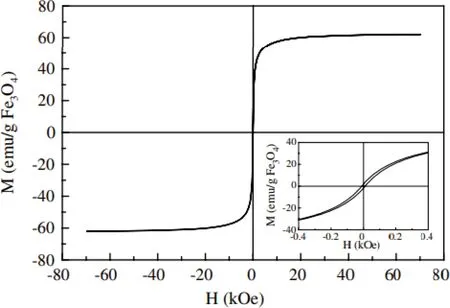
图7 磁性壳聚糖纳米颗粒的磁化强度与磁场的关系[43]Fig.7 Relationship between magnetization of magnetic chitosan nanoparticles and magnetic field[43]
固定化酶是一种利用物理或化学手段将游离的酶固定并锁住使之在一定范围或空间内起作用的技术,固定化酶的载体选择尤为重要。将磁性高分子微球作为固定化酶的载体具有以下优点:① 反应体系中的固定化酶易于分离和回收;② 操作简便;③ 在双酶反应体系中,可以通过磁性材料固载失活更快的酶,使其不易失活;④ 磁性材料方便回收,能够实现再利用,降低成本;⑤ 能够在磁场稳定的流动床反应器中工作,适合大规模连续化作业;⑥ 改变外部磁场可以控制磁性材料固定化酶的运动方式和方向,与传统机械搅拌相比提高了固定化酶的催化效率[44, 45]。Peniche等[46]利用悬浮交联方法将具有磁性的铁包封在壳聚糖上,制备出超顺磁性壳聚糖微球。微球的平均尺寸取决于制备参数,如表面活性剂浓度、搅拌速率、壳聚糖溶液浓度和交联剂的用量等。超顺磁性壳聚糖微球适用于固定化酶,固定在这些微球上的酪氨酸酶比游离酶具有更高的稳定性,并在重复使用10个循环后仍能保持较高的酶氧化活性。
2.4 多重响应性壳聚糖微球
随着人们对智能功能性材料的功能需求日益增多,传统的单一响应性材料已经无法满足人们的需求,因此制备具有多重响应性的聚合物微球已成为目前智能材料的重要研究方向之一。
2.4.1 温度和pH双重响应性壳聚糖微球
温度和pH双重响应性壳聚糖微球具有温度和pH双重响应特性,改变温度和pH值两者中的任意一个变量都会引起壳聚糖微球的变化。赵婧等[47]将温敏型单体N-异丙基丙晞酰胺(NIPAm)和含有阴离子基团的单体2-丙烯酰胺基-2-甲基丙磺酸(AMPS)进行自由基共聚,制备了温度敏感型聚合物poly(NIPAm-co-AMPS)。再利用其与壳聚糖之间的静电相互作用形成纳米颗粒poly(NIPAm-co-AMPS)/CS,并对其pH和温度响应行为进行了研究。当聚合物溶液的pH值为6,聚阳离子和聚阴离子质量比为3∶2时,可以形成粒径为200 nm左右的纳米颗粒。如图8所示,当温度在34~38 ℃之间时,纳米颗粒的粒径发生突变,从300增大至700 nm。该方法制备的温度和pH双重响应性壳聚糖微球毒性等级为0-1级,符合生物医用材料的基本要求。
2.4.2 pH和磁双重响应性壳聚糖微球
pH和磁双重响应性壳聚糖微球作为药物载体可以通过改变环境的pH值进行药物可控释放、通过磁响应进行靶向运输,从而实现了药物的载入、靶向运输以及可控释放,使药物更加高效精准地作用于靶处。郝和群等[48]利用胆酸(CA)对O-羧甲基壳聚糖(O-CMC)进行化学修饰,因为O-CMC上的—NH2、—COOH、—OH等基团可以和CA发生反应,故制备出O-羧甲基壳聚糖-胆酸(O-CMC-CA)共价复合物。这种共价复合物可以将脂溶性分子包埋在其疏水的核中,纳米颗粒表面亲水的壳在水中组成胶束。利用反溶剂法把Fe3O4和DOX包埋在O-CMC-CA疏水的核中,制备出疏水修饰的磁性壳聚糖载药纳米颗粒(DOX/Fe3O4/O-CMC-CA),并对其形貌、磁性和药物缓释特性等进行表征测试。由图9a可知,DOX/Fe3O4/O-CMC-CA在室温下表现出零矫顽力和零剩余磁化强度,说明其具有超顺磁性。由图9b可知,不同pH环境下DOX/Fe3O4/O-CMC-CA释放DOX的速率不同,pH=5.0时纳米颗粒的释放速率比pH=7.4环境慢,释放行为具有缓释效果,说明DOX/Fe3O4/O-CMC-CA纳米颗粒具有一定的pH响应性。综上,制备的DOX/Fe3O4/O-CMC-CA纳米颗粒具有双重响应性,可以有效地输送DOX到靶位(即肿瘤组织)。
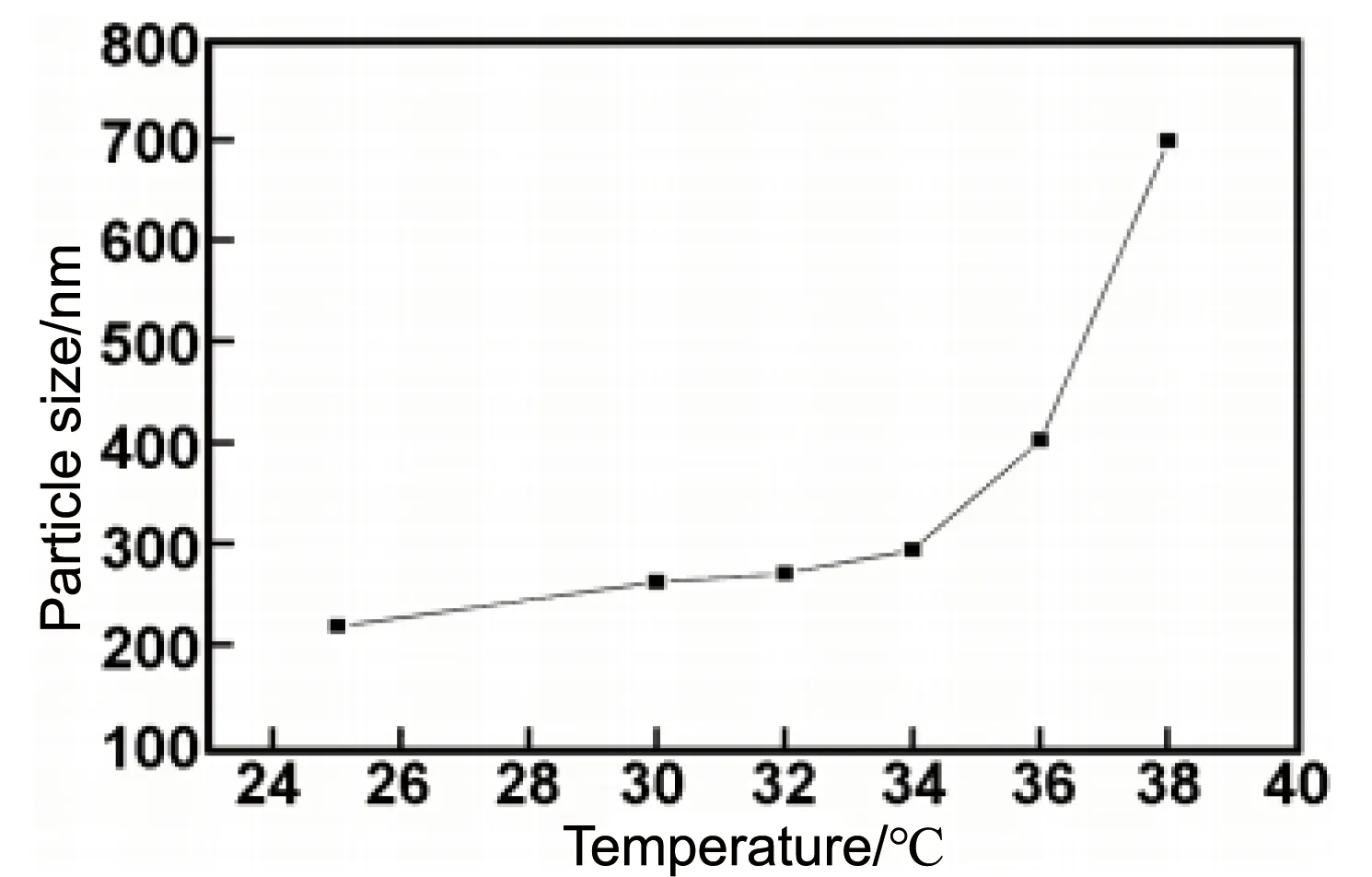
图8 Poly(NIPAm-co-AMPS)/CS在不同温度下的粒径及其分布[47]Fig.8 Nanoparticles size and distribution of the Poly(NIPAm-co-AMPS)/CS at different temperatures[47]
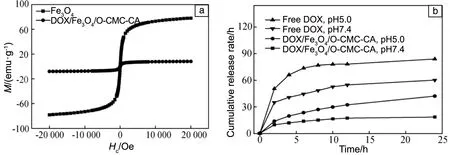
图9 DOX/Fe3O4/O-CMC-CA的磁滞曲线(a)和体外累积释放情况(b)[48]Fig.9 Hysteresis curves (a) and cumulative release in vitro(b) of the DOX/Fe3O4/O-CMC-CA [48]
3 结 语
壳聚糖由于具有优异的生物相容性、可降解性以及来源广泛、对环境友好、价格低廉等优点,近年来得到了科研工作者的广泛关注,在生物、医学、水处理、食品包装等领域均有应用。特别是在医学领域,作为载药微球,响应性壳聚糖微球由于具有优异的生物相容性和抗菌性等,故可改变药物在人体的分布情况,提高药物的生物利用度,实现药物的载入和可控释放。随着对药物载体功能要求的日益提高,刺激响应性微球作为载体材料逐渐成为药物微球领域的研究热点。响应性的差异也给壳聚糖微球带来了功能各异性,如具有磁响应性的壳聚糖微球被广泛应用于电磁屏蔽、磁共振造影、吸波材料、水处理等领域;具有pH响应性的壳聚糖微球被广泛应用于水处理和金属回收等领域。与单一的壳聚糖微球相比,响应性壳聚糖微球综合了壳聚糖的优点以及响应性材料的特殊功能。作为药物载体,利用响应性壳聚糖微球pH响应、温度响应、磁响应的特点在外部环境的作用下实现物理化学导向,通过环境条件的变化实现可控释放,在特定的范围达到速效性。根据患者的身体差异,可以实现药物的可控释放,对靶位靶向给药,达到精准治疗的效果。但对于药物载体材料来说,这些性能是远远不够的,还需要具有低毒性、理化稳定性、生物稳定性和较高的载药性。因此,制备响应性壳聚糖微球作为药物载体还需要进一步的研究和测试表征,需要在实际应用中对材料进行改进。随着人们对智能功能性材料的需求日益增大,响应性壳聚糖微球吸引了越来越多领域的研究人员的兴趣,有望取得丰硕的研究成果并应用于实践。
