核壳型纳米Au@Ag复合材料的制备、催化及光抑菌*
2022-05-09刘智峰郭少波季晓晖
刘智峰,房 迅,郭少波,汤 波,季晓晖
(1. 陕西理工大学 化学与环境科学学院,陕西 汉中 723001;2.陕西省催化基础与应用重点实验室,陕西 汉中 723001;3. 秦巴生物资源与生态环境国家重点实验室,陕西 汉中 723001)
0 引 言
贵金属金(Au)、银(Ag)纳米颗粒具有丰富的表面等离子共振、强消光系数、高生物相容性和化学稳定性等优点被广泛应用于生物医药、生物影像、医用材料、催化等领域[1-3]。纳米Au、Ag颗粒吸收近红外光谱后表面电子产生共振而具备局域热效应,且局域电子跃迁,易与介质溶液结合生成强氧化物或超氧化物(ROS)而具备杀菌活性,Au、Ag抑菌性能也与释放的Au+、Ag+粒子有关[4-6],细菌粒子通道中的铜离子通道蛋白可主动运输Au+和Ag+(Cu+作为细菌的微量元素,且Au+和Ag+的d电子轨道与其相似),Au+、Ag+粒子进入细菌内部,和氨基酸中的-SH配位生成螯合物,不可逆的破坏功能蛋白的空间结构或改变新陈代谢所需的液质环境致使细菌死亡;其次,微量的Au、Ag进入细菌内部与细胞质反应生成活性氧簇(ROS),活性氧簇可直接作用细胞器对细菌造成根本性破坏且不产生耐药性[7-9]。但由于纳米Au颗粒第一电离能较高,在介质中释放的Au+较少,因此抑菌活性较低,而Ag的抑菌性能与比表面积有关,比表面积越大抑菌性能越强,但比表面积越大表面能越高,Ag越易团聚而降低其抑菌活性,且纳米Ag在空气中易氧化等缺点限制Au、Ag的应用。为充分利用Au、Ag的相关性能,目前解决方案之一[10-11]是利用纳米Au的可塑性把Ag负载在其表面合成核壳型Au@Ag复合材料,其结果表明,核壳型Au@Ag吸收近红外谱后,Au核表面的电子发生共振,Ag接受电子在其表面形成负环境可增强Ag的稳定性,Au@Ag吸收可见光后局域热效应诱导周围环境温度升高,此作用可为癌细胞的灭活和增强对细菌的抑制提供新思路,且核壳型Au@Ag可增大Ag的比表面积,防止Ag团聚。
Au、Ag颗粒的催化加氢性能与自身电子结构相关,其表面的电子具有缺陷位,容易与氧原子形成共价键、利于形成“活性中间体”或“过渡中间态”而具备催化性能,但催化活性与电子d轨道的排布有关,Pd为重要的催化剂其d轨道具有9电子,易于吸附和脱附氢原子而具有较强的催化性能,但其价格昂贵,成本较高不利于大规模应用[12]。有学者报道[13],将Pd与Au、Ag贵金属复合成合金,可有效降低其电子密度,提高对氢原子的吸附和脱附性能而增益其催化活性。理论上将Ag、Au复合不仅可提高其催化性能,且利用其吸收近红外光谱提高局域温度增强其抑菌性能,而对此类双重性能的研究未曾报道。为此,本研究以Au为核,在其表面负载Ag合成核壳型纳米Au@Ag复合材料,以甲基橙为模型污染物研究其催化加氢活性,用革兰氏阴性菌大肠杆菌(E.coli)和革兰氏阳性菌金黄色葡萄球菌(S.aureus)为模型菌研究材料的光动力抑菌性能,并探讨其抑菌机制。
1 实 验
1.1 试剂和仪器
一缩二乙二醇、硫氢化钠(NaHS)、三氟醋酸银(CF3COOAg)、盐酸(HCl)等均为市售分析纯购自于天津市大茂化学试剂厂;聚乙烯吡咯烷酮 K30(PVP)、丙酮、柠檬酸钠、抗坏血酸和甲基橙购自于天津市致远化学试剂有限公司;AgNO3、NaOH和NaBH4购自于广州市鑫铂化工有限公司;HAuCl4购自上海吉至生化科技有限公司;酵母浸粉、胰蛋白胨和琼脂购自上海展云化工有限公司。E.coli和S.aureus均由陕西省食用菌研究所提供。
FEI Tecnai G2 F20型透射电子显微镜(TEM,荷兰FEI公司);紫外-可见漫反射吸收光谱(Cray 100);YXQ-50G干燥型立式蒸汽高压消毒锅(浙江,中友公司);ZGZ-150A型智能光照培养箱(上海丙林电子科技有限公司); C80混合反应微量热仪(法国塞塔拉姆(Setaram)公司);奥林巴斯倒置显微镜CKX41。
1.2 纳米Ag颗粒的制备:
取100 mL的一缩二乙二醇加入到250 mL烧瓶中150 ℃加热30 min,再加入1.2 mL 3 mmoL NaHS,搅拌10 min,继续滴入10 mL 3 mmoL HCl与25 mL 20 mg/mL 的PVP(以上溶剂均为一缩二乙二醇),加热至150 ℃搅拌10 min,最后滴加8 mL 282 mmoL CF3COOAg 150 ℃反应30 min得到纳米Ag溶胶,冰水浴中冷却终止反应[14],用丙酮在离心机15000 r/min下洗涤3次,0.5%柠檬酸钠洗涤2次,真空干燥箱中烘干备用。
1.3 纳米Au@Ag的制备:
1.3.1 纳米Au颗粒的制备:
将2 mL 25 mmoL/L的HAuCl4滴加在100 mL超纯水中煮沸20 min,其次加入10 mL 75 mmol/L的柠檬酸钠,100 ℃反应25 min得到纳米Au溶胶[15],在2 ℃冰箱中冷藏2 h备用。
1.3.2 纳米Au@Ag颗粒的制备:
取上述纳米Au溶胶50 mL,分别加入300 μL的抗坏血酸(0.1 moL/L),75 μL的AgNO3和375 μL的NaOH反应30 min,在离心机12 000 r/min下蒸馏水洗涤3次,0.5%柠檬酸钠洗涤2次烘干备用。
1.4 纳米Au@Ag颗粒的催化实验:
因为甲基橙在紫外可见光处有特征吸收峰,且吸收峰的强弱和浓度呈正比,因此,本实验以甲基橙为目标污染物,用NaBH4还原甲基橙监测纳米Au@Ag颗粒的催化活性。取甲基橙浓度0.25 mmol/L的溶液1 mL和2 mL 0.02 mol/L NaBH4加入比色皿中,最后加入0.5 mg/mL催化剂0.2 mL,在波长范围为200 nm~800 nm 下,间隔2 min监测465 nm处吸光度的变化[16],按照以下公式计算降解率R。
式中:R为降解率;C0为初始浓度;C为残留浓度。
1.5 纳米Au@Ag颗粒的抑菌实验:
1.5.1 滤纸片扩散实验
将生物材料放置于120 ℃高压灭菌锅20 min作杀菌处理,用无菌的纳米Au、Ag和Au@Ag颗粒分散在灭过菌的超纯水中,制备成浓度为100,200,300和400 μg/mL的梯度的溶液。将隔夜活化好的细菌用无菌超纯水稀释成5×107CFU (colony-forming units)/mL,取20 μL均匀涂在灭过菌的固体LB培养基上,取8 μL沾有不同材料的抑菌液放置在接过菌的LB培养基上分别在在黑暗和光照下培养12 h平行做6组观察结果[17]
1.5.2 菌落计数法实验
将纳米材料加入到5×105CFU/mL菌悬液中,最终Au@Ag质量浓度为300 μg/mL,分别在300 W的日光灯在照射5 、10、20和40 min,8 000 r/min 离心取上层液10 μL均匀涂在灭过菌的固体LB培养基上,平行做6组,正常培养12 h后观察结果[18],抑菌效率(n)为
式中:n代表抑菌效率,B0为参照中菌落个数,B是含有不同材料的抑菌结果菌落数。
1.5.3 细菌生长曲线监测法实验
将材料和接过菌的液体LB培养基混合配成5 mL溶液, 最终细菌浓度为5×107CFU,材料浓度为300 μg/mL,日光灯下照射10 min后加入微量热分析仪中,37 ℃下监测细菌的生长和热量释放强度。
1.5.4 细菌PI染色法实验
将上述混合液在日光灯下照射10 min,加入50 μg/mL的碘化丙啶(PI) 50 μL黑暗环境下混合15 min,在13 000 r/min的离心机下,用磷酸缓冲液洗涤3次,在荧光倒置显微镜下观察细菌的损伤情况[19]。
2 实验结果与讨论
2.1 复合材料TEM表征
纳米Au@Ag复合材料的形貌测试结果如图1所示。由图1(a,b)可知,制备的纳米Au@Ag复合材料为单分散核壳球型结构,内球Au的粒径为(10±5)nm,外球Ag厚度为(5±3)nm,而图1(c,d)纳米Ag粒子为单分散颗粒状,粒径为(15±3)nm,粒径分布较均匀,形貌不规则,其主要原因是纳米Ag颗粒在空气中不稳定(E(Ag+/Ag)=0.80 V),导致其形貌不规则,相比纳米Ag粒子,纳米Au@Ag理论上更加稳定,其原因是纳米Ag的标准还原电势小于Au,纳米Au与Ag复合,Ag电子流向Au而增强Au的稳定性,且在近红外光照射下,纳米Au中的电子跃迁至纳米Ag表面,致使纳米Ag表面形成负环境而降低复合材料的电子云密度[20],因此制备的纳米Au@Ag材料更加稳定。为进一步证明其合成材料为核壳结构,对复合材料进行了EDX能谱分析和EDX面扫描元素分布(mapping)表征。图2为制备的Au@Ag复合材料对应mapping图谱.由图2可知,材料含有Au、Ag两种元素,其中Ag元素为壳,为内空球型结构,元素Au为球核,证明合成的Au@Ag为核壳球型结构,这与TEM的结果一致。

图2 Ag@Ag样品的元素的面分布图像Fig 2 EDX spectrum images of Ag@Ag samples
2.2 复合材料UV-Vis表征
图3为样品的UV-Vis吸收光谱,图中制备的纳米Au和Ag在525 和400 nm处有明显吸收峰,分别对应单质Au和Ag的特征吸收峰[21],而纳米Au@Ag在525和400 nm处均出现吸收峰,证明制备的材料中同时具有单质Au和Ag。图中未出现其他杂峰,证明合成的材料纯度较高,结合TEM结果证明制备的Au@Ag均以单质形态存在。

图3 样品Au,Ag和Au@Ag的紫外-可见吸收光谱Fig 3 UV-Vis absorption spectra of Au, Ag and Au@Ag samples
2.3 复合材料催化活性
图4为Au、Ag和Au@Ag对甲基橙的催化加氢降解测试结果。图4a中甲基橙的峰面积(或吸光度)随着催化时间的增加而降低,此为Au对甲基橙的降解过程,在20 min内催化降解率(以初始浓度为参比)为41.25%,图4b为纳米Ag的催化降解过程,在20 min内降解率为45.12%,而图4c中纳米Au@Ag在8 min内对甲基橙的降解率为99.58%。通过对比可知,纳米Au@Ag的催化活性明显强于单独的纳米Au、Ag,其主要原因是单独使用纳米Au、Ag时在介质中易团聚而降低了其催化性能,以纳米Au为核,把Ag负载在其表面可明显提高其催化活性,增加其稳定性。此外,在249 nm处出现的新峰面积随甲基橙的峰面积降低而增加,此为材料对甲基橙的降解产物对氨基苯磺酸钠,为验证其产物,用商品对氨基苯磺酸钠进行紫外可见分析,其结果图4d和降解产物一致。其可能的催化机制为[22,16]:Au与Ag的d电子轨道为半充满状态,d轨道可接受NaBH4中的H-粒子形成过渡态产物Au-H或Ag-H,过渡态产物可与甲基橙中的N=N加成形成-NH2释放出纳米Au或Ag,而具备催化加氢活性(其机理为图5所示),但Au与Ag的催化活性和比表面积成正比,比表面越大,活性位点越多,电子转移速率越快催化活性越强,但单独的纳米Au、Ag在介质中易团聚从而降低了其催化活性,以Au为核,将Ag负载在其表面合成纳米Au@Ag复合材料不仅可解决团聚问题,纳米Au@Ag复合后d轨道电子重合,电子云密度降低,而提高其稳定性,且增加对H-的吸附与脱附能力而具备较强的催化活性。
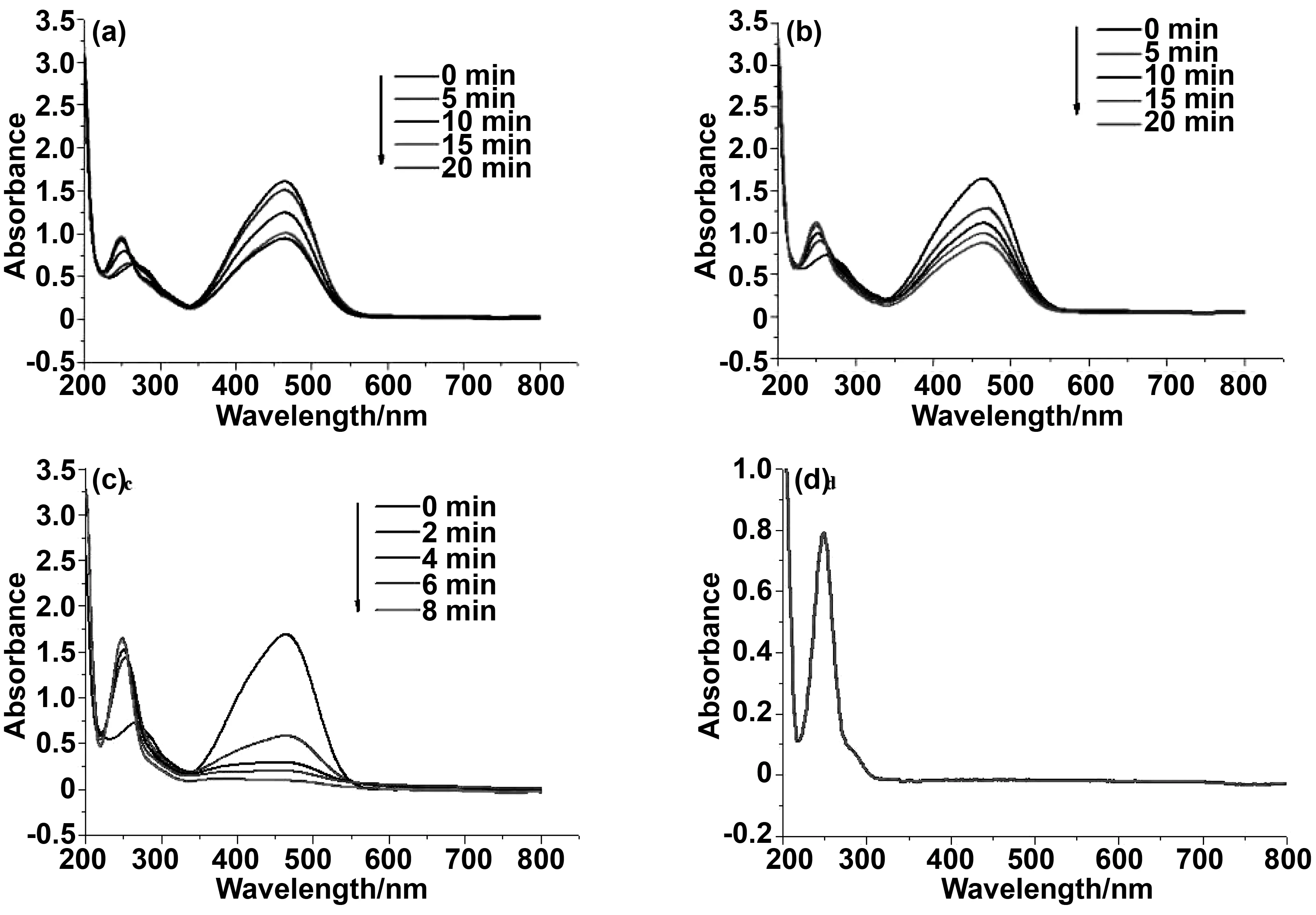
图4 相同质量(0.1 mg)的 Au (a), Ag (b)和Au@Ag (c)对甲基橙催化降解过程吸光度的变化,标准品对氨基苯磺酸钠的吸收光谱(d).Fig 4 Absorbance change during the catalytic with the same mass (0.1 mg) degradation of methyl orange using Au (a), Ag (b) and Au@Ag (c), and absorption spectra of standard sodium sulfanilate (d)

图5 甲基橙直接烷化的机制Fig 5 A mechanism path for the direct alkylation of methyl orang
2.4 复合材料光抑菌活性
2.4.1 滤纸片扩散实验结果
图6为纳米Au、Ag和Au@Ag对E.coli和S.aureus的滤纸片扩散抑菌结果。A、B和C分别为纳米Au、Ag和Au@Ag,a1-a4代表材料浓度为100、200、300和400 μg/mL在黑暗条件下对细菌的抑制结果,图6(b1-b4)为300 W(日光灯)下同浓度的光抑菌结果,由图6(a1-a4)可知,黑暗环境下纳米Au周围未出现透明的抑菌圈,证明纳米Au在400 μg/mL浓度以下几乎没有抑菌性能,纳米Ag和Au@Ag周围出现明显的抑菌圈,且纳米Au@Ag随着浓度增大抑菌圈逐渐增大,说明抑菌活性和浓度呈正比,具体的抑菌圈直径统计结果如表1所示,且材料在300 μg/mL处对两种菌的抑菌效率较高。图6(b1-b4)是在日光灯下不同材料对细菌的抑制结果,图中Au在光照下均没有抑菌性,对比黑暗环境下,而纳米Ag和Au@Ag在光照条件下的抑菌圈更大,证明光照下纳米Ag和Au@Ag的抑菌活性更强,同条件下对比纳米Ag和Au@Ag的抑菌圈,纳米Au@Ag的较大,说明纳米Au@Ag的抑菌活性更强。同条件同浓度下对比E.coli和S.aureus的抑菌性能,Ag和Au@Ag对E.coli的抑菌活性更强,说明对E.coli更为敏感。通过滤纸片扩散结果可知,纳米Ag和Au@Ag的抑菌活性和浓度呈正比,且在300 μg/mL处抑菌效率更高,光照条件下抑菌活性比黑暗条件下更高,对E.coli的抑菌效果更强,对比两种材料,纳米Au@Ag抑菌性能更强,证明把纳米Ag负载在Au表面可明显提高其抑菌活性。

表1 Au@Ag在不同浓度不同条件下对E. coli 和 S. aureus的抑菌圈直径测试结果Table 1 Detailed zone diameters of the inhibition test results for the Au@Ag composites with different concentrations of different conditions against E. coli and S. aureus

图6 不同浓度的不同条件下 Au(A)、 Ag(B)、 Au@Ag(C)对大肠杆菌(a, b)和金黄色葡糖球菌(c, d)的滤纸片扩散照片,a1, b1: 100 μg/mL, a2, b2: 200 μg/mL, a3, b3: 300 μg/mL, a4, b4: 400 μg/mL, c:黑暗培养, d: 光照培养Fig 6 Inhibition zones of the as-synthesized Au(A), Ag(B) and Au@Ag(C) composites with different concentrations of different conditions against E. coli (a, b) and S. aureus (c, d), a1, b1: 100 μg/mL; a2, b2: 200 μg/mL; a3, b3: 300 μg/mL; a4, b4: 400 μg/mL;a, c:culture in darkness; b, d: culture under light
2.4.2 菌落计数法实验结果
图7为在300 W的日光灯下,纳米Au@Ag在300 μg/mL浓度下的时间抑菌结果。图7(a)为材料对E.coli的抑菌结果,图7(b)为S.aureus,O为参照,A、B、C和D分别为混合材料的细菌溶液在光照5 min、10 min、20 min和40 min后取10 μL上清液加入固体LB培养基中,37 ℃培养12 h的抑菌结果,由图可知,E.coli中的O、A、B、C和D的菌落数分别为1 100、300、50、5、0个,而S.aureus中菌落分别为1 180、500、100、10、0个,通过对比可知,浓度为300 μg/mL时,纳米Au@Ag对E.coli和S.aureus40 min内的抑菌率为为100%,而10 min内纳米Au@Ag对E.coli的抑菌率较高,且这与滤纸片扩散结论刚好一致。

图7 Au@Ag对大肠杆菌(a)和金黄色葡萄球菌(b)的不同光照时间抑菌菌落计数法分析Fig 7 Analysis of bacteriostatic colony counting method in different illumination time with Au@Ag against E. coli (a) and S. aureus (b)
2.4.3 细菌生长曲线实验结果
图8为纳米Au@Ag在光照10 min,材料浓度为300 μg/mL的微量热分析结果。由图8(a,b)可知,对照中E.coli和S.aureus的4个生长阶段迟缓期、对数期、稳定期和衰退期中,从迟缓期到对数期的时间是5.6与6.0 min,热释放强度为4.4 和4.0 mW,且对数期和稳定期间距(生长阶段)时间较短,混合纳米Au@Ag后对E.coli和S.aureus的迟缓期变为50 和58 min,相比对照的对数期和稳定期间距时间为85 与65 min。通过对比稳定期的热流强度,混合材料组热流均降低,且E.coli更为明显,证明有部分细菌死亡。从图中可以证明材料可有效抑制细菌适应能力,相比对照,延缓期变长与稳定期热流强度降低是因为在光照过程中,溶液中存有部分ROS可有效杀死细菌,且纳米Au@Ag在溶液中释放的Ag+可使抑制细菌生长而使细菌生长阶段时间变长,且使稳定期呼吸放热量降低。

图8 Au@Ag对大肠杆菌(a)和金黄色葡萄球菌(b)的微量热分析Fig 8 Microcaloric analysis of Au @ Ag on E.coli (a) and S.aureus (b)
2.4.4 PI染色分析结果
图9为纳米Au@Ag在光照10 min,浓度为300 μg/mL下对E.coli和S.aureus的活死菌PI染色分析结果。红色斑点为死菌。图9(a、b)分别为参照和混合材料后的E.coli形貌结果,9(c、d)为参照与材料对S.aureus形貌的影响结果。由图可知,参照中E.coli和S.aureus的中有少量的红色斑点,且分别为条状和环状,材料对E.coli和S.aureus的染色结果中出现大量的条状和环状斑点,条状斑点呈现不规则现象,环状斑点的外圆环部分不完整,证明杆状的E.coli的细胞壁被纳米Au@Ag材料破坏的较为彻底,细胞壁破损导致细菌形貌发生改变,PI染色剂进入细菌内部和质粒中的DNA作用而出现无规则红色斑点形状,而S.aureus为球状,材料破坏细胞壁后,PI染色剂进入细菌内部和拟核、质粒中DNA染色而出现环状斑点,而环状斑点较为完整,证明材料对S.aureus的细胞壁损伤程度一般。通过对比可知,材料对E.coli抑制能力较强,这与以上抑菌结果一致。其可能的抑菌机理为[23-25]:在日光等的照射下,纳米Au@Ag表面电子发生局域等离子共振,部分电子逸出界面,与水介质结合生成ROS且释放Ag+,E.coli和S.aureus细胞壁中都含有带负电荷的脂多糖和磷壁酸(图10所示),可将Ag+吸附在其表面,Ag+由于与Cu+结构相似,可通过Cu粒子通道进入细菌内部破坏粒子通道、超氧化物歧化酶(SOD)、功能蛋白,协同ROS对细菌细胞器造成不可逆损伤而使细菌死亡。而纳米Au@Ag对大肠杆菌更为敏感,主要原因是E.coli细胞壁中含有大量的脂多糖蛋白和少量的磷脂双分子层,而S.aureus中含有更多的磷脂双分子层,材料很难渗透或破坏磷脂双分子层,但更易和蛋白质中的含-SH和NH2结合改变蛋白质二级结构而使细菌死亡。

图9 Au@Ag对大肠杆菌(b)和金黄色葡萄球菌(d)的PI染色分析Fig 9 PI staining analysis of Au@Ag on E. coli (b) and S. aureus (d)

图10 Au@Ag对大肠杆菌和金黄色葡萄球菌的抑菌机理Fig 10 Antibacterial mechanism of Au@Ag to E. coli and S. aureus bacteria
3 结 论
(1)以纳米Au为核,在其表面负载Ag合成核壳型纳米Au@Ag复合材料,通过TEM、EDX、UV-Vis对材料的形貌和元素进行分析,结果表明纳米Au@Ag为单分散核壳型结构,且分别以单质的形式存在,这不仅可解决Ag团聚问题,且有效提高其稳定性。
(2)因纳米Au@Ag具有丰富的表面等离子体,在300 W的日光灯的辐射下表面电子逃逸,与介质溶液结合生成ROS而具备协同抑菌性能,且双金属复合可有效降低电子密度,提高对质子的吸附和脱附能力而具备较强的催化加氢活性,在研究对甲基橙的催化加氢活性中证明,材料在10 min内对甲基橙的降解率为99%以上,对E.coli和S.aureus的抑菌研究中证明,材料在光照下抑菌活性更强,在浓度为300 μg/mL,光照10 min的抑菌效率更高,其主要原因是生成的ROS和Ag+可对细菌的生长阶段造成严重的损伤,且对E.coli的细胞壁破坏更为严重。
(3)纳米Au@Ag具有优越的催化加氢和抑菌活性可应用于污水处理和医疗器械等领域。
