牛乳中α-乳白蛋白和β-乳球蛋白的热负荷特征肽段筛选及其含量随加热温度的变化规律
2022-05-09许博舟王秀娟胡玲玲
许博舟,王秀娟,*,胡玲玲,李 洁
(1.中国检验检疫科学研究院食品安全研究所,北京 100176;2.杭州璞湃科技有限公司,浙江 杭州 310051;3.中国医科大学药学院,辽宁 沈阳 110122)
牛乳营养价值高,含有丰富的蛋白质、脂肪、碳水化合物、维生素和矿物质,易于被人体消化吸收,是理想的天然食品之一。但生鲜乳容易受到病原微生物的污染,也是微生物生长繁殖的绝佳介质。因此,生鲜乳需经过热加工处理杀灭微生物,才能确保安全饮用。
市售牛乳按其热加工处理杀菌工艺可分为两大类,包括巴氏杀菌乳和超高温灭菌乳。超高温灭菌乳经过超高温瞬时灭菌(135~150 ℃、4~15 s)处理,完全破坏其中可生长的微生物和芽孢,牛乳中无微生物存在,因此可在常温下保存,且保质期比较长,一般可达3~6个月。但是高温会损害牛乳中B族维生素、VC等营养元素,对风味和口感也有影响。而对牛乳采用较低温的巴氏杀菌法进行热处理,温度一般为72~85 ℃[1],这一方法可杀死生鲜乳中各种生长型致病菌,仅残留部分嗜热菌及其芽孢等,这些多数是对人体有益的乳酸菌。因此,巴氏杀菌乳既能够达到安全饮用标准,又能最大程度地保留生鲜乳的营养和风味。但巴氏杀菌乳的货架期较短,一般为7~12 d,且需要在2~6 ℃的低温条件下保存,不利于长时间贮存,且运输、加工和保存成本较高。除此之外,乳品企业推出的一款介于传统巴氏杀菌乳和超高温灭菌乳之间的产品üü延长货架期(extended shelf life,ESL)牛乳,近些年在市场广受欢迎,该类产品的标签货架期在低温保存条件下为21~24 d[2-3],远长于传统巴氏杀菌乳10 d左右的货架期。相关文献中报道,该类产品是采用较传统巴氏杀菌乳更高的杀菌温度进行短时间杀菌(120 ℃、2~4 s),从而实现产品的较长货架期[3]。而乳品企业则表示,该类产品是通过改进加热工艺和提高灌装设备等级实现的更高效的杀菌。ESL牛乳因满足消费者对保质期和牛乳新鲜度的要求,而在德国、奥地利等欧洲国家和地区的市场上广受欢迎[4],但目前,上述欧洲国家和我国对此类产品的加热工艺、杀菌温度等并没有明确的规定,也没有有效的鉴别方法[3]。
研究表明当生鲜乳受热时,会发生如磷酸钙的沉淀、美拉德反应和酪蛋白颗粒化等一系列变化,影响口感并导致营养损失。通常情况下,一些在未经热处理的牛乳中不存在的,或仅痕量存在的物质,因其较好的稳定性,便于含量测定,通常被用来表示高温热处理过程的热损伤程度[5]。例如糠氨酸、乳果糖、赖丙氨酸、5-羟甲基糠醛等常被用作判断食品受热程度的指标,在谷物、蛋类、肉制品、乳制品中均有应用[6-8],但此类物质无法指示较低温度或较低温度变化下牛乳的热处理强度[9-10]。乳清蛋白是生鲜乳中对热最为敏感的蛋白质,是指溶解分散在乳清中的蛋白质,其在相对较低的温度下,也易发生变性[11-12],在生鲜乳热加工过程中,当温度超过了其耐受温度,其结构、生物活性和溶解度都会发生变化[12-14],即蛋白质热变性。研究表明,当牛乳的加工条件为77.5 ℃加热60 min或90 ℃加热5 min时,其中的乳清蛋白会彻底变性[15]。Boitz等[16]研究发现巴氏杀菌乳中乳清蛋白变性率约10%~20%,超高温灭菌乳乳清蛋白变性率则高达40%~60%。由于热加工的温度和时间是影响乳清蛋白变性的重要因素,且乳清蛋白的质量分数与热处理的强度呈反比[15],本研究选用热不稳定的物质üü乳清蛋白,作为牛乳热处理过程标志物,根据乳清蛋白的质量分数评估生鲜乳中蛋白质变性程度,从而判定牛乳热处理工艺。
α-乳白蛋白(25%)和β-乳球蛋白(55%)在牛乳清蛋白中占比约80%,其在牛乳中总蛋白质占比超过20%[16-17]。研究发现,由于Ca2+的存在,当加热温度到达60 ℃或者pH值高于8.6时,β-乳球蛋白开始发生变性[18-19],当加热温度到达66 ℃,α-乳白蛋白开始发生变性[20]。在120 ℃加热80 s、130 ℃加热40 s、140 ℃加热30 s条件下,β-乳球蛋白会彻底变性[21]。国际乳品联合会(International Dairy Federation,IDF)评估不同加热条件下液态乳中β-乳球蛋白的最低含量,在巴氏杀菌乳、高温巴氏杀菌乳和超高温灭菌乳中分别为2 600、2 000 mg/L和50 mg/L[22]。目前的研究可通过乳清蛋白质含量确定牛乳中蛋白质变性温度,但无法表示随热处理温度的变化牛乳的热损伤程度。因此,本研究以牛乳中α-乳白蛋白和β-乳球蛋白作为目标物,筛选出其经热处理后的蛋白质热负荷特征肽段,通过超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)进行测定,依据筛选出的热负荷特征肽段含量判断牛乳的热损伤程度,并通过热负荷特征肽段含量指示牛乳热处理温度,采用主成分分析(principal component analysis,PCA)模型,区分不同加热温度的牛乳,从而实现不同热处理方式牛乳的鉴别。
1 材料与方法
1.1 材料与试剂
二硫苏糖醇(DL-dithiothreitol,DTT,纯度≥99.0%)、碘乙酰胺(iodocaetamide,IAA,纯度≥99.0%)美国Sigma公司;胰蛋白酶(蛋白质量分数≥50.0%)美国Promega公司;甲酸、乙腈(均为色谱纯)美国赛尔科技公司;碳酸氢铵为国产分析纯。
1.2 仪器与设备
Q Exactive组合型四极杆Orbitrap质谱仪(配有电喷雾离子源(electron spray ionization,ESI)、Proteome Discoverer 2.2数据处理软件) 美国Thermo Fisher公司;ACQUITY UPLC Xevo TQ超高效液相色谱-串联质谱仪 美国Waters公司;实验型杀菌机 中国上海辉展实验设备有限公司;恒温混匀仪 中国杭州奥盛仪器有限公司;Milli-Q Advantage A10纯水系统 德国Merck Millipore公司;Vortex Genie 2涡旋振荡器 美国Vortex公司;KQ-500DE超声波清洗器 中国昆山市超声仪器有限公司。
1.3 方法
1.3.1 样品采集
在牧场分20 批次采集生鲜乳样品,为避免个体样品差异,将采集的全部样品充分混匀,取10 L备用。采集市售牛乳样品16 例,包括巴氏杀菌乳、超高温灭菌乳和ESL牛乳,记录其品牌、包装、杀菌工艺、货架期、建议保存温度等信息。
1.3.2 标准样品制备
α-乳白蛋白和β-乳球蛋白标准品,为获得经高温热处理后的α-乳白蛋白和β-乳球蛋白的热负荷特征肽段,将乳清蛋白粉充分热处理至120 ℃,持续2 min,至α-乳白蛋白和β-乳球蛋白彻底变性,获得严重糖基化的乳清蛋白粉,备用。
1.3.3 热处理
将10 L生鲜乳样品冷却至4 ℃后,注入实验型杀菌机,缓慢加热至50 ℃,以每10 ℃为1 级变化梯度,从50 ℃加热到150 ℃,每级变化梯度保持加热时间5 s。当达到加热温度和时间,依次接出已加热的牛乳样品,待样品冷却至室温后密封贮存于-80 ℃。11 级不同加热温度梯度(50~150 ℃)的样品依次制备完成,备用。
1.3.4 多肽的测定
1.3.4.1 前处理
取1 g待测样品,用水稀释至10 mL,涡旋混匀,超声10 min,取200 μL稀释液至2 mL塑料离心管中,加入200 μL 500 mmol/L碳酸氢铵溶液溶解,涡旋混匀,加入10 μL 500 mmol/L DTT溶液,至于50 ℃温箱中30 min,取出放至室温,加入30 μL 500 mmol/L IAA溶液,避光静置30 min,加入1 mg/mL 20 μL胰蛋白酶,至于恒温混匀仪中37 ℃酶解过夜,取出放至室温,加入10 μL纯甲酸终止酶解反应,避光静置15 min,用水定容至1 mL,过0.22 μm水相滤膜,待测。
1.3.4.2 仪器条件
参照文献[11,23]前处理及其UPLC-MS/MS方法。Waters ACQUITY UPLC Peptide BEH C18色谱柱(2.1 mmh100 mm,1.7 μm);流动相:A为0.1%甲酸溶液和B为0.1%甲酸-乙腈溶液;进样量1 μL;梯度洗脱程序见表1。

表1 梯度洗脱程序Table 1 Gradient elution program
依据α-乳白蛋白和β-乳球蛋白经胰蛋白酶的酶解方式,在严重糖基化的乳清蛋白粉中,筛选出的α-乳白蛋白和β-乳球蛋白的热负荷特征肽段,编号1#~6#,通过UPLC-MS/MS在ESI+模式下采用电喷雾电离多反应监测(multiple reaction monitoring,MRM)模式进行含量测定,质谱参数如表2所示。

表2 α-乳白蛋白和β-乳球蛋白热负荷特征肽段质谱参数Table 2 Mass spectrometric conditions for analysis of signature peptides from α-lactalbumin and β-lactoglobulin
1.4 数据处理
为考察热处理温度对热负荷特征肽段(肽段1#~6#)含量的影响,每批样品进行2个水平的平行实验,通过对比不同加热温度条件下热负荷特征肽段定量离子峰强度,采用Minitab 17.0数据分析软件,单因素方差分析研究加热温度对样品中热负荷特征肽段离子峰强度值的影响,P<0.05,差异显著,P<0.01,差异极显著。
SIMCA-P 14.1(瑞典Umetrics公司)软件用于建立PCA模型,采用交叉验证方差分析对模型的可靠性进行验证,Q2及R2的值越接近于1,模型的鉴别效果越可靠且优异,其中Q2>0.5时,模型即被认可具有良好预测能力,可通过以上分析和模型,鉴别市售巴氏杀菌乳和超高温灭菌乳。
2 结果与分析
2.1 热处理前α-乳白蛋白和β-乳球蛋白特征肽段选择
选择热处理前的α-乳白蛋白和β-乳球蛋白特征肽段是准确测定目标蛋白质含量的关键。本研究通过在线计算预测工具PetptideMass(https://web.expasy.org/peptide_mass/),在UniProt数据库中搜索α-乳白蛋白和β-乳球蛋白氨基酸序列,以及理论上被胰蛋白酶切割得到的特征肽段。采用碱性胰蛋白酶作为酶切工具,利用其特异性,水解精氨酸(R)与赖氨酸(K)羧基端的肽键,将乳清蛋白粉中的α-乳白蛋白和β-乳球蛋白酶切形成肽段[24]。根据其酶解方式,α-乳白蛋白和β-乳球蛋白在R、K位点酶切,见图1,分别获得9 条和13 条长短不一的多肽。由于氨基酸数少于6个的肽段特异性不强,氨基酸数大于12个的肽段色谱分辨率较低[25],考虑到测定的准确度和稳定性,故选择6~12个氨基酸的多肽作为目标肽段进行分析。通过对多肽的离子丰度评估,经筛选,α-乳白蛋白的2 条肽段LDQWLCEK、VGINYWLAHK,β-乳球蛋白的4 条肽段IPAVFK、TPEDDEALEK、VLVLDTDYK、IDALNENK符合检测要求,可作为α-乳白蛋白和β-乳球蛋白的特征肽段。

图1 α-乳白蛋白和β-乳球蛋白A/B氨基酸序列Fig.1 Amino acid sequences of α-lactalbumin and β-lactoglobulin A/B
2.2 热处理后α-乳白蛋白和β-乳球蛋白热负荷特征肽段确定
为获得牛乳中α-乳白蛋白和β-乳球蛋白的热负荷特征肽段,本研究制备了严重糖基化的乳清蛋白粉,经胰蛋白酶酶切获得的肽段,与未经热处理的乳清蛋白粉酶切获得的IPAVFK、TPEDDEALEK等特征肽段对比,通过Q Exactive组合型四极杆Orbitrap质谱仪采集信息,将结果导入至Proteome Discoverer 2.2软件中,获得如TKIPAVFK、LDQWLCEKL等10 条热负荷特征肽段。由于α-乳白蛋白和β-乳球蛋白热变性的本质是蛋白结构的去折叠化,三级结构被破坏,分子内部的二硫键被暴露出来,形成改性单体蛋白。热处理后,糖基化过程使α-乳白蛋白和β-乳球蛋白的氨基酸序列中R或K位点处修饰单糖,导致胰蛋白酶无法在已修饰单糖的R、K位点酶切。因此,生鲜乳经热处理后,再经胰蛋白酶酶切获得的肽段发生变化,10 条特征肽段热处理前后对比表详见表3。通过UPLC-MS/MS对10 条热负荷特征肽段逐一扫描,对比离子保留时间、峰面积、峰形、离子比率等条件,考虑测定的准确度和稳定性,本研究筛选出6 条符合要求的热负荷特征肽段,并采集其离子信息,定量离子色谱图见图2,对6 条热负荷特征肽段进行编号,即肽段1#~6#,见表2。热处理程度越强,热负荷特征肽段含量越高,相应的α-乳白蛋白和β-乳球蛋白中热处理前特征肽段含量越低。

图2 肽段1#~6#定量离子MRM谱图Fig.2 Quantitative ion MRM chromatograms of peptides 1#–6#

表3 α-乳白蛋白和β-乳球蛋白特征肽段热处理前后对比Table 3 Signature peptides from α-lactalbumin and β-lactoglobulin before and after thermal treatments
2.3 热负荷特征肽段含量随热处理温度的变化规律
为考察牛乳热处理过程中α-乳白蛋白和β-乳球蛋白的热负荷特征肽段含量与加热温度的关系,将制备完成的11 级不同加热温度梯度(50~150 ℃)的牛乳样品进行热负荷特征肽段的定量离子峰强度分析。热负荷特征肽段离子峰强度值表示热负荷特征肽段在样品中的含量,热负荷特征肽段含量与蛋白变性程度有关。肽段1#、2#、4#~6#在100 ℃以下加热的牛乳样品中离子峰强度较低,当加热温度达到100 ℃时,离子峰强度显著提高,见图3,与加热温度100 ℃以下的样品具有明显差异(P<0.05)。相关文献中报道α-乳白蛋白和β-乳球蛋白其变性温度为96 ℃[26],与本实验结果基本相同,说明蛋白质变性程度和本研究筛选出的热负荷特征肽段含量存在相关性。
牛乳样品在热处理温度低于100 ℃时,肽段2#、5#(β-乳球蛋白热负荷特征肽段)的离子峰强度值均低于15 000,热处理温度在100~130 ℃时,肽段2#、5#的离子峰强度值明显升高,当热处理温度高于130 ℃,肽段2#、5#的离子峰强度值不再升高,见图3。说明随着热处理温度升高和时间延长,肽段2#、5#的含量增加,130 ℃后,乳清蛋白完全变性,样品中热负荷特征肽段含量不再变化。有研究对牛乳的热处理研究,在60~120 ℃条件下,其变性程度与热敏指标糠氨酸、乳果糖含量均存在很强的相关性(R2>0.99)[27-28]。因此β-乳球蛋白的变性程度与温度有关,筛选出的肽段2#、5#也可作为热处理的指示物,其含量随热处理温度升高和时间延长而增加。
随着热处理温度升高和时间延长,肽段3#(α-乳白蛋白热负荷特征肽段)的离子峰强度值增加,在热处理温度为60~80 ℃时,离子峰强度值明显增加,如图3所示。参考相关研究[20,28],α-乳白蛋白的热力学转变温度为66 ℃,即在66 ℃时有部分发生变性。与本实验结果显示一致,说明α-乳白蛋白的热负荷特征肽段3#也可作为牛乳热处理过程的指示物。当牛乳热处理温度超过80 ℃时,肽段3#离子峰强度值明显高于低温加热牛乳。采用巴氏杀菌法加工而成的牛乳,特点是采用72~85 ℃左右的低温杀菌[1],因此,牛乳中热负荷特征肽段3#的含量高低可用于鉴别巴氏杀菌乳和超高温灭菌乳。
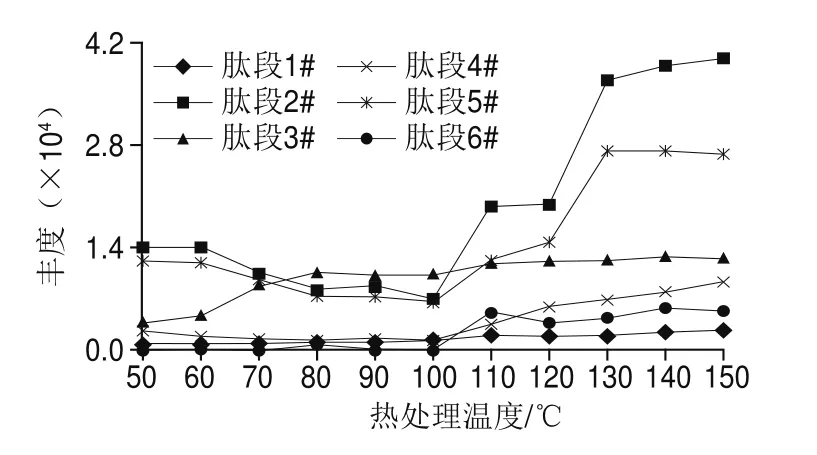
图3 热处理温度对肽段1#~6#离子峰强度的影响Fig.3 Effect of heating temperature on the ion peak intensity of peptides 1#–6#
2.4 PCA模型建立
采集市售牛乳样品16 例,包括8 例巴氏杀菌乳(1~8号)和8 例超高温灭菌乳(9~16号),采用已建立的UPLC-MS/MS方法对样品中的肽段1#~6#进行含量测定,每例样品2 组平行实验,采集获得定量离子峰强度信息。将数据预处理后导入SIMCA-P 14.1中,进行PCA模型拟合,以热负荷特征肽段离子峰强度值和热处理方式作为响应变量,采用交叉验证方差分析对模型进行验证,理论上,Q2和R2越接近1说明模型可靠性越强[29]。由于进行巴氏杀菌法的加热温度一般为72~85 ℃[1],超高温灭菌法的温度为135~150 ℃,当热加工温度超过100 ℃时,α-乳白蛋白和β-乳球蛋白糖基化程度明显加剧,导致肽段1#~6#的离子峰强度值存在明显差异,得到结果Q2=0.947,R2=0.967,见图4。因此,该分析模型可靠。

图4 市售牛乳样品PCA模型分析Fig.4 PCA plot of commercial milk samples
2.5 巴氏杀菌乳与超高温灭菌乳的鉴别
不同热处理的市售牛乳样品中肽段1#~6#的离子峰强度值均差异极显著(P<0.01)。其中,肽段1#、2#、5#、6#(β-乳球蛋白热负荷特征肽段)在巴氏杀菌乳中的离子峰强度值分别低于1 100、10 000、7 500、6 400,在超高温灭菌乳中均超过2 800、30 000、15 000和15 000。肽段3#和肽段4#(α-乳白蛋白热负荷特征肽段)在巴氏杀菌乳中的离子峰强度值分别低于450和1 800,在超高温灭菌乳中均超过2 700和2 800,见图5。鉴此可采用PCA模型和肽段1#~6#的离子峰强度值,初步实现巴氏杀菌乳与超高温灭菌乳的鉴别。
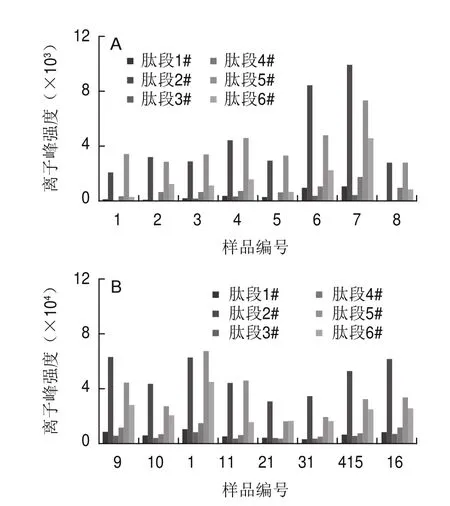
图5 市售巴氏杀菌乳(A)和超高温灭菌乳(B)中肽段1#~6#的离子峰强度值比较Fig.5 Comparison of ion peak intensity of peptides 1#–6# incommercial pasteurized milk (A) and UHT milk (B)
除此之外,研究还发现,6号和7号样品中肽段2#和肽段5#(β-乳球蛋白热负荷特征肽段)的离子峰强度值高于其他随机采集的市售巴氏杀菌乳样品,但仍与超高温灭菌乳差异极显著(P<0.01),见图5。此2 例样品标识为巴氏杀菌乳,且要求2~6 ℃低温保存,货架期分别为15 d和21 d,明显高于同类巴氏杀菌乳产品7~15 d的货架期。依据本研究结果,随着加热温度的变化,蛋白质糖基化程度逐渐明显,β-乳球蛋白的热负荷特征肽段含量逐渐增加,热处理前特征肽段含量逐渐减少。该结果与IDF评估过的不同加热条件下液态乳中的β-乳球蛋白的含量关系基本一致,为巴氏杀菌乳高于高温巴氏杀菌乳,高于超高温灭菌乳[22]。前期调研结果显示,部分厂家应用创新的热加工技术延长牛乳的货架期,结合实验分析结果,乳品企业应用了高温巴氏杀菌工艺,虽然延长了产品货架期,但较普通巴氏杀菌乳,糖基化程度增加,对鲜牛乳的营养和风味会造成一定影响。
3 结 论
热处理过程会导致牛乳中乳清蛋白糖基化,影响牛乳的风味与口感。本研究以α-乳白蛋白和β-乳球蛋白作为牛乳热处理标志物,依据胰蛋白酶酶切规律,运用Proteome Discoverer 2.2软件,筛选出α-乳白蛋白和β-乳球蛋白中共6 条热负荷特征肽段,采用UPLC-MS/MS测定其在不同加热温度下的含量变化,结果表明,热负荷特征肽段含量可用来指示热处理温度,随热处理温度的升高而增加。通过测定市售牛乳样品中热负荷特征肽段的含量,基于食品组学技术,建立的PCA模型实现了巴氏杀菌乳与超高温灭菌乳的鉴别。在乳制品生产中,可通过α-乳白蛋白糖和β-乳球蛋白热负荷特征肽段的含量,较准确的控制加热条件,从而达到例如降低乳的致敏性、改善酸凝乳的凝胶特性等不同的需求。
