地衣芽孢杆菌凝乳酶对切达干酪成熟过程中蛋白水解的影响
2022-05-09曹瑛瑛张卫兵张忠明宋雪梅乔海军杨晓丽文鹏程
曹瑛瑛,汪 月,张卫兵,*,张忠明,*,王 莹,宋雪梅,乔海军,杨晓丽,文鹏程
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学理学院,甘肃 兰州 730070;3.甘肃省商业科技研究所有限公司,甘肃 兰州 730010)
切达干酪的成熟期从2 周到2 a或更长时间不等,为了达到切达干酪典型的质构和风味,干酪必须经过发酵成熟。干酪成熟过程中会发生一系列化学和生化反应,如糖酵解、脂肪分解和蛋白水解等[1]。蛋白质作为大多数干酪品种的主要成分,对其功能特性有显著影响[2]。蛋白水解是干酪成熟的基础,在确定特定类型干酪的典型感官特征方面发挥关键作用,是重要的质量指标[3]。干酪成熟过程中的蛋白水解是一个多步骤反应,在残留凝乳酶和牛奶中纤溶酶的作用下酪蛋白(casein,CN)被水解形成长肽,长肽片段进一步被发酵剂乳酸菌、非发酵剂乳酸菌及微生物产生的蛋白酶和多肽酶水解形成游离氨基酸和小肽[4-5]。干酪中αS2-CN和β-CN的初级降解主要受纤溶酶影响,而凝乳酶负责干酪成熟过程中αS1-CN的初级降解[6]。因凝乳酶来源和种类的不同,干酪成熟过程中蛋白降解存在差异,这与奶酪最终品质密切相关。因此,研究干酪成熟过程中蛋白水解程度,对于评价凝乳酶对干酪成熟的影响具有重要意义。
目前,皱胃酶替代品的开发利用已成为凝乳酶行业的研究热点。微生物源凝乳酶由于其广泛的生物多样性和对遗传操作的敏感性而成为皱胃酶替代品的首选[7]。液化链球菌、蜡状芽孢杆菌、多黏芽孢杆菌、凝结芽孢杆菌、枯草芽孢杆菌等产凝乳酶细菌在奶酪制造中的应用已见报道[8-12]。本实验室前期从天祝高寒草原放牧牦牛生活环境的土壤样品中筛选分离得到1 株产凝乳酶细菌——地衣芽孢杆菌D3.11,该菌株在麸皮汁培养中具有较强的产凝乳酶能力[13],但其所产凝乳酶对干CN水解的作用机制尚不明确。
本研究利用地衣芽孢杆菌D3.11凝乳酶制作切达干酪,并与商品凝乳酶进行比较,分析切达干酪成熟过程中蛋白水解程度,揭示地衣芽孢杆菌凝乳酶对切达干CN水解的作用机制,以期为细菌凝乳酶在干酪生产中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜荷斯坦牛乳购自甘肃农业大学奶牛场;地衣芽孢杆菌凝乳酶由本实验室自制(200 SU/mL);商品凝乳酶(小牛皱胃酶和牛胃蛋白酶比例为7∶3,890 IMCU/g)北京多爱特生物科技有限公司;麸皮 淮南鸿汶农业发展有限公司。
α-CN、β-CN(电泳纯) 美国Sigma-Aldrich公司;L-酪氨酸、L-苯丙氨酸、L-色氨酸(色谱纯)北京索莱宝科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
754PC紫外-可见分光光度计 上海光谱仪器有限公司;TGL-20高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;1260 Infinity II高效液相色谱仪 安捷伦科技(中国)有限公司;电泳仪 美国Bio-Rad公司;SCIENTZ-10ND真空冷冻干燥机 宁波新芝生物科技股份有限公司;K9840自动凯氏定氮仪 济南海能仪器有限公司。
1.3 方法
1.3.1 切达干酪和干酪类似物样品的制作
参照石永祺等[14]的方法,工艺流程如下:原料乳(10 L)→63 ℃巴氏杀菌30 min→冷却至35 ℃→添加发酵剂(0.006 25 g/L)→添加CaCl2(0.3 g/L)→添加凝乳酶(200 SU/mL)→凝乳→切割、排乳清→加盐、搅拌→二次加热→排乳清→堆酿→压榨成型→真空包装→成熟。
按照上述工艺流程,分别制作干酪和干酪类似物样品:CDF组:添加地衣芽孢杆菌D3.11凝乳酶制备切达干酪;CD3组:添加地衣芽孢杆菌D3.11凝乳酶但未添加发酵剂制备干酪类似物;CCF组:添加商品凝乳酶制备切达干酪。
1.3.2 水分含量测定
根据GB 5009.3ü2016《食品中水分的测定》中直接干燥法测定。
1.3.3 蛋白水解指标的测定
1.3.3.1 蛋白含量
根据GB 5009.5ü2016《食品中蛋白质的测定》中凯氏定氮法测定总蛋白含量。
1.3.3.2 pH 4.6-可溶性氮(soluble nitrogen,SN)含量
参照刘会平等[15]的方法,称取干酪样品0.75 g置于硏体内充分研碎,用25 mL pH 4.6的醋酸盐缓冲溶液溶解后,再取25 mL缓冲溶液冲洗研钵,制得干酪溶液,将干酪溶液于4 ℃、4 000 r/min离心20 min,离心后取20 mL上清液进行消化处理,用凯氏定氮法测定消化后样品中氮含量。pH 4.6-SN含量以所测氮含量与干酪总氮含量的百分比表示,每个样品平行测定3次。
1.3.3.3 12%三氯乙酸(trichloroacetic acid,TCA)-SN含量
参照刘会平等[15]的方法,称取干酪样品1.5 g置于研钵内充分研碎,加入25 mL 12% TCA溶液将干酪溶解后再加入25 mL 12% TCA溶液冲洗研钵,将所得溶液于4 ℃、4 000 r/min离心20 min,取20 mL上清液进行消化处理,消化后的样品采用凯氏定氮法测定氮含量。12%TCA-SN含量以所测氮含量与干酪总氮含量的百分比表示,每个样品平行测定3次。
1.3.3.4 5%磷钨酸(phosphotungstic acid,PTA)-SN含量
参照王玲等[16]的方法,移取10 mL pH 4.6-SN测定中的上清液,加入7 mL 4 mol/L H2SO4和3 mL 333 g/L磷钨酸溶液,混合均匀,4 ℃静置24 h,滤纸过滤后取10 mL上清液移入消化管中,消化后的样品采用凯氏定氮法测定氮含量。5% PTA-SN含量以所测氮含量与干酪总氮含量的百分比表示,每个样品平行测定3次。
1.3.3.5 总游离氨基酸含量
参照Shori等[17]的方法,采用镉-茚三酮法测定干酪中总游离氨基酸。
1.3.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参照宋雪梅[18]的方法进行样品处理。称取5 g干酪样品加入15 mL去离子水,匀浆5 min,使其混合均匀,混合物40 ℃水浴条件下放置1 h,再于室温放置15 min后,用1 mol/L HCl溶液调pH值至4.6,水溶液在4 ℃、4 000 r/min下离心20 min,滤纸过滤后将沉淀部分进行真空冷冻干燥,与-18 ℃保存备用。
参照穆硕等[19]的方法进行上样前处理。称取10 mg冻干CN样品加入1 mL 6 mol/L尿素溶液溶解,上样前采用BCA法测定蛋白质量浓度,调整上样质量浓度为2 μg/μL。同时称取α-CN和β-CN用尿素溶液溶解并调整蛋白浓度为2 μg/μL。将样品以体积比为4∶1与5×上样缓冲液混合,沸水浴加热5 min,取10 μL上清液上样。
加样后起始电压80 V,待样品电泳至浓缩胶与分离胶分界线时,调整电压至120 V,至样品接近分离胶下缘时停止。将凝胶转移至染色液中染色12 h后换入脱色液进行脱色,至条带清晰后将胶片放置于凝胶成像仪进行成像分析。
1.3.3.7 pH 4.6-水溶性肽段含量
参照De Llano等[20]的方法稍作修改。称取5 g干酪样品,加入15 mL去离子水,匀浆5 min,使其混合均匀,混合物40 ℃水浴条件下放置1 h,再于室温放置15 min后,用1 mol/L HCl溶液调pH值至4.6,水溶液4 ℃、4 000 r/min离心20 min,滤纸过滤后将上清液进行真空冷冻干燥,与-18 ℃保存备用。将冻干样品溶于0.1%三氟乙酸溶液中,质量浓度为10 mg/mL,0.22 μm滤膜过滤后注入进样瓶中。
色谱条件:色谱柱为RP-C18柱(250 mmh4.6 mm,5 μm);洗脱液A:0.1%三氟乙酸;洗脱液B:乙腈-水(60∶40,V/V,含0.1%三氟乙酸溶液);流速1 mL/min;进样量10 μL;紫外检测波长214 nm。
1.4 数据统计分析
每组实验重复测定3次,采用Excel 2016软件进行数据处理,用SPSS 19.0软件进行差异显著性分析和主成分分析(principal component analysis,PCA),采用Duncan法进行数据间多重差异显著性分析,利用Origin 8.0软件进行绘图。
2 结果与分析
2.1 成熟过程中干酪水分含量的变化
由图1可知,整个成熟期内,3 组样品水分含量均随成熟时间延长显著下降(P<0.05),并且3 组样品间水分含量差异显著(P<0.05),CCF组样品水分含量显著高于CDF组和CD3组(P<0.05)。CDF、CD3、CCF3 组样品在成熟第6个月时水分含量相比其初始水分含量分别下降了9.40%、5.47%、9.33%。结果表明3 组样品在成熟过程中对水分消耗程度不同,CDF组高于CCF组和CD3组。整个成熟期间3 组样品真空包装内均有水分渗出,其中CDF组干酪样品失水率最大,其次为CCF组,CD3组失水率最低。高蛋白脂肪比、低pH值和矿物质平衡的改变以及成熟时间延长和蛋白质降解均会导致干酪水分的释放。Samal等[21]研究表明,随着贮藏时间延长,真空包装羊乳酪渗出物含量显著增加,这与蛋白水解有关,并推测随着αS1-CN的水解,干酪蛋白网络减弱并逐渐解体,导致空隙中水分渗出释放。

图1 干酪成熟过程中水分含量变化Fig.1 Changes in moisture content during cheese ripening
2.2 成熟过程中干酪蛋白含量的变化
由表1可知,在6个月成熟期内3 组样品蛋白含量均随成熟时间的延长显著增加,并且3 组样品间蛋白含量差异显著(P<0.05)。王玲等[16]、Hayaloglu[22]也发现干酪蛋白含量随成熟时间的延长呈增长趋势,这可能与成熟期间干酪水分含量减少有关。CD3组样品蛋白含量最高,其次为CCF组,CDF组样品总蛋白含量最低。CDF、CD3、CCF3 组样品在成熟6个月的蛋白含量较其初始蛋白含量分别增加了11.58%、6.54%、14.14%。本研究中,CD3组蛋白含量显著高于CDF组和CCF组,这可能是因为CD3组样品没有添加发酵剂。马玲等[23]研究发现未添加发酵剂的模拟马苏里拉干酪蛋白含量较高。
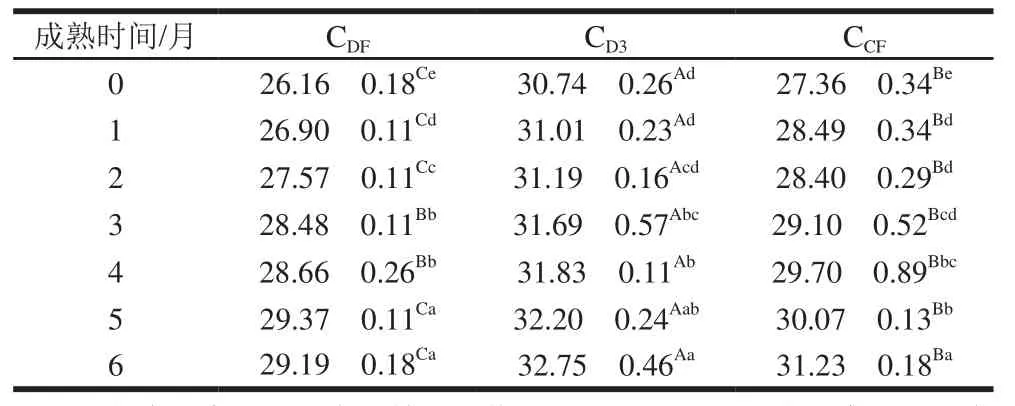
表1 干酪成熟过程中总蛋白含量变化Table 1 Changes in total protein content during cheese ripening%
2.3 成熟过程中干酪pH 4.6-SN含量变化
pH 4.6-SN是一种非特异性指数,代表蛋白水解广度,主要表征CN水解产生的中等大小肽和由纤溶酶水解β-CN产生的蛋白胨组分;此外还包含非沉淀乳清蛋白和小肽、游离氨基酸以及更小的含氮化合物,如尿素和胺[24]。由图2可知,3 组样品pH 4.6-SN含量均随成熟时间的延长显著增加(P<0.05),并且在整个成熟期内CDF组和CD3组pH 4.6-SN含量均显著高于CCF组(P<0.05)。成熟0个月,CDF、CD3和CCF组干酪样品pH 4.6-SN质量分数分别为4.38%、2.81%和1.90%;成熟6个月CDF、CD3和CCF组样品pH 4.6-SN质量分数较其初始含量分别增加了16.63%、15.69%和10.58%。pH 4.6-SN含量的升高主要归因于副CN的水解[25]。CDF组干酪具有比CCF组干酪更高的pH 4.6-SN含量,这表明地衣芽孢杆菌凝乳酶对切达干酪的蛋白水解广度较商品凝乳酶高。
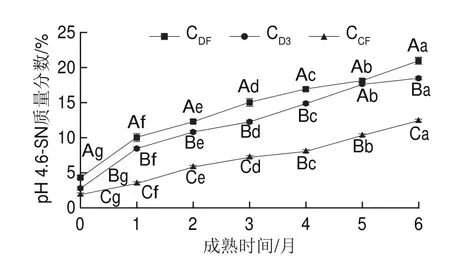
图2 干酪成熟过程中pH4.6-SN含量变化Fig.2 Changes in pH4.6-SN content during cheese ripening
2.4 成熟过程中干酪12% TCA-SN含量的变化
12% TCA-SN含量主要反映成熟过程中干酪蛋白质水解深度[16],主要由凝乳酶和发酵剂产生的肽酶共同作用而生成,可以表征干酪成熟过程中产生的游离氨基酸和中小分子肽[26]。如图3所示,在整个成熟过程中,由于中低分子质量多肽的释放,3 组样品的12% TCA-SN含量均呈上升趋势,12% TCA-SN含量依次为CDF组>CD3组>CCF组。成熟6个月,CDF、CD3和CCF组样品12% TCA-SN质量分数分别为23.41%、21.36%和17.45%。结果表明,地衣芽孢杆菌凝乳酶对切达干酪的蛋白水解深度显著高于商品凝乳酶(P<0.05)。说明凝乳酶种类对蛋白水解有重要影响,不同凝乳酶其蛋白水解水平不同。
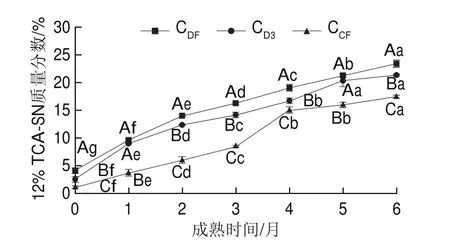
图3 干酪成熟过程中12%TCA-SN含量变化Fig.3 Changes in 12% TCA-SN content during cheese ripening
2.5 成熟过程中干酪5% PTA-SN含量的变化
由图4可知,3 组样品中5% PTA-SN含量在6个月成熟过程中均呈上升趋势,并且3 组样品间差异显著(P<0.05)。成熟2个月后CDF组样品5% PTA-SN含量显著高于CD3组和CCF组(P<0.05)。在6个月成熟期内,CDF组干酪样品5% PTA-SN含量由1.65%上升至5.76%,CD3组由1.26%上升至3.95%,CCF组由1.03%上升至4.13%。Fox等[27]报道,5% PTA-SN含量已被广泛用作衡量奶酪中游离氨基酸生成的指标,5% PTA-SN含量增加表明游离氨基酸水平升高。
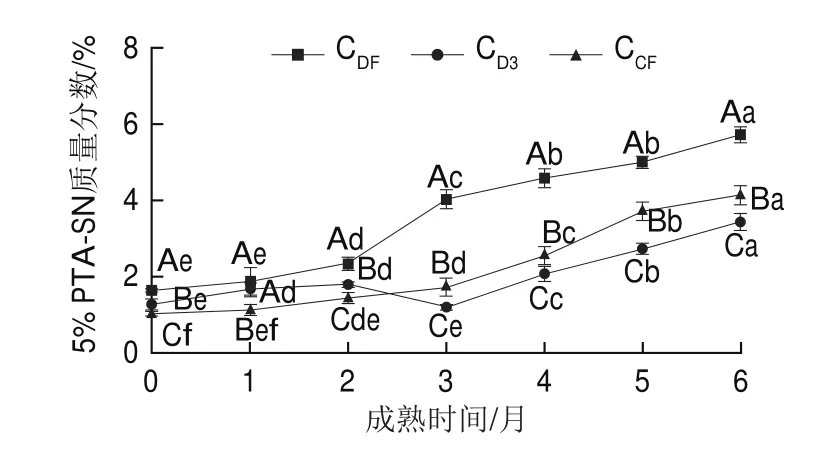
图4 干酪成熟过程中5%PTA-SN含量变化Fig.4 Changes in 5% PTA-SN content during cheese ripening
2.6 成熟过程中干酪总游离氨基酸含量的变化
如图5所示,在整个成熟过程中,3 组样品的总游离氨基酸含量均显著增加(P<0.05)。在第0个月时,CDF、CD3、CCF干酪总游离氨基酸含量分别为2.938、2.539 mg/g和1.719 mg/g,到第6个月时,CDF、CD3、CCF干酪总游离氨基酸含量分别增加了13.28、10.42 mg/g和8.80 mg/g,CDF组总游离氨基酸含量增加最多,并且在整个成熟期内,CDF组干酪的总游离氨基酸含量显著高于CD3组和CCF组。可见地衣芽孢杆菌凝乳酶显著提高了切达干酪中的总游离氨基酸含量,对总游离氨基酸的产生有促进作用。游离氨基酸是蛋白质水解的最终产物,因此在干酪成熟的任何阶段都有游离氨基酸产生[28]。用镉-茚三酮法检测干酪成熟过程中游离氨基酸的形成,氨基酸通过与茚三酮结合可以很容易被鉴定和定量[29]。与CDF、CD3相比,CCF组游离氨基酸含量相对较低,这可能与不同凝乳酶的蛋白水解力有关,说明凝乳酶种类对干酪总游离氨基酸产生影响显著。
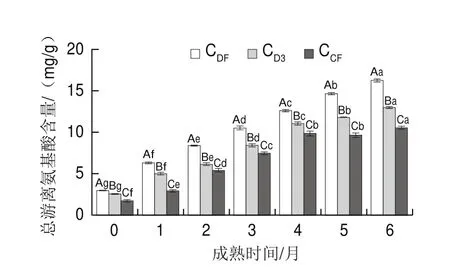
图5 干酪成熟过程中总游离氨基酸含量变化Fig.5 Changes in total free amino acid content in cheese during ripening
2.7 成熟过程中干酪CN的初级降解
由图6可以清楚观察到在干酪成熟过程中αs-CN和β-CN均有不同程度的降解,与0个月相比,成熟6个月3 组样品的条带强度明显减弱。与CCF组相比,CD3和CDF组β-CN条带较强;而CCF组α-CN条带较其他两组更明显,说明地衣芽孢杆菌凝乳酶对αs-CN的降解能力较强。随着蛋白水解的进行,3 组样品均产生小分子物质,但蛋白水解程度存在明显差异,其中CCF组次级条带最多,而CDF组和CD3组较少,可能是因为CDF组和CD3组将次级产物水解为分子质量更小的物质。Zhao Xiao等[30]发现,与商品凝乳酶相比,黄酒中的微生物凝乳酶对牛奶CN具有更广泛的比活性。综上,地衣芽孢杆菌凝乳酶对α-CN的降解能力较商品凝乳酶强。

图6 干酪成熟过程中SDS-PAGE图Fig.6 SDS-PAGE profiles of proteins in ripening cheese
2.8 成熟过程中干酪pH 4.6-水溶性肽含量的变化
如图7所示,成熟期间3 组样品pH 4.6-水溶性肽含量随成熟时间的延长呈先上升再下降的趋势。CDF组和CD3组pH 4.6-水溶性肽含量显著高于CCF组干酪(P<0.05)。CDF组干酪在第3个月后pH 4.6-水溶性肽含量开始下降,CCF组干酪在第4个月后开始下降,而CD3组则在第5个月后开始降低。表明凝乳酶对切达干酪pH 4.6-可溶性肽含量有显著影响。
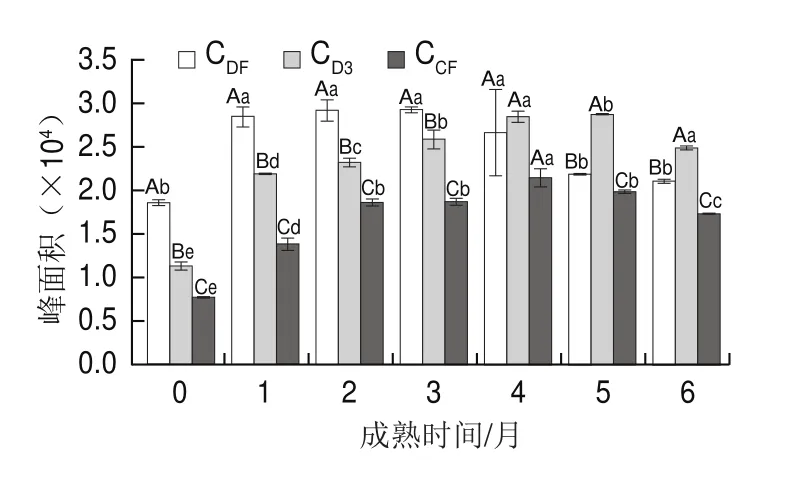
图7 干酪成熟过程中pH 4.6-水溶性肽含量变化Fig.7 Changes in content of soluble peptide at pH 4.6 during cheese ripening
干酪苦味与疏水性肽有关,过多疏水性肽的形成导致干酪中产生较明显的苦味。由表2可知,3 组干酪pH 4.6-SN提取物中疏水性肽和亲水性肽含量比值随成熟时间的延长整体呈下降趋势。在整个成熟期间,CCF组干酪疏水性肽和亲水性肽含量比值显著高于CDF组和CD3组(P<0.05)。成熟0个月CDF、CD3、CCF组疏水性肽和亲水性肽含量比值分别为4.380、2.590、12.038,随着干酪的成熟,CDF组和CCF组疏水性肽与亲水性肽含量比值均显著下降(P<0.05),在成熟第6个月时,CDF组和CCF组比值分别下降了1.712、8.250;而CD3组比值变化程度较CDF组和CCF组小,与0个月相比,第6个月时比值上升了0.232。蛋白水解专一性和总蛋白水解活性的这种差异会影响苦味,疏水性肽会增加干酪的苦味值[31]。CDF组水溶性肽含量显著高于CCF组,但疏水性肽与亲水性肽含量比值显著小于CCF组,这表明地衣芽孢杆菌凝乳酶与商品凝乳酶相比,虽然蛋白水解程度较高,但疏水性肽含量降低。An Zhigang等[32]研究表明,与商品凝乳酶相比,解淀粉芽孢杆菌凝乳酶所制干酪具有更低的疏水性肽和亲水性肽含量比值,这与本研究结果一致。
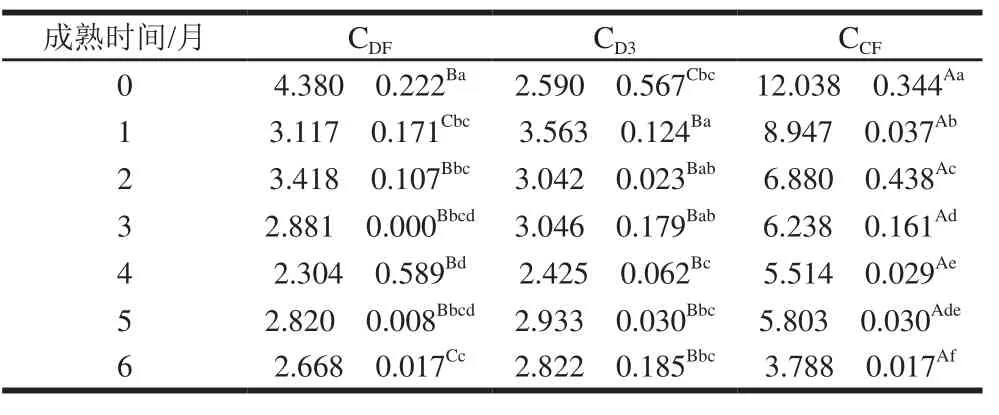
表2 成熟过程中干酪疏水性肽与亲水性肽含量比值变化Table 2 Changes in hydrophobic peptide/hydrophilic peptide peak area ratio of cheese during ripening
表3为3 组样品成熟期间蛋白水解指标的PC1和PC2的因子载荷矩阵。PC1主要综合了pH 4.6-SN、12% TCA-SN和5% PTA-SN含量3个指标的变异信息,三者在PC1上的因子载荷值均大于0.9。此外,总游离氨基酸含量和疏水性肽与亲水性肽含量比值在PC1上的因子载荷值也较大。因此,PC1可视作成熟度因子,主要表征干酪样品的水解程度。

表3 干酪成熟期间蛋白水解PC因子载荷Table 3 Principal component factor loading of proteolysis during ripening of cheese
选取pH 4.6-SN、12% TCA-SN、5% PTA-SN、总游离氨基酸、亲水性肽含量、疏水性肽含量以及疏水性肽与亲水性肽含量比值对蛋白水解程度进行PCA,如图8A所示,PC1和PC2方差贡献率分别为73.65%和16.20%,前两个PC方差贡献率总和为89.85%,基本可以反映原数据的变异信息。其中,CDF组成熟1~6个月的干酪样品(CDF-1~CDF-6)位于PC1正半轴上,其中CDF-4、CDF-5、CDF-6干酪样品得分较高,CD3组成熟3、4、5、6个月的干酪样品(CD3-3~CD3-6)位于PC1正半轴上,CCF组成熟5、6个月的干酪样品(CCF-5、CCF-6)位于在PC1正半轴上。此外,疏水性肽和亲水性肽含量比值位于PC1负半轴上。成熟时间越长的干酪,其在PC1正半轴上的得分越高,这表明干酪中疏水性肽与亲水性肽含量比值与成熟度呈负相关。上述结果说明3 组样品蛋白水解度为CDF组>CD3组>CCF组,并且干酪的蛋白水解程度与成熟度呈正相关,但与疏水性肽和亲水性肽含量比值呈负相关。
对不同成熟期的3 组干酪进行聚类分析,如图8B所示,根据蛋白水解程度可初步聚为3类。成熟0个月的CD3组和CCF组干酪样品距离较近,聚为I类,表明二者蛋白水解程度相似;成熟1~4个月的CDF组干酪样品与成熟3~6个月的CD3组样品聚为II类;而成熟0、5、6个月的CDF组干酪样品、成熟1、2个月的CD3组样品及成熟1~6个月的CCF组样品聚为III类。以上结果表明,地衣芽孢杆菌凝乳酶可缩短干酪的成熟时间。
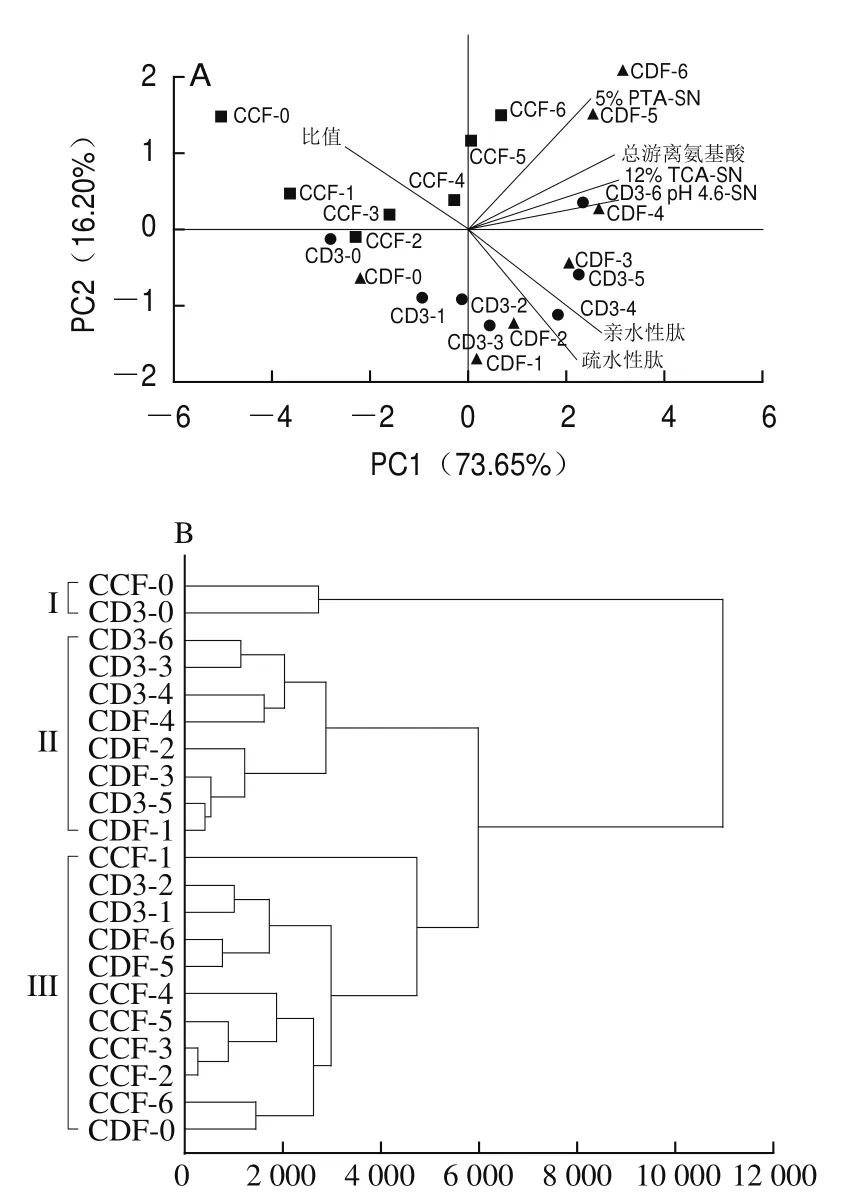
图8 不同成熟期干酪主成分载荷图(A)和聚类图(B)Fig.8 PCA loading plot (A) and cluster analysis dendrogram (B) of cheese of different maturities
3 结 论
比较3种切达干酪成熟过程中蛋白水解程度,结果表明,干酪成熟过程中CD3组样品总蛋白含量最高,其次为CCF组,CDF组干酪样品总蛋白含量最低;CDF组干酪具有比CCF组更高的pH 4.6-SN、12% TCA-SN和5% PTASN含量;与CDF、CD3相比,CCF组游离氨基酸含量相对较低,说明凝乳酶的种类对干酪的总游离氨基酸影响显著(P<0.05);SDS-PAGE结果显示地衣芽孢杆菌凝乳酶对α-CN的降解能力较强;pH 4.6-水溶性肽含量显著增加,但CDF组和CD3组疏水性肽和亲水性肽含量比值显著低于CCF组(P<0.05)。综上所述,地衣芽孢杆菌凝乳酶对切达干酪的蛋白水解作用高于商品凝乳酶,可有效缩短干酪成熟期。
