灵武长枣贮藏过程中细胞壁成分及其相关酶活性的变化
2022-05-09杨静慧邱雪张海红郝慧慧
杨静慧,邱雪,张海红*,郝慧慧
1(宁夏大学 食品与葡萄酒学院,宁夏 银川,750021)2(广州基迪奥生物科技有限公司,宁夏 银川,750021)
灵武长枣(Lingwu long jujube)又名牙马枣,因其具有个大色艳、酥脆爽口、酸甜适中、营养丰富的特点而荣获了宁夏“地理标志保护产品”殊荣。硬度等质地指标是衡量鲜食灵武长枣品质的重要指标。然而,随着贮藏时间的延长,鲜食长枣硬度下降、质地劣变、水分流失,逐渐丧失了其商业价值[1]。果品质地软化、硬度下降与其内部水分迁移、细胞壁降解及细胞壁降解酶的协同作用息息相关。陈国梁等[2]对木枣的研究发现,果胶甲酯酶(pectin methylesterase,PME)、纤维素酶(cellulase,CE)、β-半乳糖苷酶(β-galactosidase,β-Gal)、多聚半乳糖酸酸酶(polygalacturonase,PG)等对果实的成熟软化均起到一定作用。刘鑫[3]对枣皮细胞壁的变化研究表明,果实在贮藏过程中,水分处于充足而稳定的状态,可以抑制果皮细胞代谢酶的活性,延缓果皮物质的分解代谢,从而减少枣果实软化的发生。REN等[4]对番荔枝的研究发现,果实软化伴随着果皮硬度和水分的急剧下降,细胞壁多糖尤其是果胶多糖的降解破坏了细胞壁的网络结构,引起了水分自高自由度向低自由度迁移,导致采后番荔枝果实软化。LIU等[5]研究发现,杏果在采后贮藏期间硬度下降,果胶多糖逐渐降解, 水溶性果胶(water solute pectin,WSP)、螯合性果胶(chelate solute pectin,CSP)和半纤维素(hemicellulose,HC)的链长和链宽值均逐渐减小。WANG等[6]利用原子力显微镜(atomic force microscope,AFM),从微观角度对黄花和沾花2个枣树品种在生熟期和成熟期2个时期进行的研究发现,随着成熟度的增加,其CSP链中的长链宽链都有所减少。
本文拟以灵武长枣为研究对象,研究长枣果实在贮藏期间细胞壁多糖纳米结构的降解规律,探究硬度变化与细胞壁多糖及其降解酶活性、水分的内在联系,解析长枣贮藏过程中细胞壁多糖纳米结构降解对其硬度变化的响应机理,为其采后贮藏保鲜技术的开发、品质调控提供理论支持。
1 材料与方法
1.1 材料与试剂
灵武长枣采自宁夏灵武市大泉林场枣园。选取同株体上大小相似,外形完好,且无病虫害,无机械损伤,八成熟、带柄的灵武长枣。长枣被采摘后,以聚苯乙烯泡沫箱缓冲包装后,在0~4 ℃环境下运回实验室,并在4 ℃冰箱中贮藏备用。
无水乙醇、咔唑,天津市瑞金特化学试剂有限公司;二甲基亚砜、1,2-环己二胺四乙酸,天津市津科精细化工研究所;氯仿,中国宿州化学试剂有限公司;碳酸钠,天津市永大化学试剂有限公司;硼氢化钠,国药集团化学试剂有限公司;蒽酮,天津市科密欧化学试剂开发中心;溴百里酚蓝,上海麦克林生化科技有限公司;聚半乳糖醛酸,上海阿拉丁生化科技股份有限公司;4-硝基苯基-β-D-吡喃半乳糖苷,上海凛恩科技发展有限公司;所有试剂均为分析纯。
1.2 仪器与设备
TAXT PLUS/50 物性测定仪,英国Stable Micro system Ltd 公司;NMI20-040V-I低场核磁共振仪,上海纽迈电子科技有限公司;GL-20C高速冷冻离心机,北京哈纳科仪科技有限公司;THZ-82B气浴恒温振荡器,江苏省金坛市医疗仪器厂;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限公司;AL204电子天平,梅特勒-托利多仪器(上海)有限公司。
1.3 试验方法
依据长枣保鲜期,设计实验周期为16 d。从第0天开始,每4 d从预处理样品中随机抽取1组,进行测试。实验设3次重复。
1.3.1 硬度测试
选用P/2n针状探头(直径2 mm),设定测前速度5 mm/s,贯入速度1 mm/s, 测后速度5 mm/s,最小感知力5 g,穿刺深度5 mm,在整枣赤道部位均匀取3点,用TAXT PLUS/50物性测定仪对整果进行硬度测试[7]。
1.3.2 水分迁移测试
用取样器取出被测长枣后,去皮,切取约10 mm×10 mm×20 mm大小的组织块放入核磁检测管(70 mm),置于低场核磁共振仪(low field-nuclear magnetic resonance,LF-NMR)的永久磁场中心位置的射频线圈的中心,利用多脉冲回波序列(Carr-Purcell-Meiboom-Gill)测量样品的横向弛豫时间T2[8]。参数设置:90 ℃ 脉冲时间为16 μs,180 ℃脉冲时间为34 μs,测定温度为32 ℃,质子共振频率为24 MHz,采样间隔为3 000 ms,回波时间为1 ms,累加次数为4次,回波个数为1 000。每个样品重复3次,将T2进行反演,得到反演图。
1.3.3 细胞壁多糖的制备和提取
参照BRAHEM等[9],曹建康等[10]的提取方法,并略加修改。果胶含量用咔唑法测定,纤维素、半纤维素含量用蒽酮法测定[10-11]。
1.3.4 CSP纳米结构测量
分别将0、16 d的CSP提取液,稀释到合适的浓度,取15 μL提取液至洁净云母片上,室温下干燥待用。利用AFM(Nano ScopeⅢa型)以非接触模式进行测试,用Nanoscope软件分析果胶分子的聚集体、分支结构、链宽等属性。以界面分析法分析果胶分子聚集体和单个分子的链宽W和链高V,其中图像亮和暗的部分分别表示果胶链中高和低的部分。单个分子的宽度可用软件中的半峰宽测定,链宽值出现的次数记为频率(Fq)。每组利用多个平行样品得到统计结果[12]。
1.3.5 细胞壁相关酶活性的测定
长枣切丁后,立即将果肉冷冻在液氮中,并贮存在-80 ℃下,用于细胞壁及降解酶活力的测定。取3.0 g长枣果实进行粗酶液提取。PG、PME、CE、β-Gal的提取均参照曹建康等[10]的方法。
1.3.5.1 PG活力测定
参照徐晓波[13]的测定方法,并略加修改。
1.3.5.2 PME活力测定
参照ZHANG等[14]的方法,并略加修改。
1.3.5.3 CE活力测定
参照曹建康等[10]的测定方法,并略加修改。
1.3.5.4 β-Gal活力测定
参照GWANPUA等[15]的测定方法,并略加修改。
1.4 数据统计与分析
使用Excel进行统计分析,使用软件DPS 9.50[16]在参数之间进行了Pearson相关性分析以及邓肯式多重差异分析(P<0.05表示差异显著,P<0.01表示差异极显著),结果以平均值±标准差表示,并采用Origin 2019绘图。
2 结果与分析
2.1 贮藏期间长枣硬度变化规律
硬度是衡量鲜食灵武长枣质构品质的重要指标。随着贮藏时间的延长,长枣果实硬度显著降低,且前8 d为快速软化期。如图1所示,贮藏期间灵武长枣硬度介于63.07~70.69 N,0 d时的硬度为70.69 N,分别是4、8、12、16 d的1.03、1.09、1.10、1.12倍。

图1 灵武长枣贮藏期间硬度的变化Fig.1 Changes in hardness during storage of Lingwu long jujube 注:同一指标不同小写字母表示差异显著(P<0.05)(下同)
2.2 贮藏期间枣果水分迁移规律
贮藏过程中,伴随着长枣果实硬度的降低,长枣细胞内水分发生了迁移。图2为灵武长枣序列反演获得的T2水分典型峰型图,T2谱中有3个波峰,T2值越小,越靠近图的左侧分布,枣果的水分活度越低。由于液泡膜和原生质膜阻碍了水分的迁移,因而水分的弛豫时间有明显的间隔。根据T2弛豫时间的差异,可将长枣中的水分划分为3种状态,分别标记为T21(0.01~3.51 ms)、T22(3.51~37.64 ms)、T23(37.64~932.60 ms)[17],即细胞壁水、细胞质水和液泡水,其对应的峰面积分别为A21、A22、A23。

图2 灵武长枣T2水分峰型图Fig.2 Water peak pattern of T2 of Lingwu long jujube
T2弛豫的相对峰面积可以表征不同结合状态的水分含量。峰面积的变化可以反映出水分之间的相互转化及其迁移[18]。图3为灵武长枣在贮藏过程中A21、A22、A23的变化趋势图。前4 d,细胞壁水水分含量基本不变,第4天开始显著下降(P<0.05)。细胞质水水分含量在4 d前缓慢上升,4~8 d内快速升高,第8天达到峰值,存在显著差异(P<0.05)。液泡水水分含量随着贮藏时间的延长,整体呈下降趋势,差异显著(P<0.05)。这可能是因为第4天时大分子物质降解,细胞壁水转化为细胞质水,第8天时细胞质水转变为液泡水。
2.3 贮藏期间长枣果实细胞壁多糖组成的变化规律
果胶、半纤维素和纤维素是构成细胞壁的主要成分,在果实贮藏期间,WSP、CSP、碱溶性果胶(sodium carbonate-soluble pectin,SSP)表现出不同的变化规律。如表1所示,随着贮藏时间的延长,WSP含量逐渐升高,差异显著(P< 0.05)。CSP含量先增加后降低。SSP、HC、CE含量变化趋势相近,均在第4天时达到最高,随后呈下降趋势,在第8~12天贮藏期内急剧下降,表明细胞壁结构受损,果实软化[19]。

a-A21、A22变化曲线;b-A23变化曲线图3 A21、A22、A23随贮藏时间变化曲线Fig.3 A21、A22、A23 changes of storage time

表1 灵武长枣贮藏期间细胞壁物质降解规律单位:mg/100g FW
2.4 贮藏期间长枣果实细胞壁降解酶活性
枣果采摘后,仍保持着一定的生理活性。PG主要通过水解细胞壁内存在的多聚半乳糖醛酸中的α-1,4-半乳糖苷键,从而导致细胞壁结构解体,使果实软化。如图4-a所示, 随着贮藏期的延长,伴随着枣果硬度的降低,PG含量整体呈上升趋势,第12天到达果实含量最高点后略有下降,差异显著(P<0.05)。β-Gal活力整体呈“升-降-升”的趋势,并存在显著性差异(P<0.05),贮藏末期β-Gal含量是贮藏初期的1.81倍。

a-PG、β-Gal活性变化;b-PME、CE活性变化图4 灵武长枣贮藏期间酶活性的变化Fig.4 Changes of enzyme activity during storage of Lingwu long jujube
PME能够催化果实内聚半乳糖醛酸甲酯的酯键水解,形成果胶酸。如图4-b所示,随着贮藏期的延长,PME活力呈上升趋势,差异显著(P<0.05)。CE主要功能是分解含1,4-β-葡萄糖基链的半纤维素基质多糖[20],随着贮藏期的延长,长枣的CE含量由13.35 U/g逐渐上升至40.12 U/g,差异显著(P<0.05)。枣贮藏过程中,细胞壁降解酶的变化及其协同作用,是造成枣果宏观硬度降低、质构品质劣变的主要因素。
2.5 枣果硬度、细胞壁组分及其降解酶活力之间的相关分析
水分含量、细胞壁组分及其降解酶与果实硬度的相关性研究如表2所示。果实硬度与细胞壁水水分含量、液泡水水分含量及HC含量呈极显著正相关,与WSP、CSP、PG、PME、β-Gal、CE含量呈极显著负相关。各相关指标与硬度的相关程度依次为:WSP(-0.97)=CSP(-0.97)=β-Gal (-0.97)>A23(0.96)、PG(-0.96)=CE (-0.96)>A21(0.94)>PME(-0.93)>HC(0.87) >CE (0.770 0) >SSP(0.460 0)>A22(-0.180 0)。

表2 不同贮藏期红枣果实硬度与各指标的相关性Table 2 Correlation between fruit hardness and index of jujube in different storage period
2.6 枣果硬度、细胞壁组分及其降解酶活力之间的通径分析
为进一步分析各指标对长枣硬度所起的真正作用,对其进行通径分析。结果如表3所示,各因素对枣果硬度的直接通径系数大小依次为CSP (-0.492 8)>β-Gal(-0.281 3)>A23(0.262 4)。对枣果硬度的贡献率大小依次为CSP (0.478 0)>β-Gal (0.272 9)>A23(0.251 9),与直接通径系数相一致。其中CSP和β-Gal活性对枣果硬度下降起促进作用,而A23起正向作用,有利于减缓红枣果实硬度的下降,上述因素决定了长枣硬度变异的99.979%,同时有0.014%的变异是由其他因素和试验误差引起的。
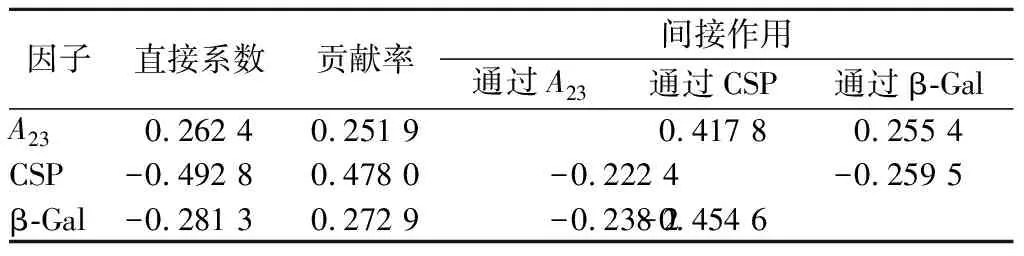
表3 不同贮藏期红枣果实硬度与各指标的通径分析Table 3 Hardness of jujube fruit in different storage periods and its path analysis
2.7 细胞壁多糖的纳米结构变化
为了进一步从微观角度解析长枣贮藏过程中硬度变化的机理,以AFM进行CSP降解的形态学研究。如图5所示,枣果贮藏初期CSP分子以聚集体结构(图5-A中“P”),丰富的长链结构及复杂的支链结构(图5-A中的“Lc”“Br”)形式存在。贮藏末期的聚集体结构,长链结构较初期的明显减少,大多以短链结构存在。表4给出了CSP分子的链宽及链高分布,贮藏初期的链宽值大多集中在35.156~58.594 nm,最高达到78.125 nm,对应的链高值大多在2 nm左右。而在贮藏末期,随着聚集体与长链的减少、支链的增加,短链(15.625、19.531、23.438、31.252 nm),出现的次数及频率均有所增加,与初期存在较大的差异,表明CSP在贮藏过程中降解显著。

表4 贮藏期间灵武长枣CSP链宽度的频率和高度Table 4 Frequency and height of CSP chain width
3 结论与讨论
果实软化是果实衰老的重要特征之一,枣果软化是由多种细胞壁降解酶协同作用下促使细胞壁多糖降解而引起细胞壁结构发生变化所导致,最后降低了硬度,水分迁移发生变化。本研究结果表明,在灵武长枣贮藏过程中,伴随着枣果硬度的降低,细胞壁降解酶活性增加,从而引起细胞壁多糖降解,网络结构破坏,水分迁移。CSP、β-Gal和液泡水水分含量对枣果软化衰老起着重要作用。CSP与β-Gal对枣果硬度下降起促进作用,彭勇等[21]在桃的研究中发现,桃在贮藏期间,随着桃硬度的下降、细胞壁发生降解,与本文研究结果一致;液泡水水分含量的降低使果实硬度下降,这与王娟等[22]研究结果一致。PG、PME、CE和β-Gal等细胞壁修饰酶均随贮藏时间的延长呈上升状态,且对枣果硬度有一定的影响。有研究表明[23],β-Gal可以降解果胶多聚醛酸侧链的半乳糖残基,改变分子链的结构,使得细胞壁膨胀,结合水减少,自由水增多。本实验中,枣果的β-Gal活性在贮藏前期出现了高峰,可以推测该酶可能在枣果软化前期起重要作用。
以AFM对CSP降解的形态学研究表明,贮藏初期与末期,枣果的CSP存在较大差异。贮藏初期枣果的CSP分子以聚集体、长链及支链结构形式存在,其链宽值大多集中在35.156~58.594 nm,最高达到78.125 nm,对应的链高值大多都在2 nm左右。伴随着枣果硬度的下降,贮藏末期的聚集体结构,长链结构较初期的明显减少,短链(15.625、19.531、23.438、31.252 nm)出现的次数及频率均有所增加,与初期存在较大的差异,表明CSP在贮藏过程中降解显著。CSP结构变化是引起长枣硬度降低的主要因素。综上所述,灵武长枣在采后贮藏过程中,伴随细胞壁降解酶活性的增加,引起细胞壁多糖的降解,破坏了细胞壁网络结构,水分与硬度也同步发生变化。相关分析结果表明,CSP、β-Gal和液泡水水分含量是影响枣果硬度的主要因素,为灵武长枣贮藏保鲜技术的开发提供了理论支持。
