钙调磷酸酯酶Calcineurin在控制马尔尼菲篮状菌无性发育、极性生长、压力应激中的作用研究
2022-05-09黄啟华罗宏潘开素廖柳维郑艳青曹存巍
黄啟华 罗宏 潘开素 廖柳维 郑艳青 曹存巍
(1.广西医科大学第一附属医院皮肤性病科,南宁 530021;2.广西卫生健康委员会真菌研究与真菌病防治重点实验室,南宁 530021;3.广西艾滋病防治研究重点实验室,南宁 530021;4.南宁市第四人民医院,南宁 530023;5.长沙市第一人民医院皮肤性病科,长沙 410005)
双相真菌马尔尼菲篮状菌(Talaromycesmarneffei, TM),在中国南方及东南亚呈区域性流行,25℃为菌丝相,37℃或进入人体则转变为酵母相,主要感染HIV等免疫力低下人群[1-2],是流行区艾滋病患者特征性的机会性感染和重要死亡因素[3-4]。目前认为,TM孢子通过呼吸道吸入后,被巨噬细胞所吞噬[2,5,6],面临严峻的压力胁迫,比如高渗透压应激、盐应激、氧化应激等[7]。但是TM可通过各种策略克服机体压力胁迫及免疫杀伤,最终在巨噬细胞内生长繁殖[7-8]。因此了解TM无性发育及压力应激适应对研究TM传播、免疫逃逸的分子机制具有重要意义。
研究发现钙调磷酸酯酶(calcineurin)在多种致病真菌的生长发育及压力应激中发挥重要作用。Calcineurin由催化亚基(cnA)和调节亚基(cnB)组成[9],其中calcineurin催化亚基编码基因cnaA(cna1)广泛参与烟曲霉、新生隐球菌、格特隐球菌、白念珠菌等病原真菌的高温(37℃)应激、血清存活、极性生长等生长致病过程[10-13]。而calcineurin调节亚基编码基因cnaB(cnb1)在不少病原真菌中起着与cnaA较为相似的作用[14-17],但在某些方面起着主要调控作用,比如构巢曲霉ΔcnaB敲除株表现出更为严重的产孢结构及产孢量缺陷[16]。我们前期研究首次证实cnaA在25℃下对TM无性发育、压力应激及致病等方面发挥重要作用:ΔcnaA产孢结构减少、对氧化,高渗透压等应激抵抗下降、细胞壁完整性受损、对小鼠毒力致病力明显减弱等[18-19]。然而,TM在37℃环境的应激反应是否与25℃有所差别并未清楚,且cnaB基因对TM生长发育及压力应激的作用尚未明确。
因此,继TM的cnaA基因功能研究之后,本研究对TM的cnaB在无性发育、极性生长及压力应激等方面进行探讨,同时进一步完善cnaA在TM形态发生、极性生长以及37℃下对包括血清存活、氧化应激在内的各种压力应激的调控作用,更全面地阐释calcineurin信号通路对TM生长、应激适应的影响。这也是首次在一种双相病原真菌中较为全面的阐释和对比cnaB及cnaA在无性发育、极性生长及压力应激的功能及差异。
1 材料和方法
1.1 实验菌株
FRR2161(wild-type)是TM国际标准菌株,也是TM基因功能研究专用菌株,由墨尔本大学Alex Andronopolous教授惠赠;cnaB基因敲除株(ΔcnaB)及其回补株(ΔcnaBcnaB+)、cnaA基因敲除株(ΔcnaA)由课题组前期成功构建,均经过Southern blotting验证。
1.2 菌株活化及菌悬液制备
将上述菌株分别接种于Aspergillusnidulansminimal medium(ANM)培养基25℃培养10 d后在ANM培养基上连续传代3次。第3代菌株培养14 d后用含有0.005%吐温80的双蒸水收取孢子,涡旋震荡5 min,静置后取上清液用高压过的滤膜过滤菌丝,使用细胞计数板进行孢子计数,调整至目标浓度。
1.3 生长速度及产孢量实验
测量25℃生长速率时,上述菌株各取1×105孢子接种至ANM平皿,每天定点进行菌落直径测量,直至第10天结束。用双蒸水收取上述各菌株培养14 d后孢子并计数,以此作为各菌株产孢量。测量37℃生长速率时,各菌株取5×105孢子至沙堡弱琼脂(Sabouraud’s Agar,SDA)培养基上,每天测量菌落直径,直至第10天。
1.4 形态发生
为了观察无性发育、菌丝形态发生过程,上述菌株分别接种至ANM 平皿25℃培养10~14 d,使用钙荧光白(calcofluor white,CFW)、4’6-二脒基-2-苯基吲哚(DAPI)染色后镜下观察并拍照。为观察酵母细胞形态发生,上述菌株分别接种至脑心浸出液(BHI)琼脂培养基,37℃培养6~10 d,CFW、DAPI染色后镜下观察拍照。
1.5 压力应激
为研究各菌株25℃压力应激适应能力,配备ANM培养基,分别添加:0.004%、0.008%十二烷基硫酸钠(sodium dodecyl sulfate,SDS);45 μg/mL、55 μg/mL刚果红(Congo red,CR);0.8 mol/L、1.0 mol/L氯化钾(KCl);1.5 mol/L、2 mol/L山梨醇(sorbitol);2 mmol/L、5 mmol/L过氧化氢(H2O2);0.1 mmol/L甲萘醌;5%、10%、20%胎牛血清(FBS)。为研究37℃压力应激适应能力,配备BHI培养基,分别添加:0.001%、0.003% SDS;5 μg/mL、10 μg/mL CR;0.3 mol/L、0.5 mol/L KCl;0.3 mol/L、0.7 mol/L sorbitol;1.5 mmol/L、3 mmol/L H2O2;1%、5%、10% FBS。
在甲萘醌应激实验中,各菌株取5×103、5×102孢子接种至ANM或含有0.1 mmol/L甲萘醌的ANM平皿中25℃培养6 d;在39℃存活实验中,各菌株均取5×105孢子接种至SDA平皿,39℃培养6 d后观察结果。同时各菌株均准备6管1×106/mL菌悬液,每种菌株各取3管放至4℃及25℃孵育,并分别在孵育1 h、3 h、6 h后每种菌株在2种温度菌悬液中各取5×103孢子接种至ANM培养基中,25℃培养6 d后观察生长情况。其余应激实验均取5×103各菌株孢子分别接种至相应应激培养基中,25℃或37℃培养6 d,观察其生长情况。
1.6 透射电镜
Wild-type和ΔcnaB菌株分别接种于ANM(25℃,10 d)或者BHI(37℃,5 d)培养基。收集新鲜菌株,使用3%戊二醛4℃固定2 h;1×PBS缓冲液4℃浸泡洗涤3次,每次10 min;1%锇酸溶液4℃下固定2 h;PBS洗涤3次,每次10 min;随后依次使用50%、70%、80%、90%乙醇溶液、1(90%乙醇)∶1(90%丙酮)、90%丙酮、100%丙酮3次逐级脱水,每次15 min;1(丙酮)∶1(包埋剂)室温静置1 h;纯包埋剂室温浸透2 h;最后用环氧树脂包埋、聚合、修块、超薄切片、染色后进行透射电镜观察。
2 结 果
2.1 菌落形态与生长速度
25℃培养6 d,wild-type、ΔcnaBcnaB+菌落均出现丰富蓬松的气生菌丝,菌落中央表现为灰绿色。而ΔcnaB始终表现为紧凑的白色菌落,中央凹陷,未见明显灰绿色分生孢子。在37℃培养6 d,wild-type表现为表面稍隆起的酵母样细胞,可见褐色色素扩散至培养基内。ΔcnaB、ΔcnaBcnaB+表现出与wild-type相似的形态(见图1A)。25℃或37℃时ΔcnaB较wild-type、ΔcnaBcnaB+表现出缓慢的生长趋势,而ΔcnaA与ΔcnaB生长趋势基本一致(见图1B)。
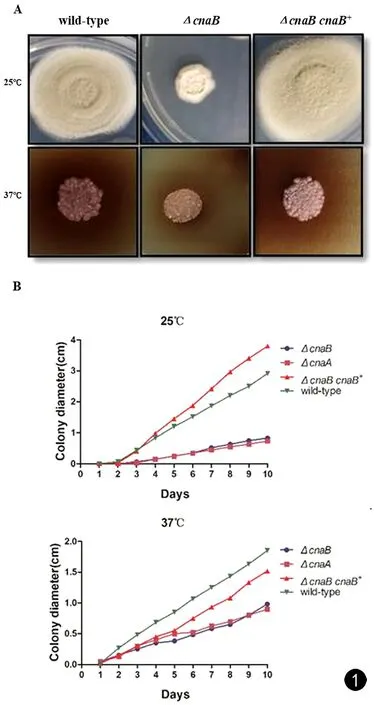
图1 A. wild-type、ΔcnaB、ΔcnaB cnaB+在ANM(25℃,6 d)或BHI(37℃,6 d)培养基上的形态特点;B. wild-type、ΔcnaB、ΔcnaA、ΔcnaB cnaB+在ANM(25℃)或SDA(37℃)生长10 d的直径变化
2.2 无性发育
25℃ wild-type可观察到典型的帚状枝,其顶端可见长孢子链(见图2A)。而ΔcnaB、ΔcnaA帚状枝少见,结构多不完整,更多的是只形成单个瓶梗,部分可见2~3个瓶梗,大部分瓶梗形态畸形,只产少量孢子或不产孢。CFW染色可见ΔcnaB、ΔcnaA分生孢子梗分隔增加(见图2D)。在第10天时ΔcnaB、ΔcnaA分生孢子梗的细胞分隔似乎发生溶解,使得细胞与细胞之间连接减弱甚至丧失,相邻细胞间出现不同程度的分离(见图2B)。其中ΔcnaA溶解分离程度和范围较ΔcnaB更严重和广泛,甚至可见到完全游离的细胞(见图2B、C)。另一方面,DAPI染色显示wild-type分生孢子梗各结构为单细胞核,而ΔcnaB、ΔcnaA异常膨大的分生孢子梗结构可见多个细胞核(见图2C);因细胞分隔溶解而与相邻细胞发生不同程度分离的这些细胞亦多为单细胞核(见图2C)。与wild-type大小形态均匀的孢子不同,ΔcnaB、ΔcnaA的孢子均表现出大小、形状不一的特点(见图2E)。产孢量结果显示,ΔcnaB产孢量较wild-type、ΔcnaBcnaB+明显减少,但ΔcnaB与ΔcnaA产孢量无明显差异(见图2F)。
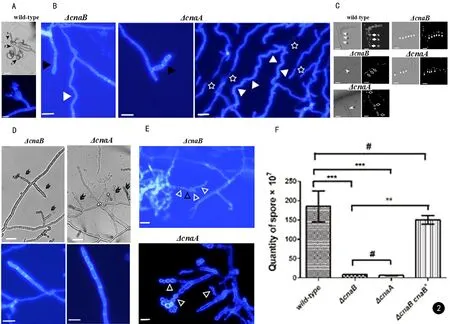
图2 A. 25℃ wild-type可见典型分生孢子梗 (S: stalk; P: phialide; C: conidia); CFW染色见wild-type分生孢子梗分隔均匀; B. ΔcnaB、ΔcnaA的stalk(黑色实心三角形)及菌丝(白色实心三角形)似乎于细胞分隔发生溶解,导致相邻细胞发生不同程度的细胞分离;ΔcnaA菌丝可见较多CFW染色不上(非实心星形); C. 左:wild-type分生孢子梗结构多表现为单个细胞核 (N, nucleus); 而ΔcnaB、ΔcnaA中异常膨大stalk表现出多细胞核现象(非实心棱形);右:由于分隔溶解所致的与相邻细胞发生分离的细胞多为单细胞核, 偶见双细胞核或细胞核缺失; ΔcnaA甚至可见完全分离的分生孢子梗细胞; D. 25℃ ΔcnaB、ΔcnaA更多见的是形成1个瓶梗, 部分可见2个瓶梗(黑色双箭头) , 产少量孢子甚至不产孢;CFW染色见ΔcnaB、ΔcnaA的stalk异常膨大, 分隔数量增加; E. ΔcnaB、ΔcnaA均可见大小不一(白色非实心三角形)、形状不一(黑色非实心三角形)的孢子; F. wild-type、ΔcnaB、ΔcnaA、ΔcnaB cnaB+的产孢量结果。#:P>0.05;*:P<0.05;**:P=0.001;***:P<0.001
2.3 形态发生
25℃ wild-type有着光滑细长、分隔均匀的竹节样菌丝(见图3A)。菌丝顶端不分支,其余菌丝细胞可形成分支。而ΔcnaB、ΔcnaA菌丝直径大小不一,延伸局限,不少菌丝分隔增加,菌丝中部可见异常膨大(见图3A)。菌丝顶端可见较多分支、其余菌丝细胞分支明显增多。菌丝分支有弯曲倾向,部分菌丝呈现出“卷曲球”特征(见图3B)。CFW染色显示ΔcnaB、ΔcnaA菌丝有较多几丁质沉淀或染不上色现象(见图3C、图2B)。ΔcnaB相邻菌丝可见有分支相互连接、融合(见图3C)。ΔcnaB、ΔcnaA菌丝中同样发现细胞之间发生不同程度的分离;ΔcnaA菌丝的细胞分离缺陷更严重(见图2B)。DAPI染色显示,wild-type菌丝多为单个细胞核,分布均匀。部分ΔcnaB、ΔcnaA菌丝,尤其是异常膨大菌丝可见多个细胞核(见图3D)。
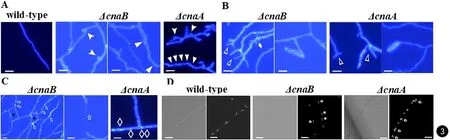
图3 A. CFW染色可见ΔcnaB、ΔcnaA部分菌丝中部膨大(白色实心箭头),分隔增加(白色实心三角形); B. ΔcnaB、ΔcnaA菌丝顶端均见有较多分支(白色非实心三角形)、其余菌丝细胞分支增多(白色实心棱形),部分菌丝呈现为“卷曲球”; C. ΔcnaB、ΔcnaA菌丝可见较多CFW染色不上(白色非实心星形以及图2B)或几丁质沉积现象(白色非实心棱形);且ΔcnaB中可见较多菌丝相互交联、融合(黑色实心星形); D. DAPI染色显示ΔcnaB、ΔcnaA部分菌丝,尤其是膨大菌丝可见多个细胞核(白色实心双箭头)
37℃ wild-type、ΔcnaB可见分隔均匀的关节菌丝以及形态相似的酵母细胞,CFW染色均匀。DAPI染色显示wild-type、ΔcnaB、ΔcnaA均可见1~2个细胞核(见图4A、B)。
2.4 细胞壁完整性
透射电镜显示,wild-type菌丝相细胞壁光滑、完整,大致可分为3层:靠近细胞膜的较薄的电子致密层,较厚的透明中间层以及电子密度较高的外层;胞内细胞器清晰可见。而ΔcnaB可见细胞壁结构疏松肿胀,细胞壁缺损、变形,细胞壁层次模糊,甚至出现细胞膜与细胞壁脱离,胞内细胞器减少。无论是wild-type还是ΔcnaB,其酵母相细胞壁与各自菌丝相相似(见图5A)。细胞膜/壁破坏剂应激实验进一步证实了CnaB对TM细胞壁的调控作用。25℃时,ΔcnaB、ΔcnaA较wild-type对SDS、CR敏感性增高;而ΔcnaB与ΔcnaA敏感性基本相同。37℃时,ΔcnaB、ΔcnaA较wild-type对SDS同样有着较高的敏感性;但与25℃不同,37℃ΔcnaB、ΔcnaA对CR表现出更强的耐受性,同样的该温度下ΔcnaB和ΔcnaA对SDS、CR敏感性基本一致(见图5B)。
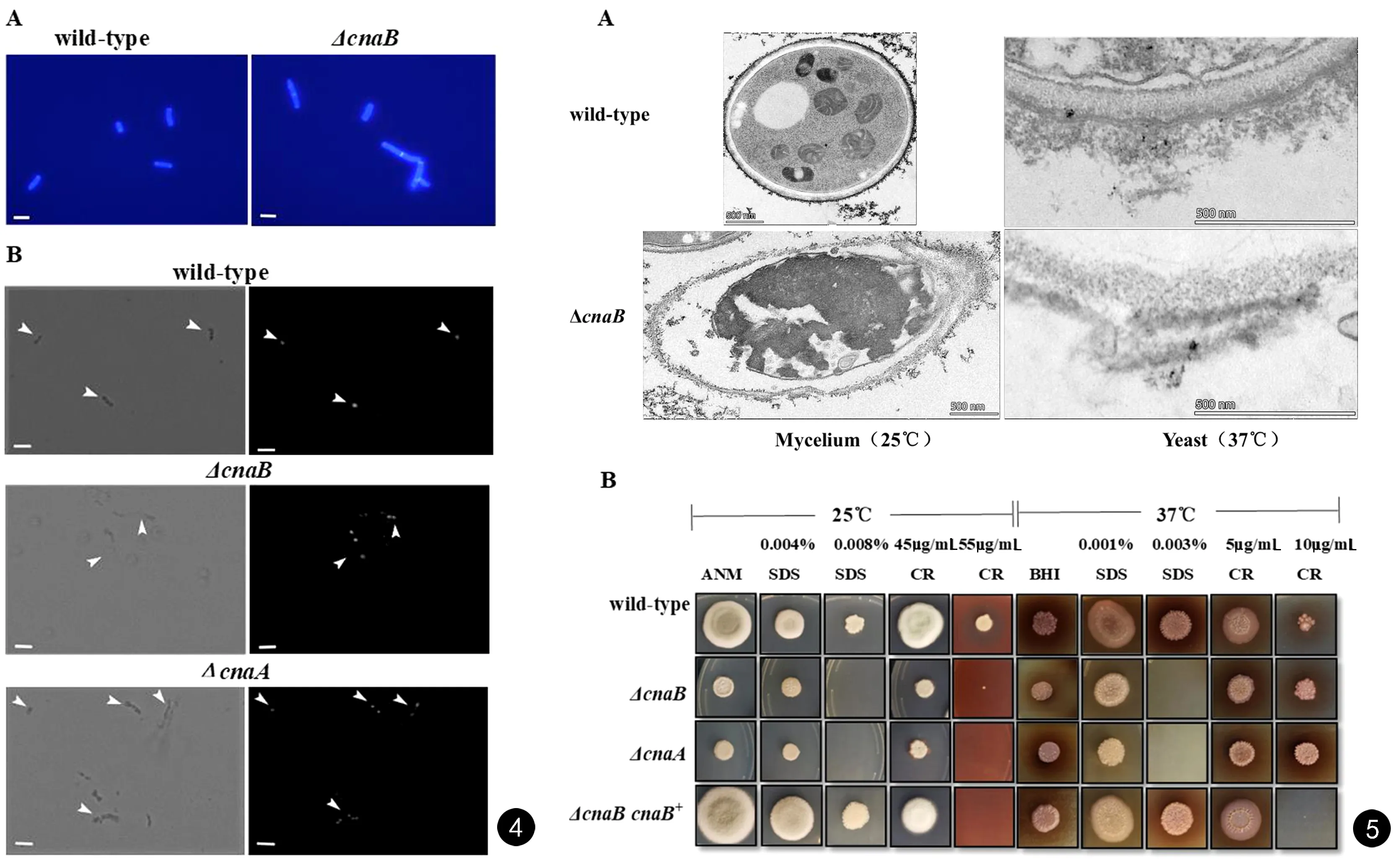
图4 A. 37℃ BHI培养5 d,wild-type、ΔcnaB可观察到形态相似的酵母细胞; B. DAPI染色示wild-type、ΔcnaB、ΔcnaA酵母细胞可见1~2个细胞核 图5 A. 25℃或37℃ wild-type、ΔcnaB透射电镜下细胞壁形态特点; B. 25℃或37℃ wild-type、ΔcnaB、ΔcnaA、ΔcnaB cnaB+在含有不同浓度SDS、CR培养基上生长情况
2.5 压力应激
25℃时ΔcnaB在KCl、sorbitol应激下有着与wild-type相似的敏感性;而对5 mmol/L H2O2则表现出更强的耐受性,但截至第6天,wild-type、ΔcnaB、ΔcnaBcnaB+在8 mmol/L H2O2应激下均未观察到明显生长。与H2O2应激情况不同,ΔcnaB较wild-type对0.1 mmol/L甲萘醌较为敏感。与ΔcnaB相比,25℃ΔcnaA对上述应激均表现出更高的敏感性(见图6A)。在37℃ΔcnaB及ΔcnaA对sorbitol、H2O2敏感性与wild-type、ΔcnaBcnaB+无明显差异;但对KCl表现出高敏感性。该温度下ΔcnaA与ΔcnaB对上述应激敏感性基本一致(见图6B)。
血清(FBS)、温度存活实验结果显示,wild-type、ΔcnaB、ΔcnaA、ΔcnaBcnaB+均能在含有20 % FBS(25℃)以及10 % FBS(37℃)培养基上生长(见图7A);在39℃培养6 d后,wild-type、ΔcnaB、ΔcnaA均可见表面皱褶的酵母样菌落(见图7B);同时各菌株孢子液放于4℃和25℃分别孵育1 h、3 h、6 h后转移至25℃培养6 d,同一种菌株在不同温度孵育未观察到明显的生长差异,同一种菌株在4℃孵育不同时间亦未见明显差异(见图7C),提示calcineurin并非TM在FBS或更高温度(39℃)或低温(4℃)存活所需。

图6 25℃(A)或37℃(B)wild-type、ΔcnaB、ΔcnaA、ΔcnaB cnaB+在含有不同浓度KCl、sorbitol、H2O2培养基上生长情况 图7 A. wild-type、ΔcnaB、ΔcnaA、ΔcnaB cnaB+在25℃或37℃,在含有不同浓度FBS培养基上生长情况; B. wild-type、ΔcnaB、ΔcnaA在39℃培养6 d后的生长情况; C. 将wild-type、ΔcnaB、ΔcnaA、ΔcnaB cnaB+各菌株孢子液同时放于25℃或4℃孵育1 h、3 h、6 h后接种至ANM平皿并在25℃继续培养6 d的生长情况
3 讨 论
极性生长是真菌发育分化为不同细胞类型所必需的[20],研究表明calcineurin信号通路参与烟曲霉、卷枝毛霉的菌丝极性生长,但具体机制尚未明确[21-22]。TM的ΔcnaB和ΔcnaA菌丝顶端细胞分枝异常增多,提示极性异常。同时,ΔcnaB、ΔcnaA菌丝呈现大小形态不一、几丁质沉积、异常膨大、细胞核增多等现象;菌丝及分生孢子梗均可见到细胞分隔溶解及细胞分离,提示cnaB和cnaA对菌丝正常形态维持、细胞壁完整性、细胞核活动及细胞分离均起着重要调控作用。而菌丝的极性、形态、细胞分离等异常导致TM的ΔcnaB和ΔcnaA生长直径明显慢于wild-type,并进一步引起无性发育异常及压力应激敏感性增高。同时与ΔcnaB相比,ΔcnaA表现出更严重的细胞溶解分离缺陷,提示cnaA可能在这方面发挥主要调控作用。
分生孢子被认为是TM的感染形式[2,5,23],双相转换被认为是TM重要致病机制[5,24],了解孢子产生、双相转换过程对阐明TM的致病机制具有重要意义。研究表明calcineurin信号通路参与构巢曲霉产孢过程,且相对于cnaA,cnaB可能起着主要调控作用[16]。本研究发现TM的ΔcnaB、ΔcnaA产孢量明显低于wild-type;显微镜观察到ΔcnaB、ΔcnaA有着分隔增加,细胞核增多的膨大分生孢子梗,这些分生孢子梗多不产孢;其余分生孢子梗帚状枝结构不完整,孢子链短,孢子大小形状不一;并且与构巢曲霉不同,TM的ΔcnaA的产孢缺陷基本与ΔcnaB相同。因此我们推测,cnaB、cnaA在TM产孢过程中起着同样重要的调控作用:通过调控分生孢子梗的分隔形成及细胞核活动、调节瓶梗及孢子的形成,维持分生孢子梗的正常形态结构及产孢功能。同时,作为一种胞内双相致病菌,在宿主内进行酵母相的转变并维持酵母相形态对TM致病有着重要意义[5]。我们前期研究发现TM的ΔcnaA在37℃下仍能形成酵母细胞[18-19];同样的本研究37℃ TM的ΔcnaB仍能出现与wild-type形态相似的关节菌丝及酵母细胞,且ΔcnaB、ΔcnaA酵母细胞核数量基本与wild-type一致,提示cnaB亦不是TM双相转换的关键基因。
生物有机体在其生命过程中必须应对不同的温度变化,比如季节性环境改变、全球气候改变[25];当TM进入机体引起发热时,TM也可受到37℃以上的温度应激;在新生隐球菌中,CNA1基因、CNB1基因均是在高温(37℃)生长所必需[11,14],然而本研究提示cnaA、cnaB似乎均不参与TM的高温(39℃)以及低温(4℃)应激,类似的,白念珠菌CNB1基因缺失后对不同温度(22 ~42℃)也不敏感[15],提示calcineurin在不同真菌中有着相对独特的作用。另外,TM在自然环境或是巨噬细胞内需克服盐应激、氧化应激等压力胁迫才能实现生长繁殖。我们前期研究发现25℃下cnaA参与了TM盐应激(KCl)、高渗透压应激(sorbitol)、氧化应激(H2O2)以及细胞壁应激(CR)[18-19]。而本研究进一步发现,37℃cnaA同样参与TM压力应激:细胞膜应激(SDS)、盐应激(KCl)。而不同的是,37℃下ΔcnaA对高渗透压应激(sorbitol)、细胞壁应激(CR)、氧化应激(H2O2)并不敏感。这种不同温度下的应激差异,除了cnaA在不同温度下有着不同的调控作用外,也有可能是其他原因所致,比如25℃ΔcnaA对H2O2敏感而37℃时不敏感,除了37℃cnaA可能不调控TM氧化应激外,还可能与该温度下TM过氧化氢酶-过氧化物酶编码基因CpeA表达增高有关[26]。同时,我们发现不同温度下cnaB在TM盐应激、渗透压应激、细胞壁应激、氧化应激中起着与cnaA相似或更弱的应激调控作用。其中,ΔcnaB在25℃ H2O2应激中未表现出明显调控作用,但进一步研究发现,ΔcnaB对甲萘醌显示出较高敏感性,提示cnaB可能也参与部分氧化应激适应。另一方面,透射电镜结果显示cnaB对TM菌丝相、酵母相细胞膜/壁完整性均有调控作用,细胞膜/壁破坏剂应激则进一步应证了该作用。当TM进入人体血循环时,可受到包括血清在内的各种成分的压力胁迫。研究表明白念珠菌cnb1/cnb1敲除株、烟曲霉calA敲除株对血清FBS敏感性增高[10,15]。然而TM的ΔcnaB和ΔcnaA在含20%(25℃)或10%(37℃)FBS平皿中均能生长,提示TM在血清(FBS)中存活可能不需要calcineurin信号通路的参与。
以上结果显示canA及cnaB通过调控TM无性发育、极性生长、形态发生,维持TM的正常生长繁殖,并通过调控25℃、37℃多种压力应激适应,促进TM成功克服严峻的体内外环境,实现致病。然而,calcineurin对TM的这些调控作用分子机制尚不清晰。研究指出,转录因子Crz1(CrzA)是calcineurin重要而保守的效应因子:calcineurin被激活后,对Crz1进行去磷酸化,后者继而进入细胞核内诱导相关基因表达从而发挥调控效应[27]。研究显示,calcineurin-CrzA信号通路参与烟曲霉孢子产生过程,并且该调控过程至少涉及brlA、wetA两个基因表达[28]。在白念珠菌中,calcineurin-Crz1信号通路则调控SDS应激、菌丝形成以及毒力[29];同时该通路对新型隐球菌SDS、CR的压力应激以及毒力也起着调控作用[30]。但Crz1(CrzA)又是通过何种分子机制发挥这些效应,目前尚未清晰,而使用转录组测序、微阵列芯片等技术有助于筛选出相关效应基因。另一方面,其他研究表明calcineurin除了Crz1(CrzA)外,还存在其他效应因子,比如Dig2、Rcn1、Atg13[27]。研究显示,stuA、abaA基因参与TM分生孢子梗或(和)瓶梗结构发生[23,31];cflA、cflB、rasA基因则参与TM菌丝形成及极性生长过程[32-33];yapA、cpeA等基因则参与TM氧化应激、亚硝化应激过程[26,34]。因此calcineurin对TM在无性发育、极性生长、压力应激的调控作用是否通过Crz1或是其他效应因子,激活stuA、abaA、cflA等效应基因从而发挥调控效应?这些问题仍需进一步探讨。
综上,与其他大多数病原真菌一致,cnaA和cnaB都是calcineurin功能完整性所必需,两者通过调控TM无性发育、极性生长、压力应激从而影响TM生长发育及致病。同时我们也发现:相对于ΔcnaB,ΔcnaA在25℃无性发育过程中的细胞分离、氧化应激(H2O2、甲萘醌)及盐应激(KCl)、渗透压应激(sorbitol)表现出更严重缺陷,提示cnaA在这些方面可能起着主要调控作用。同时本研究也表明,calcineurin,尤其是cnaA,或许可以成为TM抗真菌治疗的重要靶点。
