西藏牦牛肠出血性大肠杆菌HPI基因调查及耐药性分析
2022-05-09卢姊豪贡嘎常攀武琦李天骄吴丹罗润波索朗斯珠
卢姊豪 贡嘎 常攀 武琦 李天骄 吴丹 罗润波 索朗斯珠





摘要:为明确西藏牦牛源肠出血大肠杆菌强毒力岛(HPI)基因以及ESBLs耐药基因携带情况,复壮笔者所在实验室保存的14株牦牛源肠出血性大肠杆菌,采用麦康凯培养基和伊红美蓝培养基进行筛选,镜检确定复壮成功后,应用PCR方法检测HPI携带情况,并对HPI相关毒力基因进行克隆与序列分析,测序结果同时采用K-B纸片法对被检菌株进行药敏试验和ESBLs表型检测,最后应用PCR方法进行ESBLs耐药基因检测。结果显示,14株被检菌株中HPI标志性基因 fyuA 的携带率最高,达42.86%(6/14),其次分别为ybtA、irp2和irp8基因,携带率均为21.43%(3/14),irp3携带率为14.2%(2/14),而未检测到irp5阳性基因。分离菌株对青霉素、苯唑西林、氨苄西林、头孢氨苄、头孢唑林、头孢拉定、阿米卡星的耐药率均≥57.14%,对派拉西林、羧苄西林、头孢他啶、环丙沙星耐药率均 ≥21.43%,并存在多种耐药现象,耐药谱集中在3~10耐,其中6耐菌株最多,有5株,其次为8耐3株、7耐2株,10耐、9耐、5耐和3耐均1株。对被检菌株进行14种ESBLs类基因检测,结果发现被检菌株只携带1种ESBLs类基因,为 bla TEM基因,携带率21.43%(3/14)。综上,西藏牦牛源肠出血性大肠杆菌中存在HPI基因。对常用抗菌药产生较高的耐药性并存在多种耐药现象,但对ESBLs类药物具有较高的敏感性。
关键词:肠出血性大肠杆菌;强毒力岛;耐药性;西藏牦牛
中图分类号: S855.1+2 文献标志码: A
文章编号:1002-1302(2022)07-0051-08
收稿日期:2021-07-04
基金项目:国家肉牛/牦牛产业技术体系建设专项(编号:CARS-37);西藏自治区科技厅2019年度重点项目(编号:201901)。
作者简介:卢姊豪(1998—),女,北京人,硕士研究生,主要从事高原动物传染病研究,E-mail:670630168@qq.com;共同第一作者:贡 嘎(1983—),男,西藏拉萨人,博士研究生,主要从事高原动物传染病研究,E-mail:xzlzgg@163.com。
通信作者:索朗斯珠,博士,教授,主要从事高原动物传染病研究。E-mail:xzslsz@163.com。
目前,出血性大肠杆菌(enterohaemorrhagic Escherichia coli ,EHEC)是6种大肠杆菌中重要的食源性病原菌,给食品健康带来前所未有的挑战。牛源EHEC是引起人类大肠杆菌病的主要来源之一。据报道,国外健康牛以及牛肉中分离出EHEC(O46血清型)并给人类健康带来一定的危害[1-2]。赵燕娟等2019年从西藏牦牛体内分离鉴定出牦牛源肠出血性大肠杆菌并确定主要毒力基因为 ehxA [3],提示西藏牦牛群中确实存在肠出血性大肠杆菌。
强毒力岛(high pathogeniticity island,HPI)也称为耶尔森菌强毒力岛。它的核心基因主要有6种,分别为fyuA、irp2、irp8、irp5、ybtA和irp3组成,其中irp2和fyuA是HPI基因簇的核心基因[4]。耶尔森菌强毒力岛在大肠杆菌和耶尔森菌之间进行水平传播的相关报道很多,并与致病性大肠杆菌的毒力有关系[5]。Schubert等早在1997年就从大肠杆菌中检测到irp2和fyuA。但目前西藏牦牛肠出血性大肠杆菌HPI基因检测鲜有报道。
大肠杆菌引起的腹泻病是西藏牦牛的主要疾病之一,但由于抗菌药物的不合理使用,造成牦牛大肠杆菌耐药现象不断增多,给牦牛大肠杆菌病的防治带来严峻挑战。贡嘎等2014年报道西藏牦牛大肠杆菌耐药率较高且存在多重耐药现象[6],2020年王刚等报道西藏牦牛源肠产毒性大肠杆菌的ESBLs阳性率为55.3%,说明西藏牦牛大肠杆菌的耐药现象较为严重[7]。但目前未见检测西藏牦牛肠出血性大肠杆菌耐药性以及碳青霉烯类药物耐药性的相关报道。因此,本研究对笔者所在实验室保存的14株牦牛源肠出血性大肠杆菌进行首次HPI标志基因检测、耐药性检测及碳青酶烯类药物耐药性检测以明确西藏牦牛源肠出血大肠杆菌HPI基因及ESBLs耐药基因携带情况。
1 材料与方法
1.1 材料
14株牦牛源肠出血性大肠杆菌株由笔者所在实验室于2019年鉴定保存。其中,西藏阿里8株、日喀则3株、林芝2株、昌都1株,按以上順序分别命名为TBY1、TBY2、TBY3、TBY3、TBY4、TBY5、TBY6、TBY7、TBY8、TBY9、TBY10、TBY11、TBY12、TBY13、TBY14[4]。
1.2 主要试剂
大肠杆菌鉴别培养基由笔者所在实验室自制[8];常用抗菌药敏纸片购自杭州天和微生物试剂有限公司。Green Taq Mix、PCR试剂、核酸染料Gel View等购自丰科生物科技有限公司(昆明)。
1.3 细菌复苏培养及鉴定
待复苏的菌株接种在普通营养肉汤培养基上,在37 ℃振荡培养箱中培养18 h,观察培养特性,同时进行细菌革兰氏染色镜检观察。普通肉汤上生长的菌液划线接种至琼脂平板上,在37 ℃培养18 h后挑取单个菌落接种至麦康凯琼脂平板和伊红美蓝平板上,37 ℃培养,观察。
1.4 HPI相关基因PCR检测
提取细菌基因组DNA,根据文献[9]中报道的HPI基因引物进行PCR鉴定,引物序列见表1。PCR反应体系为:Green Taq Mix 25 μL,上游及下游引物各2 μL,模板 DNA 4 μL、dd H 2O 17 μL,50 μL体系。PCR扩增反应为:94 ℃预变性5 min;94℃ 30 s,退火温度见表1,72 ℃ 1 min,35个循环;72 ℃延伸10 min。最后采用1.5%琼脂糖凝胶电泳观察扩增结果。
1.5 药敏试验、ESBLs表型及ESBLs耐药基因检测
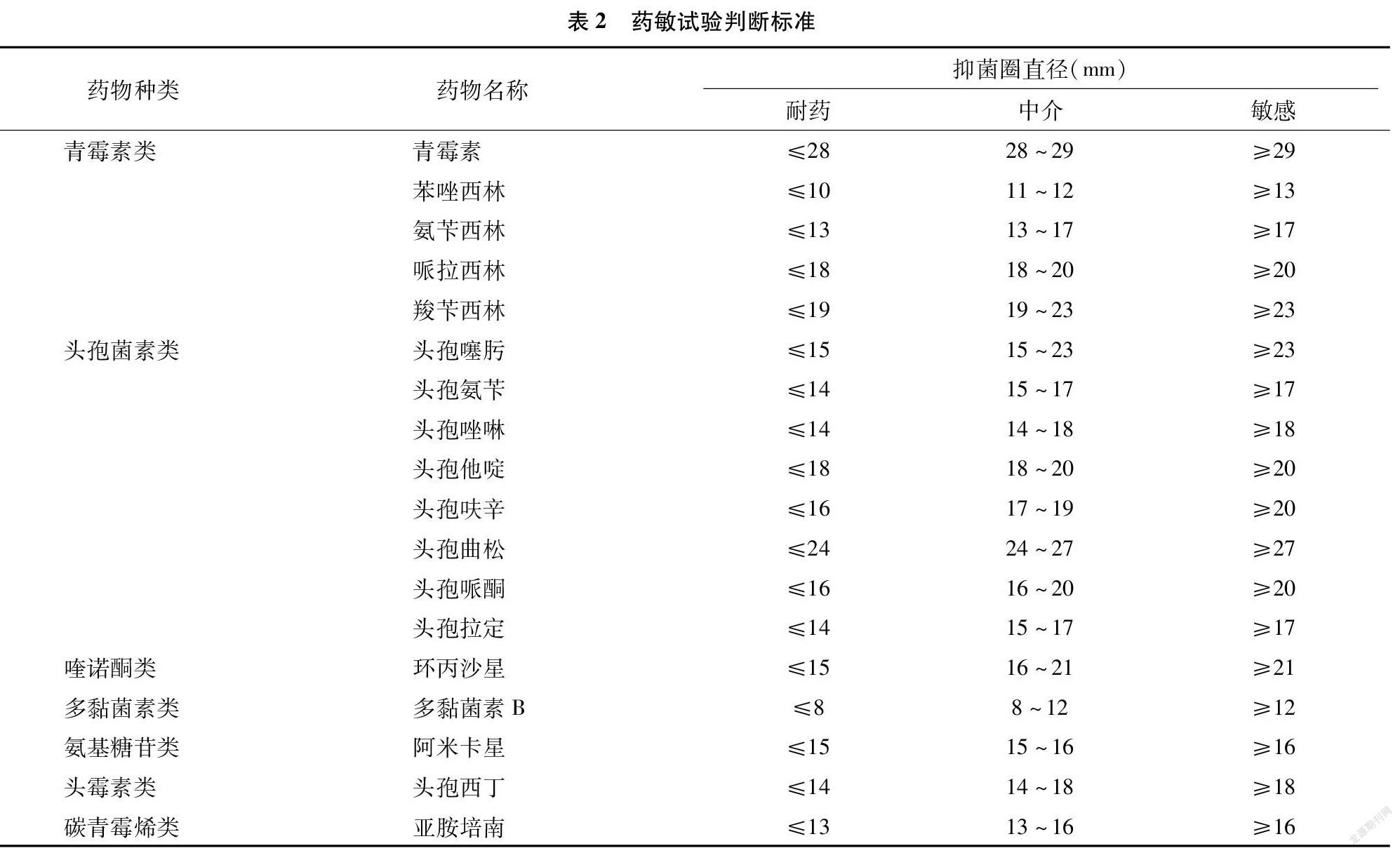
取成功复苏的菌液涂布接种至普通琼脂上,将临床常用17种抗生素药敏纸片和1种碳青霉烯类(亚胺培南)纸片贴于琼脂平板表面中央,倒置平皿,放于37 ℃培养箱中培养18~24 h后观察结果。抑菌结果参照美国临床实验室标准委员会(NCCLS)2013年公布的标准作出判定,具体见表2。
提取细菌基因组DNA,根据文献[9]中报道的ESBLs类基因引物进行PCR鉴定,引物序列见表3。PCR反应体系和程序见“1.4”节。
2 结果与分析
2.1 菌株復壮结果
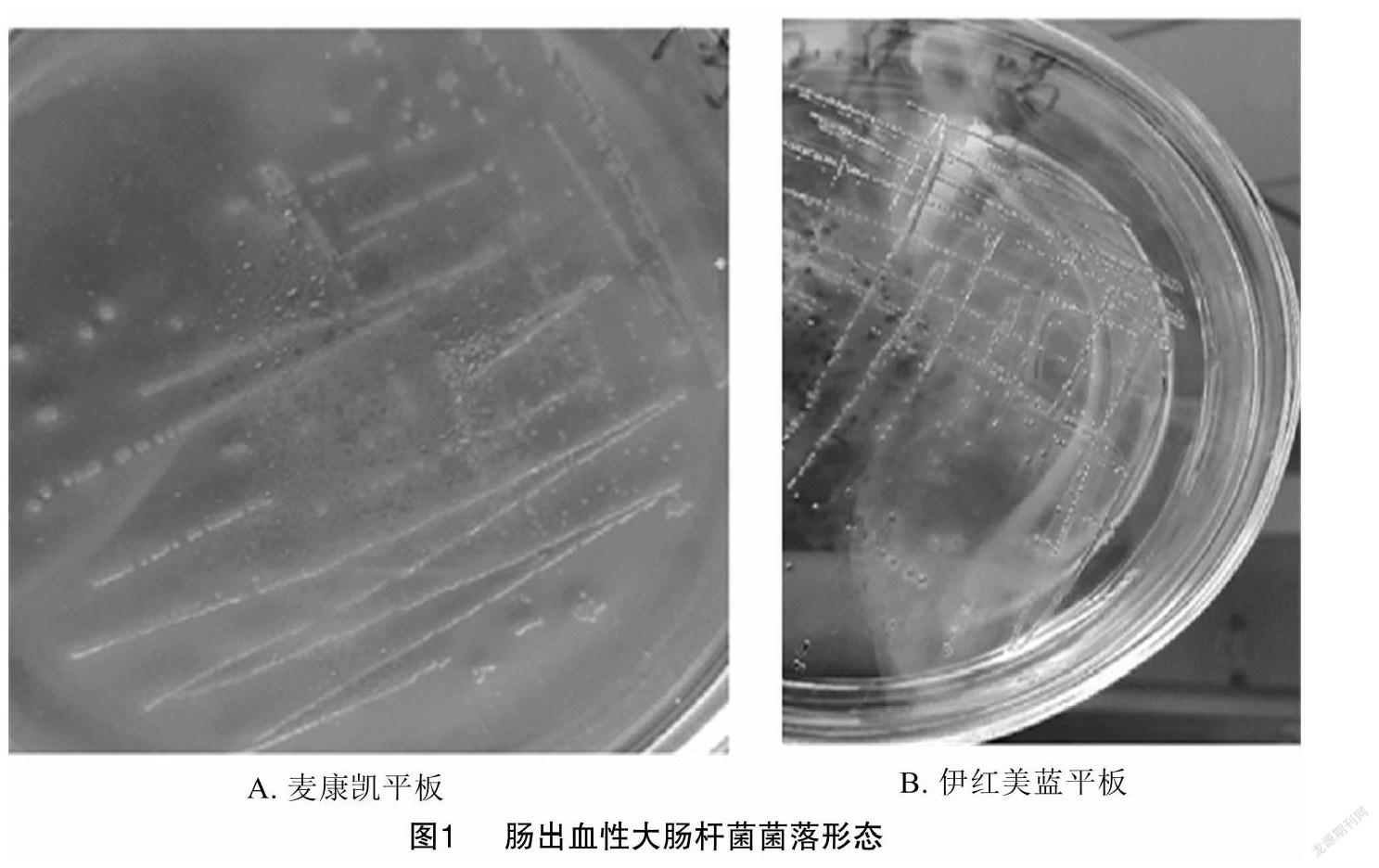
由图1可知,被检菌株在伊红美蓝上生长为黑色带金属光泽的湿润圆形菌落,在麦康凯上生长边缘整齐、表面光滑的典型红色菌落,革兰氏染色染结果为两端略圆的红色短杆菌。
2.2 fyuA 基因携带情况及进化分析
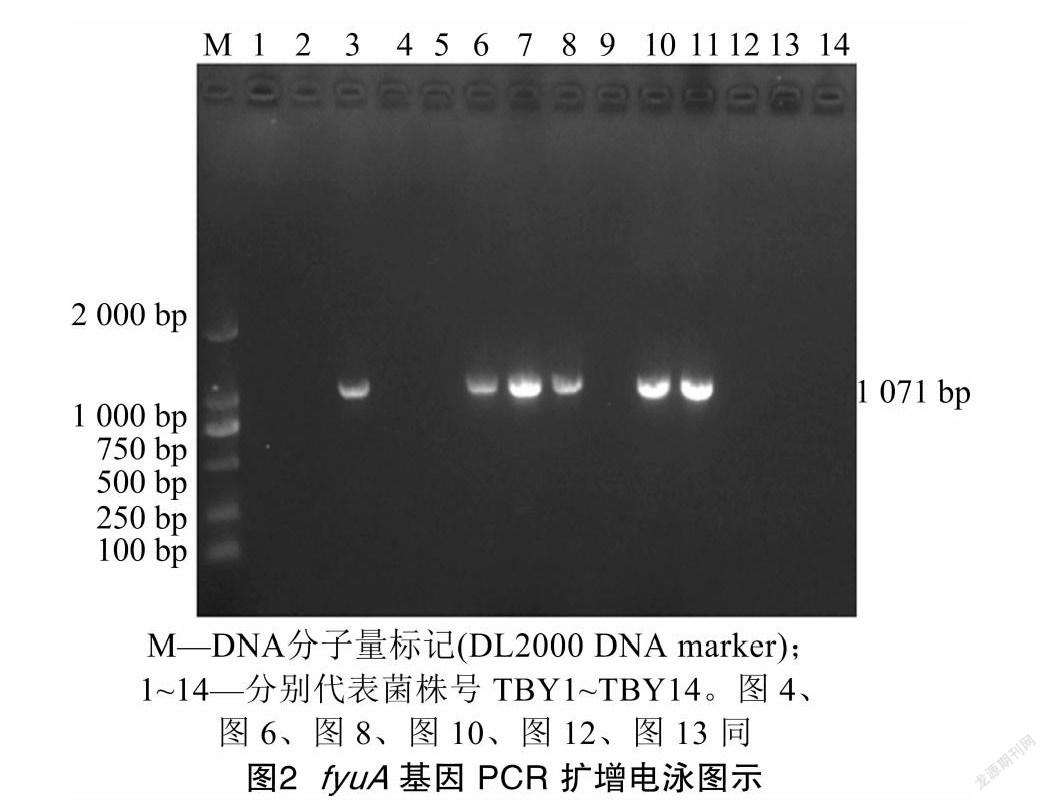
通过PCR检测、测序并在NCBI上进行比对,发现被检14株菌株中有6株与GenBank上 fyuA 基因同源性98%以上,确定为 fyuA 基因阳性,阳性率最高,达42.86%(6/14),分别为TBY3~TBY8,均来自西藏阿里;TBY10和TBY11,来自西藏日喀则。系统进化分析(图2、图3)显示,6株菌株与韩国人源CP026473和巴西人源CP0196的 fyuA 基因聚成一簇,亲缘关系较近。
2.3 irp2基因携带情况及进化分析
通过PCR检测、测序并在NCBI上进行比对,发现被检的14株菌株中有3株与GenBank上irp2基因同源性99%以上,确定为irp2基因阳性,阳性率最高,达21.43%(3/14),分别为TBY7来自西藏阿里,TBY10和TBY11来自西藏日喀则。系统进化分析(图4、图5)显示,3株菌株单独聚成一个小簇,与荷兰人源CP068990、美国鸡源CP056077、中国合肥鸭源CP045206及日本人源AP02411的irp2基因聚成一个大簇,亲缘关系相对较近。
2.4 irp3基因携带情况及进化分析
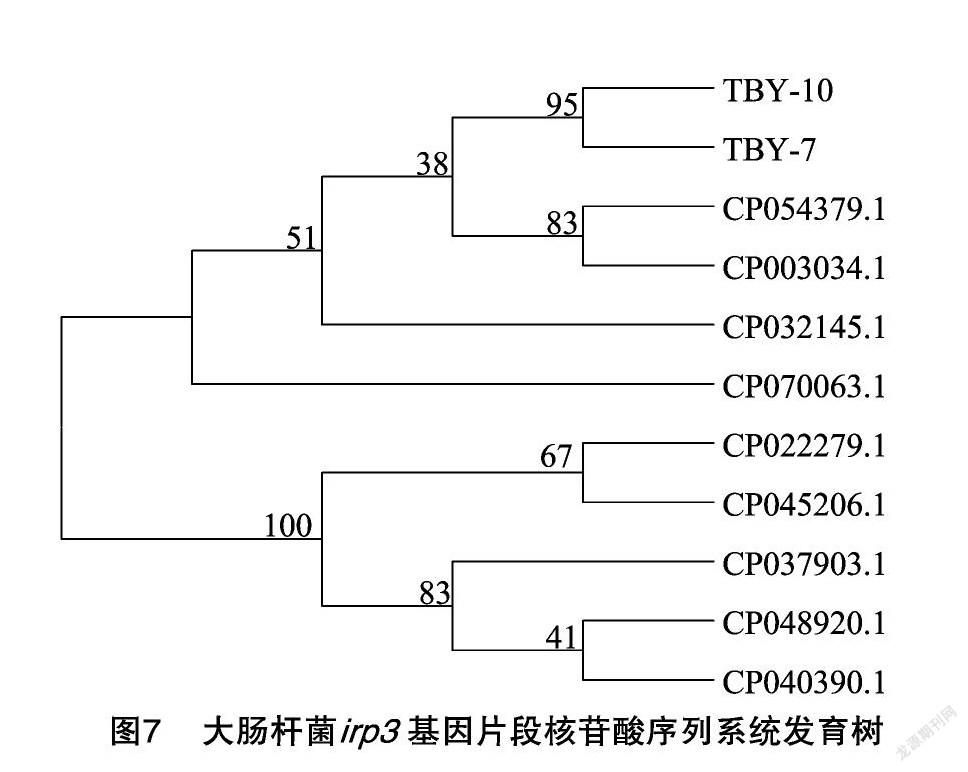
通过PCR检测、测序并在NCBI上进行比对,发现被检的14株菌株中有2株与GenBank上irp3基因同源性98%以上,确定为irp3基因阳性,阳性率最高,达14.29%(2/14),分别为TBY7来自西藏阿里,TBY10来自西藏日喀则。系统进化分析(图6、图7)显示,2株菌株与美国人源CP054379CP003034的irp3基因聚成一簇,亲缘关系相对较近,而其他物种鸡源、旱濑源、鸭源等irp3的基因亲缘性较远。
2.5 irp8基因携带情况及进化分析
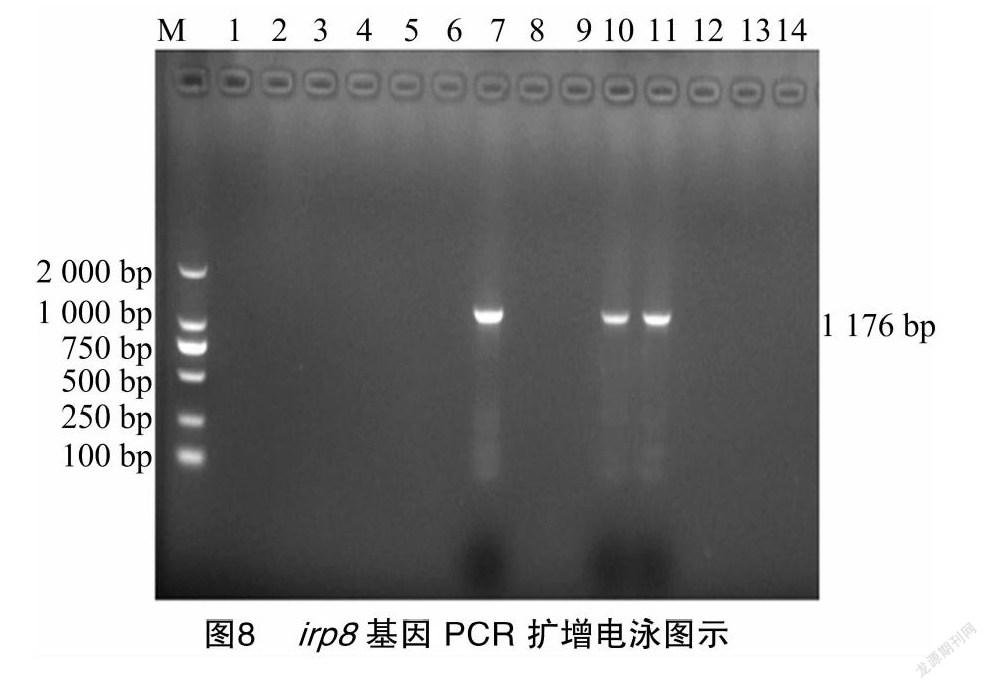
通过PCR检测、测序并在NCBI上进行比对,发现被检的14株菌株中有3株与GenBank上irp8基因同源性98%以上,确定为irp8基因阳性,阳性率最高,达21.43%(3/14),分别为TBY7来自西藏阿里,TBY10和TBY11来自西藏日喀则。系统进化分析(图8、图9)显示,3株菌株与美国人源CP054353和中国杭州人源CP04101的irp8基因亲缘关系相对较近。
2.6 ybtA 基因携带情况及进化分析
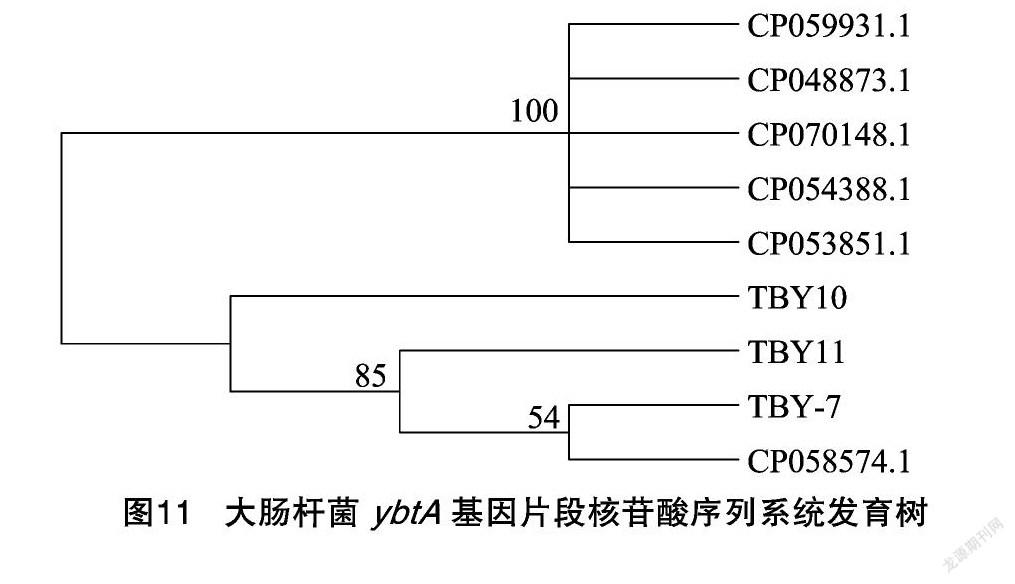
通过PCR检测、测序并在NCBI进行比对,结果发现,被检的14株菌株中有3株与GenBank上 ybtA 基因同源性98%以上,确定为 ybtA 基因阳性,阳性率最高,达21.43%(3/14),分别为TBY7来自西藏阿里,TBY10和TBY11来自西藏日喀则。系统进化分析(图10、图11)显示,3株菌株与澳大利亚智人源CP058574的 ybtA 基因亲缘关系相对较近。
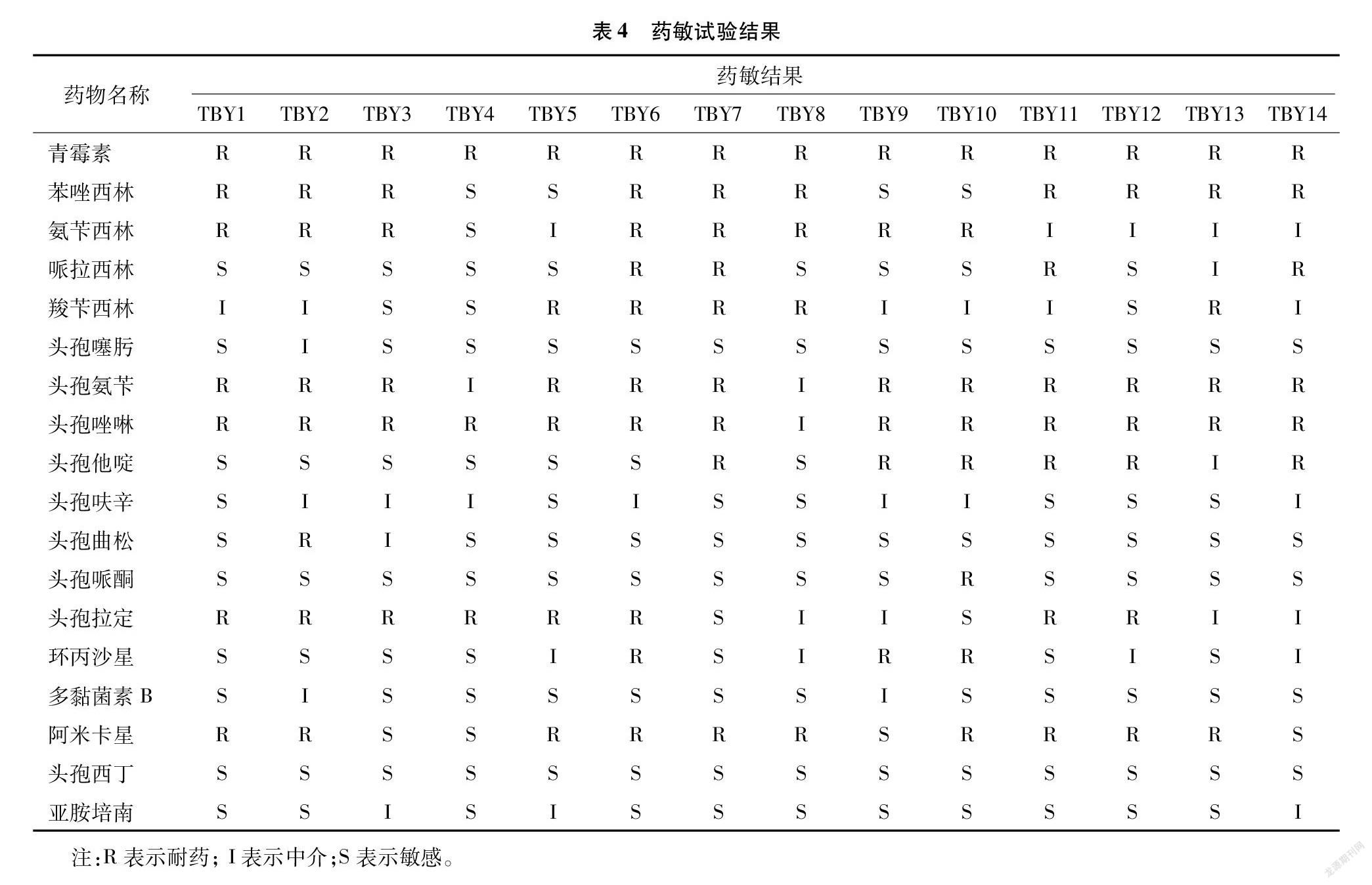
2.7 耐药表型结果
由药敏试验结果(表4)可知,本研究对牦牛源肠出血性大肠杆菌进行7类18种抗菌药物耐药表型检测,结果耐药率达到50%以上的有7种药物,耐药最严重的是青霉素(100%),其次是头孢唑林、头孢氨苄、苯唑西林、阿米卡星、头孢拉定和氨苄西林,耐药率分别为92.86%、85.71%、71.43%、71.43%、5714%和57.14%。并且存在多重耐药现象,其中,6耐5株、8耐3株、7耐2株,10耐、9耐、5耐和3耐均为1株。14株被检菌株对碳青霉素烯类(亚胺培南)、头孢噻肟、头孢呋辛、头孢曲松、头孢哌酮、多黏菌素B和头孢西丁等7种药物敏感率100%。
2.8 ESBLs基因检测结果
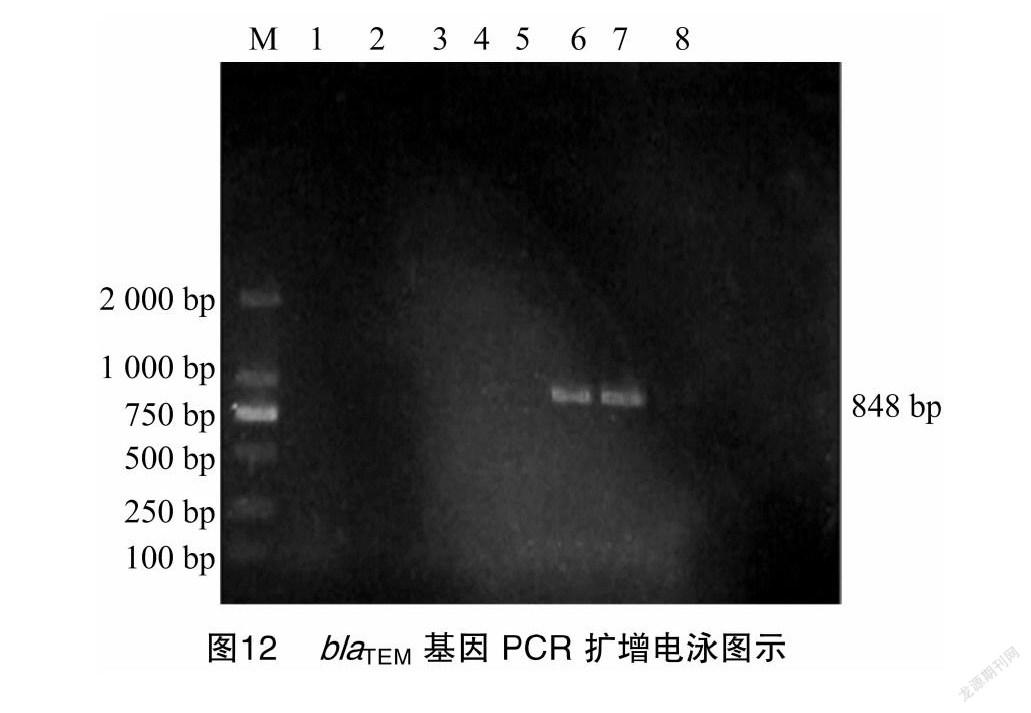
对14株牦牛源肠出血性大肠杆菌进行14种ESBLs类基因的检测,结果发现被检菌株只携带1种ESBLs类基因,为 bla TEM基因,携带率21.43%(3/14)。PCR扩增电泳图见图12、图13。
3 讨论
致病性大肠杆菌毒力的强弱与从宿主摄取铁的能力直接相关。强毒力岛(HPI)基因是致病性大肠杆菌的重要毒力因子,具有保守的核心区域,致病性大肠杆菌在宿主体内获得这些毒力因子并生存在宿主体内,最终导致宿主发病。此外,这些毒力因子可在人和动物间发生水平转移,因此,存在一定的公共卫生安全问题。
耶尔森菌强毒力岛是牛源、兔源、人源致泻性大肠杆菌的重要毒力因子[10-13],但有关西藏地区牦牛源大肠杆菌HPI毒力岛的检测尚未见报道。本研究复苏笔者所在实验室保存的牦牛源肠出血大肠杆菌14株,通过PCR方法检测其强毒力岛基因fyuA、irp2、irp3、irp8,ybtA、irp5。结果发现,14株牦牛源肠出血性大肠杆菌中检出5种HPI基因,分别为 fyu A、 irp 2、 irp 3、 irp 8和 ybt A,检出率分别为4286%(6/14)、21.43%(3/14)、14.2%(2/14)、21.43%(3/14)和21.43%(3/14),其中 fyuA 基因检出率最高。
fyuA和irp2基因是HPI基因簇的主要结构基因之一,编码产物对于细菌在低铁环境下的生存具有重要的意义。本研究中 fyuA 基因携带率最高,为42.86%(6/14),远低于高海慧等报道的宁夏犊牛大肠杆菌的阳性率82.67%(62/75)[8]、朱利霞等报道的河北肉牛溶血性大肠埃希菌的阳性率957%(22/23)[13]和元振杰等报道的新疆致犊牛腹泻大肠杆菌的阳性率91.67%(11/12)[14],而高于王姣姣等报道的吉林省犊牛腹泻大肠杆菌的检出率30%(10/33)[15]和徐继英等报道的中国北京等7个省份奶牛乳腺炎源大肠杆菌的阳性率18.94%(36/190)[16]。与不同种动物(猪源、禽源)相比,本次结果与云南撒坝猪源大肠杆菌的检测率43.18%(19/44)[17]基本相一致,辽宁锦州地区鸡大肠杆菌的检测率18.7%(28/150)[18]明显低于本次结果。不同地域、不同品种的动物之间 fyuA 基因检出率的差异原因有待进一步研究。有研究表明,irp2基因仅在强致病性大肠杆菌中才能存在,本研究中被检的14株菌株中irp2基因的检出率为21.43%(3/14)[19]。此外,14株被检菌株对6种毒力基因组合模式进行分析发现,携带5种基因的菌株3株,分别为TBY7、TBY10和TBY11,毒力基因组合模式为:irp2+irp3+irp8+fyuA+ybtA,占阳性菌株的3571%。与孙武文研究的携带5种基因的模式[20]一致,这是否成为牛种动物致病性大肠杆菌的HPI毒力基因的组合模式需要更多数据的支撑。
新德里金属 β -内酰胺酶(NDM)能够水解所有金属内酰胺酶(除单环 β -内酰胺酶类外)[22-23],在革兰氏阴性细菌临床治疗中碳青霉烯酶是最后一道防线[24-25]。世界范围内传播的NDM阳性菌株已发现,给临床管理和公共卫生带来了严重的影响[26]。 bla NDM基因可随著优势克隆株或质粒在动物、动物性食品和人之间快速传播[27]。因此,即便碳青酶烯类药物被禁用于动物养殖和动物临床,在动物中也会出现NDM阳性细菌的报道,首次报道是2009年[28],随后全球多个国家和地区相继报道了 bla NDM 基因的发现[29]。近几年,我国个别地区动物群中NDM阳性细菌报道较多[30-32]。2020年王刚等首次报道西藏地区存在产ESBLs大肠杆菌菌株[7]。本研究对牦牛源出血性大肠杆菌进行7类18种抗菌药物耐药表型检测,结果耐药率达到50%以上的有7种药物,其中青霉素耐药率最高,达到100%。14株被检菌株对碳青霉素烯类(亚胺培南)、头孢噻肟、头孢呋辛、头孢曲松、头孢哌酮、多黏菌素B和头孢西丁等7种药物敏感率100%。本次检测的奎诺酮类药物、头霉素类及大部分头孢菌素类的耐药表型结果与王刚等报道西藏牦牛源肠产毒性大肠杆菌的耐药检测结果[7]一致,但头孢噻肟的耐药性结果完全相反,这可能与被检大肠杆菌的种类不同有一定的关系。另外,测试了14株分离菌ESBLs基因携带情况,发现仅有3株大肠杆菌携带 bla TEM基因,携带率21.43%(3/14),其余菌株均未检测到ESBLs基因,这与本次试验耐药表型结果一致。
王刚等报道西藏牦牛源肠产毒性大肠杆菌ESBLs基因检出率为55.3%,其中,TEM检出率为78.9%[7],王警等报道江苏奶牛源大肠杆菌ESBLs基因检出率为11.2%,其中TEM检出率为100%[9]。本次西藏牦牛源肠出血大肠杆菌ESBLs基因检出率7.14%,TEM检出率为21.43%,检出率远低于以上报道的结果。而佟盼盼等报道新疆牛源产志贺毒素大肠杆菌ESBLs基因鉴定,结果ESBLs检出率为1.91%,并说明检测到的主要是 bla TEM和 bla CTX-M[33],本次结果与之一致。
HPI是一个强毒力岛,含有HPI的大肠杆菌毒力要高于不含HPI的大肠杆菌,因此,HPI可能增强细菌的致病力。牦牛腹泻病是西藏地区牦牛主要传染病之一,对牦牛的生产带来很大的危害。其中,大肠杆菌是牦牛腹泻病的主要病原菌。本研究首次对西藏地区分离鉴定的14株牦牛源肠出血性大肠杆菌进行HPI的主要基因检测,填补了这一研究数据空白。此外,监测了西藏地区牦牛源肠出血性大肠杆菌ESBLs基因的携带情况,可为西藏牦牛致病性大肠杆菌引起的腹泻病防治提供理论支撑。
参考文献:
[1]Janezic K J,Ferry B,Hendricks E W,et al. Phenotypic and genotypic characterization of Escherichia coli isolated from untreated surface waters[J]. The Open Microbiology Journal,2013,7(1):9-19.
[2]于学辉,李 键,程安春,等. 鸭出血性大肠杆菌O46分离株实验病理模型的建立[J]. 中国农业科学,2013,46(24):5217-5227.
[3]赵燕娟,王 刚,索朗斯珠. 西藏牦牛源肠出血性大肠杆菌毒力基因检测与进化分析[J]. 中国农业大学学报,2019,24(2):107-114.
[4]Carniel E,Guilvout I,Prentice M. Characterization of a large chromosomal “high-pathogenicity island” in biotype 1B Yersinia enterocolitica [J]. Journal of Bacteriology,1996,178(23):6743-6751.
[5]Smati M,Magistro G,Adiba S,et al. Strain-specific impact of the high-pathogenicity island on virulence in extra-intestinal pathogenic Escherichia coli [J]. International Journal of Medical Microbiology,2017,307(1):44-56.
[6]贡 嘎,王 刚,拉 珍,等. 西藏牦牛大肠杆菌对常用抗菌药物的耐药性分析[J]. 中国兽医杂志,2014,50(8):80-82
[7]王 刚,赵燕娟,索朗斯珠,等. 38株西藏牦牛源肠产毒性大肠杆菌ESBLs基因型检测及耐药性分析[J]. 江苏农业科学,2020,48(14):211-214.
[8]高海慧,黎玉琼,高小斐,等. 犊牛腹泻源大肠杆菌耐药情况及HPI相关基因的检测[J]. 中国畜牧兽医,2020,47(6):1942-1951.
[9]王 警,张雪寒,郭芸芸,等. 江苏地区奶牛场 bla NDM阳性大肠杆菌的分子流行病学[J]. 江苏农业学报,2020,36(2):391-397.
[10]Bach S,de Almeida A,Carniel E. The Yersinia high-pathogenicity island is present in different members of the family Enterobacteriaceae[J]. FEMS Microbiology Letters,2000,183(2):289-294.
[11]Clermont O,Bonacorsi S,Bingen E.The Yersinia high-pathogenicity island is highly predominant in virulence-associated phylogenetic groups of Escherichia coli [J]. FEMS Microbiology Letters,2001,196(2):153-157.
[12]Penteado A S,Ugrinovich L A,Blanco J,et al. Serobiotypes and virulence genes of Escherichia coli strains isolated from diarrheic and healthy rabbits in Brazil[J]. Veterinary Microbiology,2002,89(1):41-51.
[13]朱利霞,王洪彬,赵希艳,等. 肉牛溶血性大肠埃希菌分离鉴定和毒力与耐药基因检测及药敏试验[J]. 动物医学进展,2019,40(7):128-133.
[14]元振杰,王 燕,夏晨阳,等. 致犊牛腹泻大肠杆菌对小鼠致病性及LEE、HPI毒力岛的检测[J]. 西南农业学报,2014,27(5):2212-2215.
[15]王姣姣,孙武文,陈 龙,等. 吉林省部分地区犊牛腹泻大肠杆菌的分离鉴定与强毒力岛(HPI)相关序列分析[J]. 黑龙江畜牧兽医,2016(9):58-61.
[16]徐继英,杨志强,陈化琦,等. 奶牛乳腺炎源大肠杆菌中耶尔森菌强毒力岛相关基因的检测及序列分析[J]. 中国农业科学,2012,45(6):1199-1205.
[17]刘超英,蒋 欢,单春兰,等. 云南撒坝猪源大肠杆菌优势血清型强毒力岛的检测及其致病性[J]. 中国兽医学报,2019,39(8):1484-1489.
[18]蒋 月,盛鹏飞. 鸡源大肠杆菌中HPI和LEE毒力岛相关基因的检测[J]. 中国家禽,2014,36(21):54-56.
[19]Magistro G,Magistro C,Stief C G,et al. The high-pathogenicity island (HPI) promotes flagellum-mediated motility in extraintestinal pathogenic Escherichia coli [J]. PLoS One,2017,12(10):e0183950.
[20]孫武文. 我国北方地区犊牛腹泻大肠杆菌HPI分子结构组成及其菌蜕的研究[D]. 长春:吉林农业大学,2016:1-103.
[21]Yong D,Toleman M A,Giske C G,et al. Characterization of a new metallo- β -lactamase gene, bla (NDM-1),and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India[J]. Antimicrobial Agents and Chemotherapy,2009,53(12):5046-5054.
[22]Marrs E C L,Day K M,Perry J D. In vitro activity of mecillinam against Enterobacteriaceae with NDM-1 carbapenemase[J]. Journal of Antimicrobial Chemotherapy,2014,69(10):2873-2875.
[23]Nicolau D P.Carbapenems:a potent class of antibiotics[J]. Expert Opinion on Pharmacotherapy,2008,9(1):23-37.
[24]Moellering R C Jr.NDM-1:a cause for worldwide concern[J]. The New England Journal of Medicine,2010,363(25):2377-2379.
[25]Wang Y,Zhang R M,Li J Y,et al. Comprehensive resistome analysis reveals the prevalence of NDM and MCR-1 in Chinese poultry production[J]. Nature Microbiology,2017,2:16260.
[26]王 剛,赵燕娟,索朗斯珠,等. 38株西藏牦牛源肠杆菌ESBLs基因型检测及耐药性分析[J]. 江苏农业科学,2020,48(14):211-214.
[27]Nordmann P,Naas T,Poirel L. Global spread of Carbapenemase-producing Enterobacteriaceae[J]. Emerging Infectious Diseases,2011,17(10):1791-1798.
[28]孙 坚,刘雅红,冯友军. 动物源细菌耐药性研究现状与对策[J]. 生物工程学报,2018,34(8):1246-1258.
[29]Liu B T,Song F J,Zou M,et al. High incidence of Escherichia coli strains coharboring mcr-1 and bla NDM from chickens[J]. Antimicrobial Agents and Chemotherapy,2017,61(3):e02347-16.
[30]Kong L H,Lei C W,Ma S Z,et al. Various sequence types of Escherichia coli isolates coharboring bla NDM -5 and mcr-1 genes from a commercial swine farm in China[J]. Antimicrobial Agents and Chemotherapy,2017,61(3):e02167-16.
[31]Lin D C,Xie M M,Li R C,et al. IncFII conjugative plasmid-mediated transmission of bla NDM -1 elements among animal-borne Escherichia coli strains[J]. Antimicrobial Agents and Chemotherapy,2016,61(1):e02285-16.
[32]He T,Wang Y,Sun L C,et al. Occurrence and characterization of bla NDM -5-positive Klebsiella pneumoniae isolates from dairy cows in Jiangsu,China[J]. Journal of Antimicrobial Chemotherapy,2016,72(1):90-94.
[33]佟盼盼,杨银萍,谢金鑫,等. 乌鲁木齐市宠物犬、猫粪源大肠杆菌耐药性分析与ESBLs基因型检测[J]. 中国农业大学学报,2020,25(11):90-98.
