甜橙 NHX 基因家族的鉴定及功能分析
2022-05-09杨杰陈蓉胡文娟吴巧玲佟晓楠李兴涛陈健美
杨杰 陈蓉 胡文娟 吴巧玲 佟晓楠 李兴涛 陈健美


摘要:Na+/H+逆向转运(Na+/H+exchange or antiporter,NHX)蛋白家族的氨基酸序列具有Na+/H+exchange 蛋白结构域,在植物生长发育和非生物胁迫应答中发挥重要作用。为探究甜橙( Citrus sinensis ) NHX 基因家族的生物学特性,本研究从甜橙基因组中鉴定出6个 NHX 基因家族成员,并对其理化性质、基序组成、进化关系、表达谱等进行分析。结果显示, CsNHXs 编码蛋白的长度为407~543个氨基酸,分子量为44.71~59.97 ku;所有 CsNHXs 非均匀地分布在5条染色体上,均具有保守的Na+/H+exchange结构域;蛋白质二级结构分析结果表明,甜橙NHX蛋白主要以 α-螺旋和无规则卷曲为主。与拟南芥( Arabidopsis thaliana )、水稻( Oryza sativa )的NHX蛋白一起構建的系统进化树聚类为3个亚群,甜橙NHX蛋白分布在Endo和Vac亚群中。顺式作用元件预测分析结果表明, CsNHXs 启动子区域包含多个植物的生长发育响应元件、激素响应元件和逆境响应元件。转录组数据分析结果表明, CsNHXs 在甜橙不同组织中的表达存在差异性,总体上分为特异性表达和普遍性表达。本研究系统分析了甜橙 NHX 基因家族,为进一步阐明甜橙 NHX 基因家族的功能提供了理论依据。
关键词:甜橙; NHX 基因家族;生物信息学;基因表达;顺式作用元件
中图分类号:S666.401 文献标志码: A
文章编号:1002-1302(2022)07-0035-08
收稿日期:2021-10-17
基金项目:国家自然科学基金(编号:32060667、32160731);江西省教育厅科学技术研究项目(编号:GJJ190758、GJJ180758)。
作者简介:杨 杰(1995—),男,山西吕梁人,硕士研究生,主要从事果树逆境生理研究。E-mail:yangjiepersist@qq.com。
通信作者:陈健美,博士,副教授,主要从事柑橘遗传育种研究。E-mail:chen_jm09@hotmail.com。
Na+/H+逆向转运(Na+/H+exchange or antiporter,NHX)蛋白属于阳离子/质子逆向转运体1(cation/proton antiporter-1,CPA1)超家族,具有保守的Na+/H+exchange 结构域[1]。NHX蛋白能将细胞内Na+排除或区隔化来保持植物细胞内较低水平的Na+浓度[2],具有调节细胞内pH值、控制细胞扩增和维持细胞膨压的功能,是响应植物抗旱耐盐机制的关键因子[3]。
NHX 基因广泛存在于植物中,现已在拟南芥[4]、水稻[5]、玉米[6]、苹果[7]、香蕉[8]等植物中发现了该基因家族蛋白。其中,部分 NHX 基因的功能也已经被验证。过表达AtNHX1的拟南芥株可以在200 mmol/L NaCl溶液中持续生长和发育[9];将水稻OsNHX1超表达,可以提高转基因水稻株的耐盐性[5];过表达SsNHX1的转基因玉米株在10 mg/mL NaCl溶液中有较高的种子发芽率和较小的生理损伤[10];刘威等通过施加10%聚乙二醇(PEG)6000、100 mmol/L脱落酸(ABA)提高了杜梨叶片中PbNHX1的转录水平[11];另外Bao等利用转基因技术将霸王ZxNHX1转入百脉根后,发现转基因株系的叶片和根中积累了比对照更多的Na+、K+和Ca2+,保持了其叶片较低渗透势和较高的保水率,显著提高了转基因株系的抗旱性[12]。
甜橙( Citrus sinensis )为芸香科(Rutaceae)柑橘属( Citrus )多年生果树,主要分布于16°~37°N,甜橙也是市场上畅销鲜果之一,我国是甜橙产量增长最快的国家[13-14]。 NHX 基因虽然已在多种植物中都有研究,但在甜橙中还未见关于 NHX 基因家族成员的报道。甜橙基因组数据的公布,使研究甜橙 NHX 基因家族成员成为了可能。本研究以甜橙为研究对象,在全基因组水平上鉴定出6个甜橙 NHX 基因家族成员,并进一步分析其理化性质、进化关系和表达水平等,以期为后续深入研究甜橙 NHX 基因的功能奠定基础。
1 材料与方法
1.1 甜橙 NHX 基因家族鉴定
甜橙基因组数据来源于CPBD(http://citrus.hzau.edu.cn/index.php),含有Na+/H+exchange结构域的HMM模型(PF00999)来自于Pfam数据库(http://pfam.xfam.org/)。利用HMMER 3.0软件在甜橙基因组数据中进行比对分析,比对结果经Pfam、CDD(https://www.ncbi.nlm.nih.gov/cdd/term)和InterPro(https://www.ebi.ac.uk/interpro/search/sequence/)数据库进行验证,去除不含Na+/H+exchange保守结构域的蛋白序列,得到的甜橙 NHX 基因家族成员( CsNHXs )按照其在染色体上的位置依次进行命名。
1.2 甜橙 NHX 基因编码蛋白的理化性质分析
利用ExPASy ProtParam软件(http://web.expasy.org/compute_pi/)在线分析甜橙NHX蛋白序列长度、相对分子量、理论等电点、亲水性等理化性质;采用WoLF PSORT(https://psort.hgc.jp/)进行亚细胞定位预测分析。
1.3 甜橙 NHX 基因家族成员的染色体定位及系统发育树构建
从CPBD获取甜橙基因组注释文件,确定 CsNHXs 的位置信息和染色体长度信息,利用Map MG2C工具(http://mg2c.iask.in/mg2c_v2.0/)在线绘制 CsNHXs 在染色体上的位置分布图。
经查阅文献,分别得到8个拟南芥( Arabidopsis thaliana ) NHX 基因序列号、7个水稻( Oryza sativa ) NHX 基因序列号,参照前人的命名规则[15]对其命名。然后采用MEGA 7.0的Neighbor-Joining法构建系统发育进化树,Bootstrap值设置为1 000,其他参数为默认值。
1.4 甜橙 NHX 基因家族成员的基因结构与保守基序分析
使用GSDS v2.0软件(http://gsds.gao-lab.org/)在线对 CsNHXs 的基因结构进行可视化分析;利用MEME在线网站(http://meme-suite.org/)对 CsNHXs 编码的蛋白质进行模体(motif)分析,数量设置为10;通过Pfam数据库在线分析 CsNHXs 编码蛋白的保守结构域。
1.5 甜橙 NHX 基因编码蛋白的空间结构
甜橙NHX蛋白二级结构预测运用软件SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线分析完成;通过SWISS-MODEL在线分析工具(https://swissmodel.expasy.org/),采用同源建模(以序列相似度高的蛋白质结构为模板)的方法预测分析甜橙NHX蛋白的三级结构。
1.6 甜橙 NHX 基因家族成员的共线性分析
利用TB-tools分析 CsNHXs 在进化过程中可能发生的基因复制事件,并筛选重复基因对信息;根据蛋白序列的相似性,通过TB-tools绘制甜橙和枳( Poncirus trifoliata)NHX 基因的共线性关系图。
1.7 甜橙 NHX 基因家族成员的启动子顺式作用元件分析
使用Plant CARE软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测 CsNHXs 起始密码子上游2 000 bp区域的顺式作用元件,并将顺式作用元件按照功能归类后通过 TB-tools 可视化。
1.8 甜橙 NHX 基因家族成员的表达分析
在CPBD数据库中下载甜橙愈伤组织、花、叶片和果实中的RNA-seq数据,分析 CsNHXs 在4个不同组织中的相对表达量。使用TB-tools将结果可视化,红色表示基因表达量上调,绿色则表示下调。
2 结果与分析
2.1 甜橙 NHX 基因家族成员的鉴定与分析
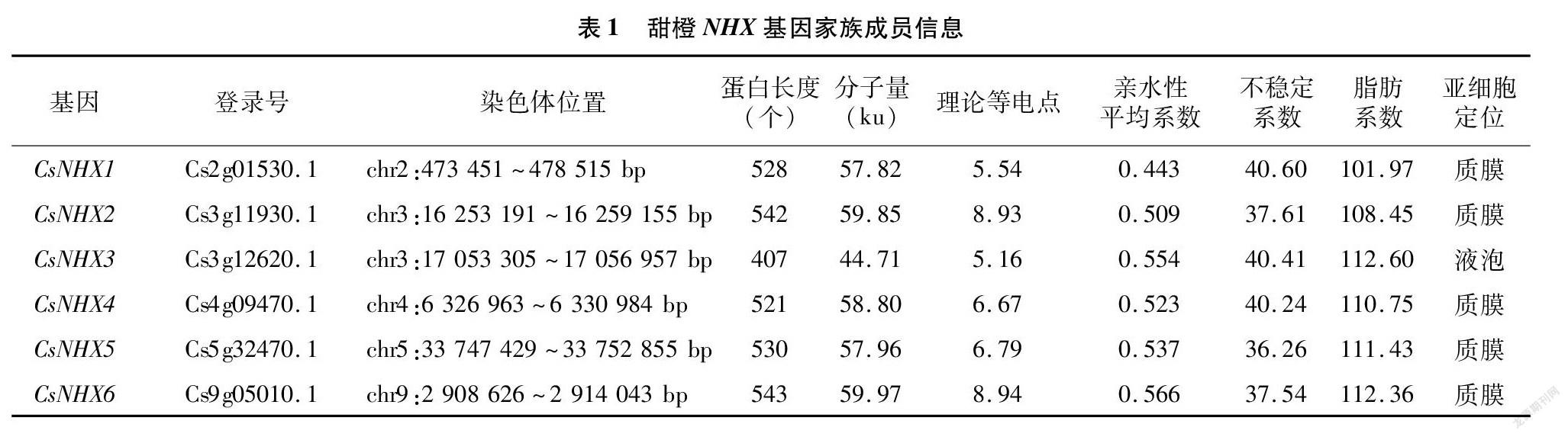
由表1可知,在甜橙基因组中共鉴定到6个 CsNHXs ,根据染色体定位依次命名为CsNHX1~CsNHX6。 CsNHXs 的蛋白序列差异较小,长度(以氨基酸数量计)为407~543个,蛋白质分子量为4471~59.97 ku。理论等电点(pI)介于5.16~894之间,其中CsNHX2和CsNHX6等电点大于7,为碱性蛋白;其余家族成员的等电点小于7,为酸性蛋白。蛋白亲水性平均系数为0.443~0566,均大于0,为疏水性蛋白。CsNHX1、CsNHX3和CsNHX4蛋白的不稳定系数均大于40,预测为不稳定蛋白;其他成员的小于40,为稳定蛋白。蛋白脂肪系数为101.97~112.60,平均值为109.59,均具有较高的脂肪系数。亚细胞定位预测结果表明,除CsNHX3定位在液泡,其他所有CsNHX蛋白都定位在质膜。
2.2 甜橙 NHX 基因家族成员的染色体定位分析
如图1所示,6个 CsNHXs 分别分布在5条染色体上。CsNHX1位于第2条染色体上,CsNHX2、CsNHX3位于第3条染色体上,CsNHX4位于第4条染色体上,CsNHX5位于第5条染色体上,CsNHX6位于第9条染色体上。总的来看,染色体的长度与其上分布的 CsNHXs 数量无正相关关系。
2.3 甜橙 NHX 基因家族成员的进化分析
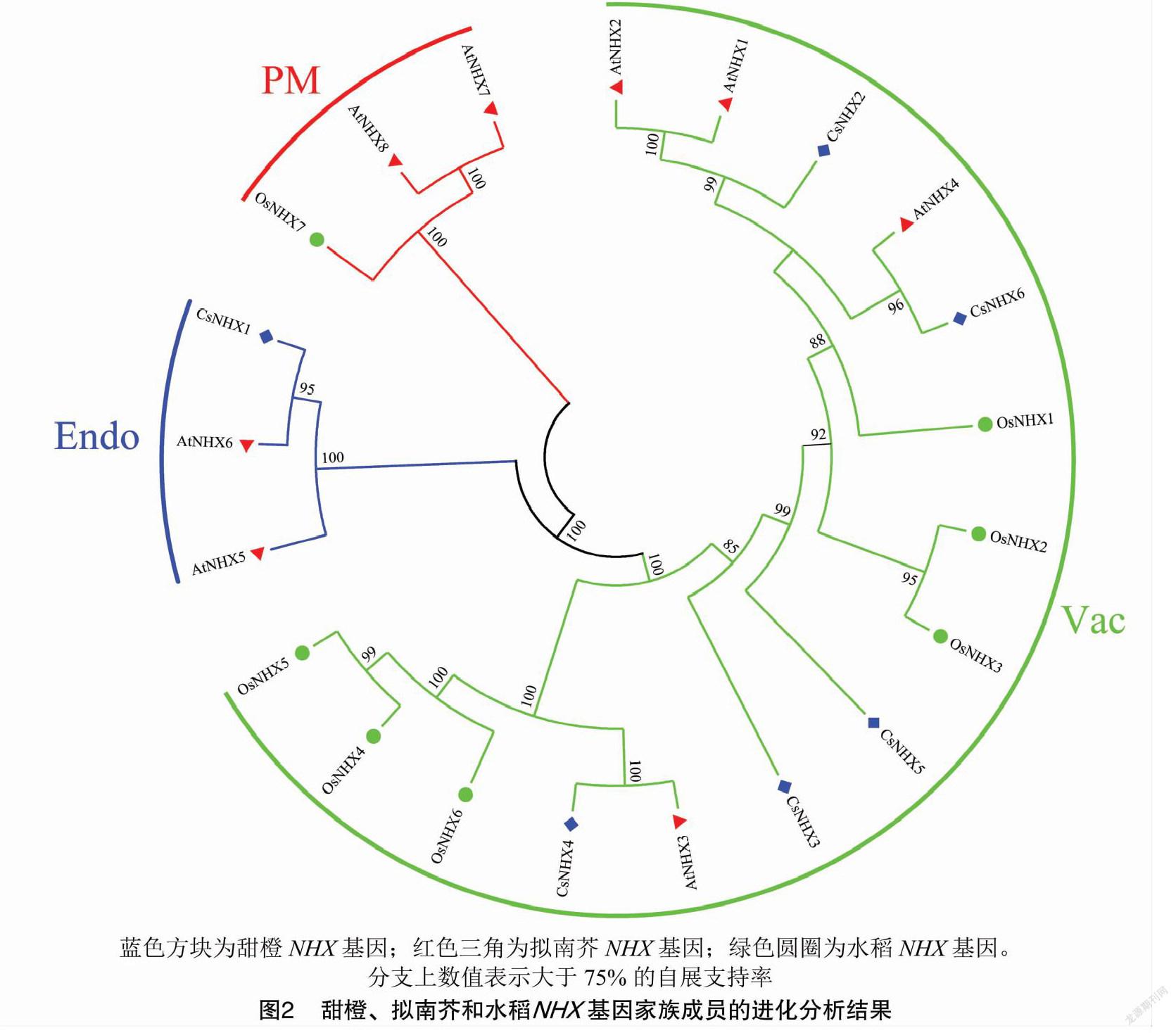
采用Neighbor-Joining法构建拟南芥、水稻和甜橙共21个NHX蛋白序列的系统发育树,结果(图2)显示,供试 NHX 基因家族可以分为3个亚群,而甜橙 NHX 基因家族分为2个亚群。其中甜橙 NHX 基因家族成员主要集中于Vac亚群中,包括CsNHX2、CsNHX3、CsNHX4、CsNHX5和CsNHX6,而Endo亞群仅含CsNHX1。此外,PM亚群由拟南芥和水稻 NHX 基因所构成。
2.4 甜橙 NHX 基因家族成员的基因结构分析
分析6个甜橙 NHX 基因家族成员的基因结构,包括外显子、上下游序列及内含子。结果(图3)显示,6个 CsNHXs 均含有外显子,但各基因外显子数量存在差异。其中CsNHX1的外显子数量最多,达20个;CsNHX2、CsNHX4、CsNHX5和CsNHX6中均含14个外显子;CsNHX3最少,仅含10个。除CsNHX1和CsNHX3外,其余4个 CsNHXs 均含有上游基因序列。甜橙 NHX 基因家族成员分为2个亚群,且在进化树中位置相近的 CsNHXs 具有类似的基因结构。
2.5 甜橙 NHX 基因家族成员的保守基序分析
为进一步研究甜橙 NHX 基因家族成员结构特征,对6个 CsNHXs 的保守基序进行分析,得到10个保守motif(图4),其中motif的具体基序如图5所示。分析结果表明,不同 CsNHXs 的motif数量相差较大,为4~10个;所有 CsNHXs 均含有motif 1和motif 2,证明motif 1和motif 2基序高度保守,其中motif 2基序中包含FFI/LY/FLLPPI结合位点,代表Na+/H+exchange结构域;同一亚群 CsNHXs 间motif的数量、类型和空间分布相似,如motif 2、motif 4、motif 5、motif 6、motif 9和motif 10;CsNHX3中的Motif数量相比同一进化分支其他基因有缺失,这可能是基因串联重复过程中碱基丢失造成的;N端主要是motif 6,该基序保守结构可能与顺式作用元件结合。对CsNHX蛋白序列的结构域进行分析发现,所有CsNHX蛋白均含有Na+/H+exchange保守结构域(图6)。
2.6 甜橙NHX蛋白结构预测
甜橙NHX蛋白二级结构预测结果(表2)表明,6个CsNHX蛋白的二级结构均有α-螺旋、β-折叠和无规则卷曲。其中α-螺旋所占比例为4317%~50.38%,是甜橙NHX蛋白结构的主要组成部分;β-折叠和无规则卷曲所占比例较少,分别为360%~4.43%和29.73%~34.50%。用SWISS-MODEL在線分析CsNHX蛋白的三级结构,结果(图7)表明6个CsNHX蛋白之间的相似性在 27.46%~36.81%之间。
2.7 甜橙 NHX 基因家族成员的共线性分析
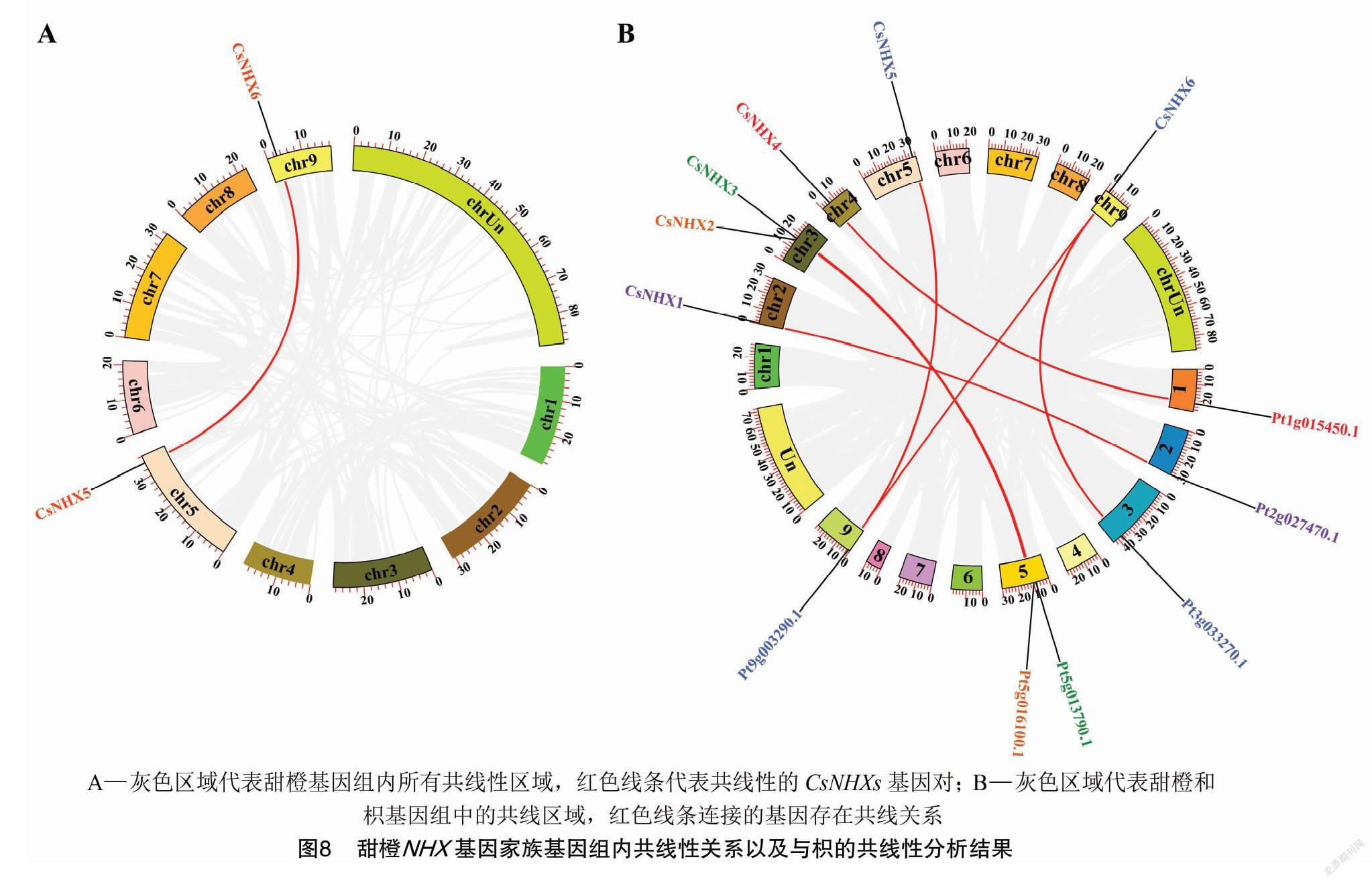
为了确定甜橙 NHX 基因家族成员的复制事件,对甜橙基因组进行共线性分析。结果(图8-A)表明,CsNHX5和CsNHX6之间存在共线性关系。为进一步阐明 NHX 基因在甜橙和枳之间的进化关系,对这2个物种进行共线性分析。如图8-B所示,在甜橙和枳之间共鉴定出7个直系同源基因对,分别为CsNHX1/Pt2g02470.1、CsNHX2/Pt5g016100.1、CsNHX3/Pt5g013790.1、CsNHX4/Pt1g015450.1、CsNHX5/Pt9g003290.1、CsNHX6/Pt9g003290.1和CsNHX6/Pt3g033270.1。
2.8 甜橙 NHX 基因家族成员的启动子顺式作用元件分析
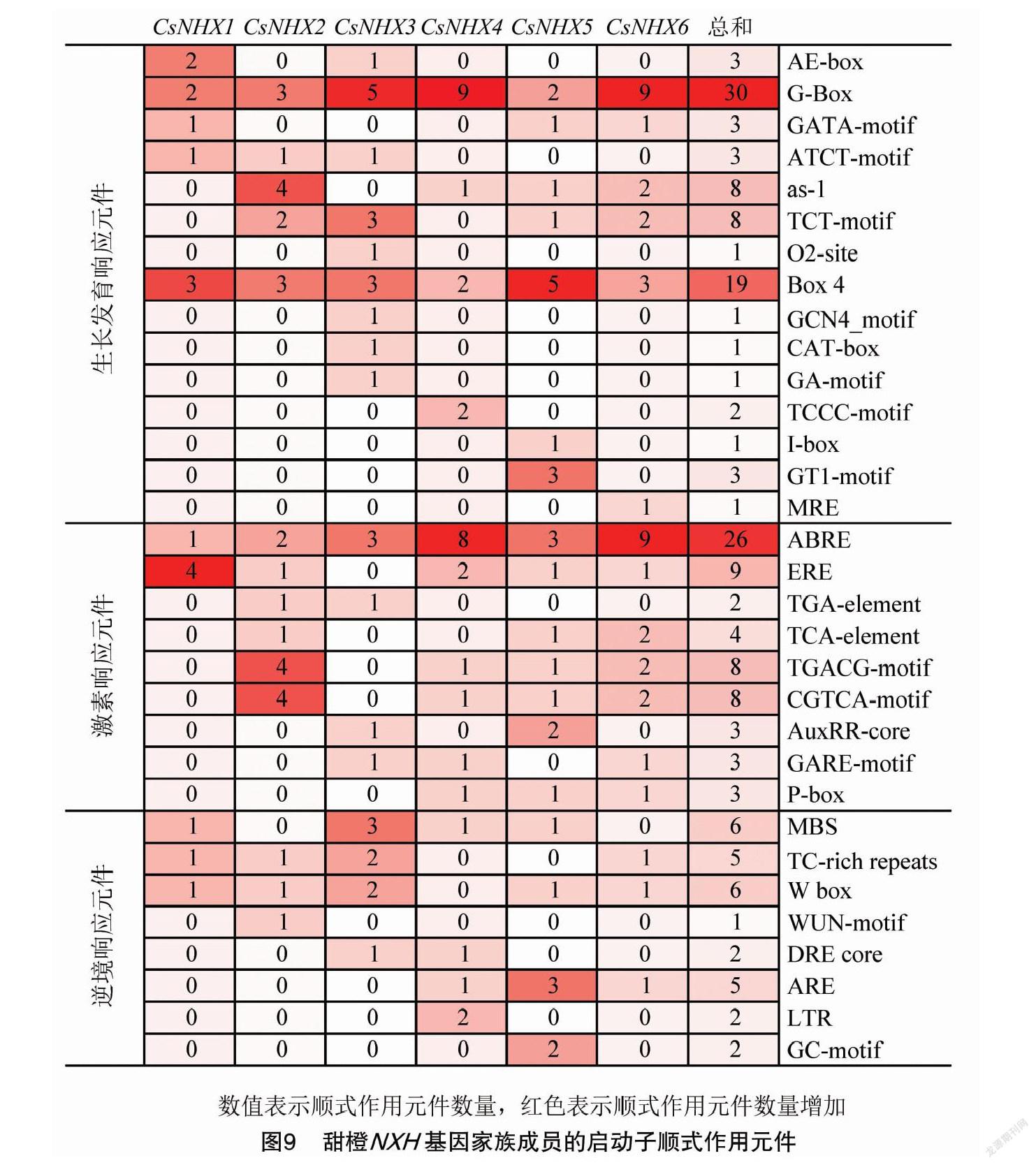
在 CsNHXs 上游2 000 bp启动子区域的顺式作用元件类型主要分为3种:植物生长发育响应元件、激素响应元件、逆境响应元件(图9)。其中,参与植物生长发育的响应元件G-Box(30个)和Box 4(19个),存在于所有 CsNHXs 中。激素响应元件在 CsNHXs 中预测到8种,分布最广的脱落酸响应元件(ABRE)数量最多(26个);其次是乙烯响应元件(ERE),数量为9个;而茉莉酸甲酯响应元件(TGACG-motif,CGTCA-motif)数量均为8个。逆境响应元件中,参与干旱诱导MYB结合位点(MBS)和非生物胁迫(W box)的元件数量均为6个,参与应激反应(TC-rich repeats)和厌氧诱导(ARE)的元件数量均为5个。这些结果表明, CsNHXs 在甜橙生长发育、激素诱导和响应非生物胁迫的过程中可能发挥重要作用。
2.9 甜橙 NHX 基因家族成员的表达分析
6个 CsNHXs 的表达模式结果表明, CsNHXs 在不同组织中均有不同程度的表达(图10)。其中,愈伤组织中表达量高的基因有CsNHX1、CsNHX2、CsNHX4和CsNHX6;花中表达量高的基因有CsNHX1和CsNHX2; 叶片中表达量高的基因为CsNHX2; 果实中表达量高的基因有CsNHX1、CsNHX2和CsNHX4。表明CsNHXs在甜橙中具有组织表达特异性。此外,CsNHX1和CsNHX2在不同组织中表达量均较高,而CsNHX3和CsNHX5表达量均较低。
3 讨论与结论
NHX蛋白主要参与植物响应盐胁迫过程中离子平衡的重建[16-17],但对具有较高经济价值和营养价值的甜橙中 NHX 基因家族知之甚少。因此,对甜橙 NHX 基因家族的鉴定分析,有助于了解 CsNHXs 的结构和潜在功能。
本研究基于甜橙基因组数据共鉴定出6个 CsNHXs ,比拟南芥少2个,比水稻少1个,比番茄多1个[18],说明不同物种间 NHX 基因家族成员数量存在差异。甜橙 NHX 基因家族成员间内含子-外显子分析结果差异较大, CsNXHs 内含子数量在9~19个,其中67%的 CsNHXs 含13个内含子;而外显子数量为10~20个。这与前人在葡萄[1]和石榴[19]中的研究结果相类似,证明 NHX 基因家族成员的基因结构在不同物种中比较保守。6个 CsNHXs 编码的蛋白均含Na+/H+exchange结构域,结构上高度保守,这与王影等对杜梨 NHX 基因家族的研究结果[20]一致。此外,4个CsNHX蛋白为酸性蛋白,推测 CsNHXs 主要在酸性亚细胞环境中发挥作用。
Wu等在甜菜 NHX 基因家族研究中将甜菜、拟南芥、水稻等13种植物共93个NHX蛋白的进化树聚成3个亚群:Vac、Endo和PM[15]。本研究中甜橙、拟南芥和水稻NHX蛋白的系统发育进化树同样分为Vac、Endo和PM共3个亚群, AtNHXs和OsNHXs 不均匀地存在于3个亚群中,而 CsNHXs 存在于除PM外的亚群中。相对单子叶植物水稻而言,甜橙与双子叶植物拟南芥 NHX 基因亲缘关系更近,同源性较高,说明 CsNHXs 在进化上较为保守。此外,具有相似Motif组成的甜橙 NHX 基因家族成员,在聚类分析中距离较近,暗示进化方式相近的 NHX 基因的蛋白结构和功能也相近。
6个 CsNHXs 启动子区含有多种激素类响应元件,且不同基因间元件数量和种类均有差异,说明 CsNHXs 响应激素的种类和程度不同,进而导致 CsNHXs间功能有差异;部分CsNHXs还同时含有多种逆境响应元件,证明CsNHXs 作为中间转录因子响应不同激素的信号,从而调节植株在逆境胁迫中的生长。罗建等对辣椒 NHX 基因启动子序列顺式作用元件的分析[21]与本研究的结果相似。此外, CsNHXs 在不同组织中表达的分析结果进一步表明,该基因家族在甜橙不同组织中存在表达差异,推测 CsNHXs 在甜橙愈伤组织、花、叶片和果实各自发育过程中发挥着一定的调控作用,但具体功能机制需要在后续试验中进一步验证。
参考文献:
[1]Ayadi M,Martins V,Ayed R B,et al. Genome wide identification,molecular characterization,and gene expression analyses of grapevine NHX antiporters suggest their involvement in growth,ripening,seed dormancy,and stress response[J]. Biochemical Genetics,2020,58(1):102-128.
[2]Bassil E,Blumwald E. The ins and outs of intracellular ion homeostasis:NHX-type cation/H+ transporters[J]. Current Opinion in Plant Biology,2014,22:1-6.
[3]Cao B N,Xia Z Q,Liu C Y,et al. New insights into the structure-function relationship of the endosomal-type Na+,K+/H+antiporter NHX6 from mulberry ( Morus notabilis )[J]. International Journal of Molecular Sciences,2020,21(2):428.
[4]Gaxiola R A,Rao R,Sherman A,et al. The Arabidopsis thaliana proton transporters,AtNhx1 and Avp1,can function in cation detoxification in yeast[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(4):1480-1485.
[5]Fukuda A,Nakamura A,Tagiri A,et al. Function,intracellular localization and the importance in salt tolerance of a vacuolar Na+/H+ antiporter from rice[J]. Plant and Cell Physiology,2004,45(2):146-159.
[6]Zrb C,Noll A,Karl S,et al. Molecular characterization of Na+/H+antiporters ( ZmNHX ) of maize ( Zea mays L.) and their expression under salt stress[J]. Journal of Plant Physiology,2005,162(1):55-66.
[7]Li Y H,Zhang Y Z,Feng F J,et al. Overexpression of a Malus vacuolar Na+/H+antiporter gene (MdNHX1) in apple rootstock M.26 and its influence on salt tolerance[J]. Plant Cell,Tissue and Organ Culture,2010,102(3):337-345.
[8]徐 亞,滕梦鑫,何岳东,等. 香蕉 NHX 基因家族的鉴定及表达分析[J]. 植物生理学报,2021,57(3):681-691.
[9]Apse M P,Aharon G S,Snedden W A,et al. Salt tolerance conferred by overexpression of a vacuolar Na+/H+antiport in Arabidopsis [J]. Science,1999,285(5431):1256-1258.
[10]Huang Y,Zhang X X,Li Y H,et al. Overexpression of the Suaeda salsa SsNHX1 gene confers enhanced salt and drought tolerance to transgenic Zea mays [J]. Journal of Integrative Agriculture,2018,17(12):2612-2623.
[11]刘 威,李 慧,蔺 经,等. 杜梨PbNHX1基因的克隆、表达分析及功能验证[J]. 果树学报,2018,35(2):137-146.
[12]Bao A K,Wang Y W,Xi J J,et al. Co-expression of xerophyte Zygophyllum xanthoxylum ZxNHX and ZxVP1-1 enhances salt and drought tolerance in transgenic Lotus corniculatus by increasing cations accumulation[J]. Functional Plant Biology,2014,41(2):203-214.
[13]董美超,李进学,周东果,等. 柑橘品种选育研究进展[J]. 中国果树,2013(6):73-78.
[14]童 彤. 全球:甜橙消费量日益增长[J]. 中国果业信息,2018,35(11):42.
[15]Wu G Q,Wang J L,Li S J. Genome-wide identification of Na+/H+antiporter ( NHX ) genes in sugar beet ( Beta vulgaris L.) and their regulated expression under salt stress[J]. Genes,2019,10(5):401.
[16]Yarra R. The wheat NHX gene family:potential role in improving salinity stress tolerance of plants[J]. Plant Gene,2019,18:100178.
[17]Fu X K,Lu Z Y,Wei H L,et al. Genome-wide identification and expression analysis of the NHX (sodium/hydrogen antiporter) gene family in cotton[J]. Frontiers in Genetics,2020,11:964.
[18]Karim R,Bouchra B,Fatima G,et al. Plant NHX antiporters:from function to biotechnological application,with case study[J]. Current Protein & Peptide Science,2021,22(1):60-73.
[19]Dong J M,Liu C Y,Wang Y Y,et al. Genome-wide identification of the NHX gene family in Punica granatum L. and their expressional patterns under salt stress[J]. Agronomy,2021,11(2):264.
[20]王 影,李 慧,蔺 经,等. 杜梨 NHX 基因家族的鉴定及其在非生物胁迫下的表达分析[J]. 果树学报,2019,36(7):825-836.
[21]罗 建,许春苗,张国斌,等. 辣椒 NHX 基因家族的鉴定和表达分析[J]. 华北农学报,2021,36(3):15-24.
