环境因子对掌状海带有性生殖过程的影响
2022-05-08刘福利梁洲瑞袁艳敏张朋艳汪文俊孙修涛
王 潇, 刘福利,2*, 梁洲瑞, 袁艳敏, 张朋艳, 汪文俊,2, 孙修涛,2
(1. 农业农村部海洋渔业可持续发展重点实验室中国水产科学研究院黄海水产研究所, 山东 青岛 266071;2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071)
引 言
掌状海带(Laminariadigitata)属于褐藻门(Phaeophyta)、褐藻纲(Phaeophyceae)、海带目(Laminariales)、海带科(Laminariaceae)、海带属(Laminaria),分布于北大西洋沿岸,主要包括冰岛沿岸、格陵兰岛南部、爱尔兰西北部、法国西北部、英国南海岸、挪威北海岸[1-4]。掌状海带是一种大型海藻,可生长在2~6 m深的水下岩礁上[5],具有重要的经济和生态价值。它是生产褐藻胶、海藻盐、碘的原材料,也可用于新兴领域如营养保健品、药物及第三代生物燃料等[6-8];掌状海带可形成海藻林,具有提高近海生物多样性、调节近岸海域生态环境的作用[9]。我国不是海带属种类的原产地[10],缺乏海带属大型海藻种质资源,而掌状海带的引进是对我国大型海藻种质资源的有力补充。当前掌状海带生长发育繁殖的研究已有一些报道,但大都是对野生群体的调查研究。人工养殖的海藻,其生长发育和繁殖特性相对野生群体有所不同,以规模化养殖的海带(Saccharina japonica)为例,野生海带生活史跨越三个年份,而人工养殖的只需两个年份。可以预见人工养殖掌状海带的生长发育和生殖特点也将不同于原产地野生群体的特点。因此,有必要对人工养殖群体掌状海带的繁育特点及其环境条件进行系统研究,以期为掌状海带人工育苗技术的构建提供理论依据。
海带属种类的生活史包括微观配子体和宏观孢子体两个世代[11]。对海带属种类的有性生殖过程,包括游孢子放散和附着,雌/雄配子体的形成、生长和发育,雌/雄配子体排卵/精以及幼苗产生的过程。有性生殖过程是一个极其复杂的生物学过程,受多种环境因子的调控和影响,其中光和温度被认为是影响有性生殖过程较为重要的环境因子[12]。探明影响掌状海带有性生殖过程的关键环境因子,是建立海带属种类人工苗种繁育技术的基本前提。而目前对掌状海带的研究主要集中在生物活性物质提取、生态资源调查、遗传多样性研究[13]以及单一环境因子对掌状海带生长发育影响的研究[14],缺乏对掌状海带有性生殖过程中关键节点的适宜环境条件的系统性研究。
本研究以人工养殖的成熟掌状海带为材料,在不同光照强度、温度、氮磷营养盐浓度条件下,观察掌状海带游孢子萌发、配子体形成及生长、配子囊形成及配子排放以及孢子体形成的过程和规律,探究掌状海带有性生殖过程的适宜环境条件,旨在为掌状海带人工育苗提供理论依据和数据支持。
1 材料与方法
1.1 实验材料
孢子囊组织来源于同一株成熟的掌状海带,尽可能保证游孢子的成熟度和发育状态一致。剪取掌状海带的成熟孢子囊组织块,用灭菌海水擦洗干净,在10~15 ℃环境下阴干刺激1 h,放入10 ℃左右的灭菌海水中进行游孢子放散,1 h左右后取一滴游孢子水,显微镜观察,每个视野(100×)内有10个左右的游孢子即可停止放散。将含有游孢子的海水用300目筛绢过滤,将滤液倒入铺满玻片的培养板上进行附着。第2天将附有游孢子的玻片分别放在直径9 cm的培养皿中进行不同环境条件下的培养,每7d换水一次。
1.2 试验方法
以灭菌的天然海水为培养液,设置不同的温度、光强和营养盐浓度实验组:
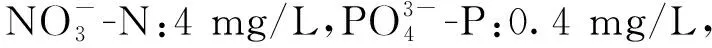
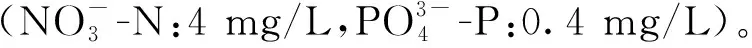
1.3 掌状海带有性生殖过程的观察与测定
在显微镜下观察掌状海带有性生殖过程,每3 d拍照一次,实验周期为24 d。
胚孢子直径、配子体宽度和长度的测量: 每个培养皿中随机观察10个视野(100×),用DLC Performance 软件进行拍照,用Image-Pro Plus 5.1软件进行测量。
配子体形成率、排卵率和幼孢子体形成率的统计:每个培养皿随机观察10个视野(100×),统计形成初期的配子体、排卵的雌配子体和幼孢子体的数量,按配子体形成数占总细胞数的百分比计算配子体形成率;按排卵的雌配子体占总细胞数的百分比计算排卵率;按长成幼孢子体的数量占总细胞数的百分比计算幼孢子体形成率。
1.4 数据处理
使用SPSS 19.0对配子体形成率、排卵率和幼孢子体形成率进行单因素方差分析、Duncan 多重比较(P<0.05为差异显著)。
2 结果
2.1 掌状海带配子体的生长发育
掌状海带游孢子放散附着后形成胚孢子(图1a),其细胞直径约为5.43 μm,然后胚孢子细胞表面产生突起开始萌发,突起延长形成萌发管,细胞的内含物全部流到萌发管的顶端,出现细胞壁,萌发管顶端与空的萌发管分离,形成配子体(图1b),从游孢子附着后到配子体形成,需46 d。雌配子体(图1c)、雄配子体(图1d)开始由一个细胞不断进行细胞分裂(图1e)。培养至16 d左右(105 ℃),雄配子体细胞分裂形成78个细胞的细胞段,细胞宽度约为9.13 μm,细胞长度约为19.87 μm,而雌配子体细胞分裂形成47个细胞的细胞段,细胞宽度约为14.81 μm,细胞长度约为22.61 μm,雄配子体细胞大小显著小于雌配子体。雌配子体细胞表面出现突起形成卵囊(图1f),第20天雌配子体开始排卵(图1g),与雄配子体放散的精子结合,合子生长发育为幼孢子体(图1h)。20 ℃时有性生殖过程停滞在配子体形成阶段,无配子体成熟及幼孢子体产生现象。

图1 掌状海带的早期发育过程
2.2 不同环境条件下掌状海带的配子体形成率
由图2和图3可知,随着温度的增加或随着氮、磷浓度的增加,掌状海带的配子体形成率均呈先升高后下降的趋势。15 ℃组的配子体形成率显著高于其它温度组(P<0.05),20 ℃组的配子体形成率最低。N4营养盐组的配子体形成率显著高于其它营养盐组(P<0.05),氮磷浓度过高或过低均会降低配子体的形成率。由图4可知,10 ℃和15 ℃的不同光强组的配子体形成率均随着光强的增加呈先升高后下降的趋势。光强为20 μmol photons/(m2·s)、温度为15 ℃的处理组的配子体形成率(90.2%)显著高于其它处理组(P<0.05)。

图2 不同温度条件下培养6 d后掌状海带的配子体形成率
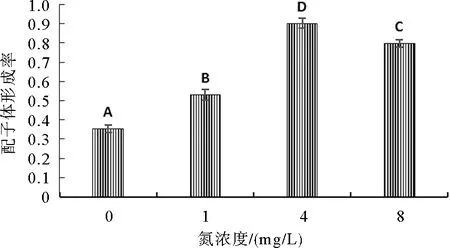
图3 不同营养盐(氮、磷)浓度条件下培养6 d后掌状海带的配子体形成率(N∶P=10∶1)
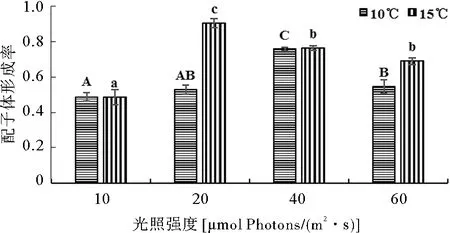
图4 不同温度、光照强度条件下培养6 d后掌状海带的配子体形成率
2.3 不同环境条件下掌状海带的雌配子体排卵率
由图5可知,10 ℃组的掌状海带配子体排卵率显著高于其它温度组(P<0.05),20 ℃时无排卵现象。由图6可知,掌状海带的配子体排卵率随氮、磷浓度的增加呈先升高后下降的趋势,N4营养盐组的配子体排卵率显著高于其它营养盐组(P<0.05),N0营养盐组的排卵率最低。由图7可知,10 ℃和15 ℃的不同光强组的配子体排卵率均随着光强的增加呈先升高后下降的趋势。15 ℃组的排卵率稍低于10 ℃组。温度为10 ℃、光照为40 μmol photons/(m2·s) 时配子体排卵率最高。

图5 不同温度条件下培养20 d后掌状海带的雌配子体排卵率

图6 不同营养盐(氮、磷)浓度条件下培养20 d后掌状海带的排卵率(N∶P=10∶1)

图7 不同温度、光照强度条件下培养20 d后掌状海带的排卵率
2.4 不同环境条件下掌状海带的幼孢子体形成率
由图8可知,温度为10 ℃和15 ℃下,掌状海带的幼孢子体形成率较高且没有显著差异(P>0.05),20 ℃下没有幼孢子体的形成,这与在20 ℃下没有排卵的结果相互印证。由图9可知,幼孢子体形成率随着氮、磷浓度的增加呈先升高后下降的趋势,N4营养盐组的幼孢子体形成率显著高于其它营养盐组(P<0.05),N0营养盐组的幼孢子体形成率最低。由图10可知,除了60 μmol photons/(m2·s)光强组外,其它光强组在15 ℃下的幼孢子体形成率均显著低于10 ℃下(P<0.05)。温度为10 ℃、光强为40 μmol photons/(m2·s) 处理组的幼孢子体形成率显著高于其它处理组(P<0.05)。

图8 在不同温度条件下的掌状海带幼孢子体形成率

图9 不同营养盐浓度条件下的掌状海带幼孢子体形成率(N∶P=10∶1)

图10 不同温度、光照强度条件下的掌状海带幼孢子体形成率
3 讨论
本研究表明,掌状海带胚孢子发育形成配子体的过程受到多种环境因子的影响。掌状海带在15 ℃下的配子体形成率最大,可高达90%以上,而低温(10 ℃)和高温(20 ℃)会显著降低配子体形成率。Barsch等[15]的研究也发现高温会使掌状海带游孢子萌发形成配子体的几率明显降低,20 ℃是致死上限;Cosson[16]研究认为低温会使配子体形成受阻,5 ℃下形成的配子体比10~18 ℃下形成的配子体小,与本研究结果相一致。Müller等[17]研究发现温度达到18 ℃时,糖海带和掌状海带的胚孢子萌发率为0,而本研究表明当培养温度达到20 ℃时,掌状海带配子体形成率即使显著降低,但仍有20%左右的形成率,这表明本研究的掌状海带对高温的耐受性可能高于Müller等研究的掌状海带,本研究的掌状海带来源于法国,是掌状海带自然分布的南端,有可能适应较高的温度。本研究发现15 ℃时低光强更适宜于配子体形成初期的生长,梁洲瑞等[18]研究发现配子体初期叶绿素含量较低,叶绿素含量与光照需求成正比,高光会对胚孢子或配子体初期造成伤害。鞠青等[19]发现氮磷营养盐的缺乏会使海带胚孢子的萌发和配子体的形成滞后,氮浓度为4 mg/L、磷浓度为0.4 mg/L时,配子体的形成率相对较高,而氮浓度为8 mg/L、磷浓度为0.8 mg/L时,配子体的形成率显著低于氮浓度为4 mg/L、磷浓度为0.4 mg/L的条件,Berges等[20]发现氮磷浓度偏高会导致藻类出现磷抑制现象,这些研究结果与本研究相一致。
Martins等[11]研究认为海带雌配子体细胞段至少有一个细胞进入了发育阶段,开始形成卵囊,则认为雌配子体处于卵期,3 d左右进行卵子释放即排卵。温度决定着海带配子体是营养生长还是开始发育,本研究发现10 ℃有利于掌状海带配子体的发育,排卵率相对较高,显著高于15 ℃,而20 ℃条件下配子体没有出现发育和排卵现象,这与Dieck等[21]的研究结果相似,即掌状海带配子体在5~12 ℃时的具有较高发育率,而17 ℃的发育率略有降低。在适宜温度10 ℃条件下,40 μmol Photons/(m2·s)的光强时掌状海带配子体的排卵率显著高于其他光强组。而Hsiao等[22]研究发现糖海带配子发育的最佳条件是17 μmol Photons/(m2·s)。掌状海带相对糖海带更喜强光,类似光照需求的种间差异也有相关报道[23-25]。本研究发现掌状海带配子体需要充足的氮磷营养盐,氮浓度为4 mg/L、磷浓度为0.4 mg/L最为适宜,天然海水中不额外添加氮磷营养,会严重抑制配子体排卵率,而过高的氮磷浓度(氮浓度为8 mg/L、磷浓度为0.8 mg/L)也不利于掌状海带雌配子体的排卵。
正常的幼孢子体附着在各自的雌性卵囊上,具有正常形态,即规则的细胞分裂、具有明显分化为基底的根状茎和近端的细长叶片[11]。Bolton[26]在实验中发现掌状海带幼孢子体在10~15 ℃具有较高的形成率和生长速率,这与本实验研究结果一致,即10 ℃和15 ℃条件下海带幼孢子体形成率相对较高且没有显著性差异,而20 ℃时没有幼孢子体的形成,凌晶宇等[14]研究发现温度过高会抑制配子体正常发育,没有排卵发生。在适宜温度10 ℃、光照强度40 μmol Photons/(m2·s)条件下掌状海带幼孢子形成率相对较高,而在温度15 ℃条件下,40~60 μmol Photons/(m2·s)的光照强度有利于掌状海带幼孢子体的形成,说明适宜的光照强度也会随着温度的变化有所变化。
Müller等[17]表明,掌状海带游孢子萌发为配子体的最佳温度不同于排卵和幼孢子体形成的最佳温度,后者的最佳温度一般较低。本研究表明掌状海带配子体形成的最佳温度(15 ℃)不同于排卵和幼孢子形成的最佳温度(10 ℃),游孢子萌发和配子体营养生长需要较高温度,而配子体发育(配子形成、受精作用)则稍低温度更有利。此外,从游孢子到幼苗产生的这个阶段对光照的需求也有不同,从胚孢子萌发形成配子体,到配子体生长、发育形成幼孢子体,对光照的需求呈现增高趋势,这可能与该生长发育阶段叶绿素含量不断增加有关。而氮磷营养盐需求无显著变化,氮浓度为4 mg/L、磷浓度为0.4 mg/L适宜于掌状海带从游孢子到幼苗产生整个阶段,相关研究表明该氮磷营养盐浓度也适宜于其它海带种类[27-28]。
