非小细胞肺癌组织中PD-1、TIM-1的表达及其对预后的影响
2022-05-07郑林鑫麦玉梅李伟峰中国人民解放军南部战区总医院呼吸内科广东广州510000
陈 灿,郑林鑫,麦玉梅,李伟峰 (中国人民解放军南部战区总医院呼吸内科,广东 广州510000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是一种常见的病理类型,约占肺癌的85%,早期发病隐匿,无明显症状,多数患者就诊时已属于中晚期,错过了最佳手术切除时机,预后极差[1]。NSCLC的治疗手段包括手术切除、化疗、放疗、免疫治疗等,通常采用以手术切除为主、放/化疗为辅的方式,但受肿瘤类型、个体差异、就诊时间等影响,患者5年生存率仅约16%,效果不够理想[2]。近年来,有研究发现宿主抗癌免疫的有效性与细胞毒性T淋巴细胞密切相关,T淋巴细胞介导的免疫应答是肿瘤免疫治疗的基础,而程序性死亡受体-1(programmed death receptor-1,PD-1)在活化T淋巴细胞中广泛表达,PD-1可通过与其配体结合,对肿瘤的免疫逃逸进行介导[3]。周舸等[4]发现肝细胞癌组织中PD-1的表达水平较癌旁组织高。黄健等[5]发现与癌旁组织相比,结肠癌组织中PD-1的表达水平也明显增高。这表明PD-1与多种肿瘤的发生有关,可能参与肿瘤进展。周鹏等[6]则认为T淋巴细胞免疫球蛋白和黏蛋白结构域分子1(T cell immunoglobulin and mucin domain-containing molecule-1,TIM-1)能促进免疫抑制,参与肿瘤细胞的免疫逃逸过程。基于此,本研究纳入125例NSCLC患者进行研究,旨在分析PD-1、TIM-1在NSCLC组织中的表达情况及二者与NSCLC患者预后的关系,以期为临床NSCLC的诊疗提供参考。
1 资料与方法
1.1 临床资料
选取我院2016年1月至2019年6月收治的125例NSCLC患者开展前瞻性研究,其中男68例,女57例;年龄34~71岁,平均(55.39±12.71)岁;临床分期:Ⅰ期23例,Ⅱ期35例,Ⅲ期67例;病理类型:腺癌63例,鳞状细胞癌62例;分化程度:高分化58例,中低分化67例;淋巴结转移41例;肿瘤直径:≥3 cm 73例,<3 cm 52例。纳入标准:成年;经病理诊断证实为NSCLC;术前无免疫治疗、放疗、化疗史;病历资料及各项检查资料完整;无精神障碍、意识障碍,能配合研究。排除标准:患有严重心血管疾病、脑血管疾病、其他部位原发性肿瘤等危及生命的疾病;凝血功能障碍;因NSCLC复发就诊;患传染性疾病;出现远处转移。本研究获我院伦理委员会批准(2016012502),所有患者均对本研究知情,并自愿签署同意书。
1.2 检测方法
主要仪器:石蜡切片机(德国Leica公司,RM2245型)、烤片机(武汉俊杰电子有限公司,JK-5型)、超低温冰箱(青岛海尔集团,DW86L338J型)、光学显微镜(日本OLYMPUS,CX21型);主要试剂:抗PD-1抗体、抗TIM-1抗体(美国赛默飞世尔科技公司)。
采用免疫组化法检测NSCLC患者癌组织、癌旁组织(距离病灶3~5 cm)中PD-1、TIM-1的表达情况。免疫组化染色:组织样本经10%甲醛固定,并石蜡包埋,石蜡切片厚度为4 μm,置于载玻片备用。将切片分别经二甲苯Ⅰ、Ⅱ浸泡10 min,然后经无水乙醇Ⅰ、Ⅱ各浸泡10 min,经95%、85%乙醇各浸泡5 min,双蒸馏水冲洗5 min,经PBS清洗3次,每次5 min。加入3% H2O2甲醇,在室温下反应10 min,经PBS清洗3次。利用高压锅行抗原修复,采取柠檬酸钠缓冲液高温高压抗原修复法,取柠檬酸钠缓冲液加入沸水内,封盖。取玻片放置在金属染色架加热,使其经PBS浸泡5 min,加热完毕后去除热源,开盖,待样本自然冷却,经PBS清洗3次。滴入正常山羊血清(10%),37 ℃反应20 min。弃血清,加入抗PD-1抗体或抗TIM-1抗体,4 ℃孵育过夜,经PBS清洗3次。甩去PBS,室温孵育过夜后37 ℃反应1 h。加入二抗,37 ℃反应40 min,经PBS清洗3次。甩去PBS,经DAB显色,控制染色深度,经双蒸馏水冲洗,终止染色。行苏木素复染,再次经双蒸馏水冲洗。脱水、透明,封片。
1.3 染色结果评估
评估方法[7]:光学显微镜下随机选择10个高倍视野(×400)进行观察,分析染色情况,以细胞浆、胞膜内出现黄色或棕黄色颗粒判定为阳性细胞。染色强度:无染色(0分)、淡黄色(1分)、棕黄色(2分)、棕褐色(3分)。阳性细胞占比:0~10%(0分)、11%~25%(1分)、26%~50%(2分)、51%~75%(3分)、75%以上(4分)。染色强度评分与阳性细胞占比评分的乘积≤2分为低表达,>3分为高表达。
1.4 随访
术后随访24个月,随访方式包括上门随访、电话随访、门诊随访,患者出院后根据医嘱定期复查。记录患者随访期间的无瘤生存率与总生存率。
1.5 统计学方法
采用SPSS 20.0软件进行数据分析,计数资料用率(%)表示,行χ2检验。采用Spearman相关系数分析PD-1与TIM-1表达的相关性,并分析二者与临床病理特征的关系。经多因素Cox回归分析影响预后的危险因素,采用Kaplan-Meier法计算生存率,log-rank检验比较不同PD-1、TIM-1表达患者的无瘤生存率与总生存率。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 癌组织、癌旁组织PD-1、TIM-1的表达情况及二者表达的相关性分析
癌组织中PD-1、TIM-1高表达率高于癌旁组织(P<0.05),见表1。免疫组化染色结果显示,PD-1、TIM-1在癌旁组织中无明显染色,在癌组织中可见明显的棕黄色或棕褐色染色,见图1。Spearman相关系数分析结果显示,PD-1与TIM-1表达呈正相关(r=0.745,P<0.001)。

a:癌旁组织中PD-1的表达;b:癌组织中PD-1的表达;c:癌旁组织中TIM-1的表达;d:癌组织中TIM-1的表达
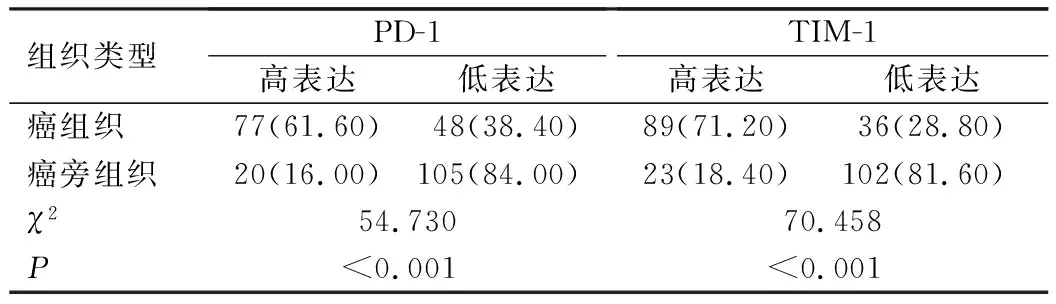
表1 癌组织、癌旁组织中PD-1、TIM-1表达情况比较[n=125,例(%)]
2.2 NSCLC患者PD-1、TIM-1表达与临床病理特征的关系
根据PD-1、TIM-1表达情况分成PD-1、TIM-1高表达组与PD-1、TIM-1低表达组。PD-1、TIM-1高表达组临床分期Ⅲ期、中低分化、淋巴结转移、肿瘤直径≥3 cm的比例高于PD-1、TIM-1低表达组(P<0.05),见表2。

表2 NSCLC患者PD-1、TIM-1表达与临床病理特征的关系[例(%)]
2.3 NSCLC患者生存与死亡情况及多因素Cox回归分析
随访期间,125例NSCLC患者中,死亡34例(27.20%),生存91例(72.80%)。多因素Cox回归分析显示,临床分期Ⅲ期、中低分化、淋巴结转移、肿瘤直径≥3 cm及PD-1、TIM-1高表达是影响预后的危险因素(P<0.05),见表3。

表3 NSCLC患者预后的多因素Cox回归分析
2.4 NSCLC患者PD-1、TIM-1表达与预后的关系
随访期间,PD-1高表达组的无瘤生存率为59.74%,总生存率为63.64%;PD-1低表达组的无瘤生存率为83.33%,总生存率为87.50%,PD-1高表达组的无瘤生存率、总生存率均低于PD-1低表达组(P<0.001),见图2a、b。TIM-1高表达组的无瘤生存率为61.80%,总生存率为66.29%;TIM-1低表达组的无瘤生存率为83.33%,总生存率为88.89%,TIM-1高表达组的无瘤生存率、总生存率均低于TIM-1低表达组(P<0.001),见图2c、d。

a:不同PD-1表达患者的无瘤生存曲线;b:不同PD-1表达患者的总生存曲线;c:不同TIM-1表达患者的无瘤生存曲线;d:不同TIM-1表达患者的总生存曲线
3 讨论
NSCLC是全球比较常见的癌症,具有较高的发病率、复发率、转移率、病死率。随着临床诊断技术的发展,NSCLC的检出率逐年增高,但受癌症浸润、转移、复发等因素影响,NSCLC的预后仍然欠佳,5年生存率未见明显改善[8]。既往临床采用常规肿瘤标记物(如鳞癌细胞抗原、癌胚抗原、神经元特异性烯醇化酶等)评估肺癌病情,虽然有一定价值,但总体作用有限,敏感度、特异度不理想,对预后的评估效果较差[9]。近年来,有研究发现PD-1与肿瘤的发生密切相关,其对外周组织内T淋巴细胞活性有抑制作用,使癌细胞形成免疫抵抗机制[10]。另有研究指出,PD-1与程序性死亡配体-1(programmed cell death-ligand 1,PD-L1)表达增高能促进肿瘤细胞增殖,导致病情进展[11]。此外,王巨等[12]发现TIM-1对辅助性T淋巴细胞1/辅助性T淋巴细胞2的平衡有调节作用,其在桥本甲状腺炎癌变患者中呈过表达,表明TIM-1也具有促癌作用。基于此,本研究通过探索PD-1、TIM-1在NSCLC中的表达情况及其对预后的影响,以期为NSCLC的诊治提供参考。
本研究结果显示,与癌旁组织相比,NSCLC组织中PD-1、TIM-1高表达率更高,且PD-1与TIM-1表达呈正相关,表明二者可能共同参与NSCLC的发生进展。T淋巴细胞所介导的免疫应答在抗肿瘤免疫中有重要作用,而T淋巴细胞活化需要依赖相关的协同刺激分子受体,PD-1是一种非常重要的介导负性协同刺激受体,在T淋巴细胞中存在表达,PD-1/PD-L1信号通路能对T淋巴细胞活化以及增殖进行抑制,导致T淋巴细胞凋亡,使癌细胞逃过免疫监视[13]。杨德松等[14]发现PD-1/PD-L1信号通路参与了NSCLC的进展,该信号通路具有负性调节作用,能抑制B淋巴细胞、T淋巴细胞受体信号路径的激活,从而抑制淋巴细胞增殖,帮助癌细胞免疫逃逸。TIM-1是TIM家族的重要一员,是共刺激分子,在T淋巴细胞表面存在表达,其异常表达可破坏T淋巴细胞亚群的免疫平衡,导致组织细胞出现恶变或者异常增生,引起癌变[15]。Halim等[16]指出TIM-1在正常组织内低表达,而在肾细胞癌、卵巢癌等恶性肿瘤中表达上调,这可能与其对免疫表型的调节作用有关,进一步证实了TIM-1具有促癌作用。由此可见,PD-1与TIM-1高表达均具有促癌作用,可能通过共同破坏T淋巴细胞功能,促进癌细胞增殖。本研究结果显示,NSCLC患者PD-1、TIM-1表达与肿瘤分期、分化程度、淋巴结转移、肿瘤直径有关。分析原因可能为PD-1、TIM-1在NSCLC中发挥促癌作用,二者表达水平越高,则越能促进癌症进展,导致NSCLC分期增高,分化程度降低,肿瘤增长速度加快,淋巴结转移风险增加。
已有研究证实,NSCLC患者的预后与肿瘤临床分期、淋巴结转移等因素有关[17]。本研究结果显示,临床分期Ⅲ期、中低分化、淋巴结转移、肿瘤直径≥3 cm是影响NSCLC患者预后的危险因素,与既往研究结论基本一致[18]。本研究还发现,PD-1、TIM-1高表达也是影响NSCLC预后的危险因素,且二者高表达可导致患者术后24个月的无瘤生存率、总生存率降低。PD-1能帮助癌细胞逃过免疫监视,而TIM-1可通过破坏T淋巴细胞亚群平衡,促进细胞恶变,二者均能加速癌症进展。Fujimoto等[19]发现,NSCLC患者经同步放/化疗后PD-1水平降低,且低表达的PD-1有利于改善患者预后,也提示PD-1表达与NSCLC预后有关,本研究结果与之吻合。但该研究未分析PD-1与NSCLC临床病理特征的关系,本研究分析了PD-1、NSCLC与患者临床病理特征及预后的关系,为NSCLC诊疗提供了更可靠的依据。
综上所述,PD-1、TIM-1在NSCLC组织中高表达,其高表达是影响NSCLC预后的危险因素,对患者无瘤生存率、总生存率有较大影响。但本研究也有局限性,如分析危险因素时纳入变量较少,未来还需进一步完善病历资料,纳入更多变量予以探讨。
