IFITM1在肝癌组织中的表达及临床意义
2022-05-07吴垵梦马志健米日古丽郑威楠成都医学院公共卫生学院预防医学系四川成都60500海南医学院人体解剖学教研室海南海口5799成都医学院基础医学院人体解剖学与组织胚胎学教研室发育与再生四川省重点实验室四川成都60500
吴垵梦,马志健,章 维,袁 静,罗 良,米日古丽,郑威楠 (.成都医学院公共卫生学院预防医学系,四川 成都 60500;.海南医学院人体解剖学教研室,海南 海口 5799;.成都医学院基础医学院人体解剖学与组织胚胎学教研室/发育与再生四川省重点实验室,四川 成都 60500)
世界卫生组织公布全球每年肿瘤患者病死人数约占总死亡人数的1/6[1],2018年癌症数据显示,每分钟里有7人诊断为癌症[2]。肝癌是癌症相关死亡的第三大因素,全球每年肝癌病死人数超过500 000人[3-4]。肝癌发病原因复杂,治疗效果差,易复发,因此,寻找新的筛查指标具有重要意义。干扰素诱导的跨膜蛋白1(interferon-induced transmembrane protein 1,IFITM1)定位于人类11号染色体pl5.5区域,其缺失与多种肿瘤的发病机制密切相关[5]。有研究表明,IFITM1与肿瘤的发生、发展密切相关,其可参与肿瘤同型黏附和增生信号的转导,与增生、病毒感染等有关[6-7]。IFITM1在肝癌的发生发展过程中可抑制病毒的表达,从而发挥抗病毒作用,因此,IFITM1有可能成为新的肝癌肿瘤标记物和筛查指标。前期研究发现IFITM1在维吾尔族妇女宫颈癌组织中低表达,但IFITM1表达水平与宫颈癌的病理分级无相关性[8],且既往研究未阐明IFITM1在肝癌组织病理分级中的意义。因此,本研究探讨IFITM1在肝癌组织中的表达及其在病理分级中的意义,以期为临床提供诊断依据。
1 材料与方法
1.1 标本与试剂
选取2015~2019年海南医学院附属医院肝癌手术中切除的术前未经放疗及化疗的新鲜组织标本和活检新鲜肝组织标本108例,所有取材均经患者同意,并经海南医学院附属医院伦理委员会审核批准(HYLL-2021-378)。其中肝癌的石蜡标本60例,正常肝组织的石蜡标本48例。所有切片均由2位临床病理学副主任医师采用双盲法阅片诊断。
实验所用IFITM1兔抗人单克隆抗体购于美国MILLIPORE公司,二抗试剂(SP9001山羊抗兔)购于北京中杉金桥公司。
1.2 方法
正常肝组织HE染色:二甲苯(Ⅰ、Ⅱ)脱蜡各10 min;100%、90%、80%、70%酒精脱水各5 min;苏木精染色4 min,流水轻轻冲洗;5%乙酸分化1 min,流水冲洗,用吸管滴加5%乙酸,布满玻片上的组织即可。伊红染色1 min,流水冲洗;70%、80%、90%、100%酒精醇洗及脱水各10 s;最后二甲苯透明1 min,自然晾干5 min,滴中性树胶封片。
采用免疫组织化学法对肝癌的石蜡标本进行染色,以PBS代替一抗作为阴性对照。常规二甲苯(Ⅰ、Ⅱ)脱腊处理(各20 min),并以100%、95%、80%、70%酒精脱水处理(各10 min)。灭活内源性过氧化物酶:30%过氧化氢37 ℃孵育10 min,PBS冲洗5 min,循环3次。抗原修复:标本在0.01%枸橼酸缓冲液(pH为6.0)中孵育2~3 min,自然冷却50 min,PBS冲洗5 min,循环3次。使用正常羊血清封闭。滴加一抗,4 ℃冰箱孵育过夜,PBS冲洗5 min;滴加二抗,37 ℃孵育30 min,PBS冲洗5 min,循环3次。滴加辣根过氧化物酶标记的链霉素卵白素,37 ℃孵育30 min,PBS冲洗5 min,循环3次。DAB显色、苏木素复染,常规脱水,透明,干燥,封片。阳性细胞判断标准:染色后IFITM1细胞浆或细胞膜呈棕黄色颗粒。标本染色结果评分标准:标本染色结果评分标准:阳性细胞数低于1%,为阴性(-),记0分;阳性细胞数占1%~15%,为弱阳性(+),记1分;阳性细胞数占15%~50%,呈棕黄色,为阳性(++),记2分;阳性细胞数占50%以上,呈棕褐色,为强阳性(+++),记3分。
1.3 统计学分析
采用SPSS 21.0统计学软件处理数据,数据以率(%)表示,采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 IFITM1在肝癌不同病理分级的免疫组化结果
在正常肝组织中IFITM1高表达,表达较均一,而肝癌组织中IFITM1低表达,表达不均一,且肝癌分化程度不同,蛋白表达水平也不同;肝癌组织病理分级与IFITM1表达水平密切相关,肝癌组织的分化程度越高,IFITM1表达水平越高,肝癌的恶性程度越低;而肝癌组织的分化程度越低,IFITM1表达水平越低,肝癌的恶性程度越高,差异有显著统计学意义(P<0.01),见图1。
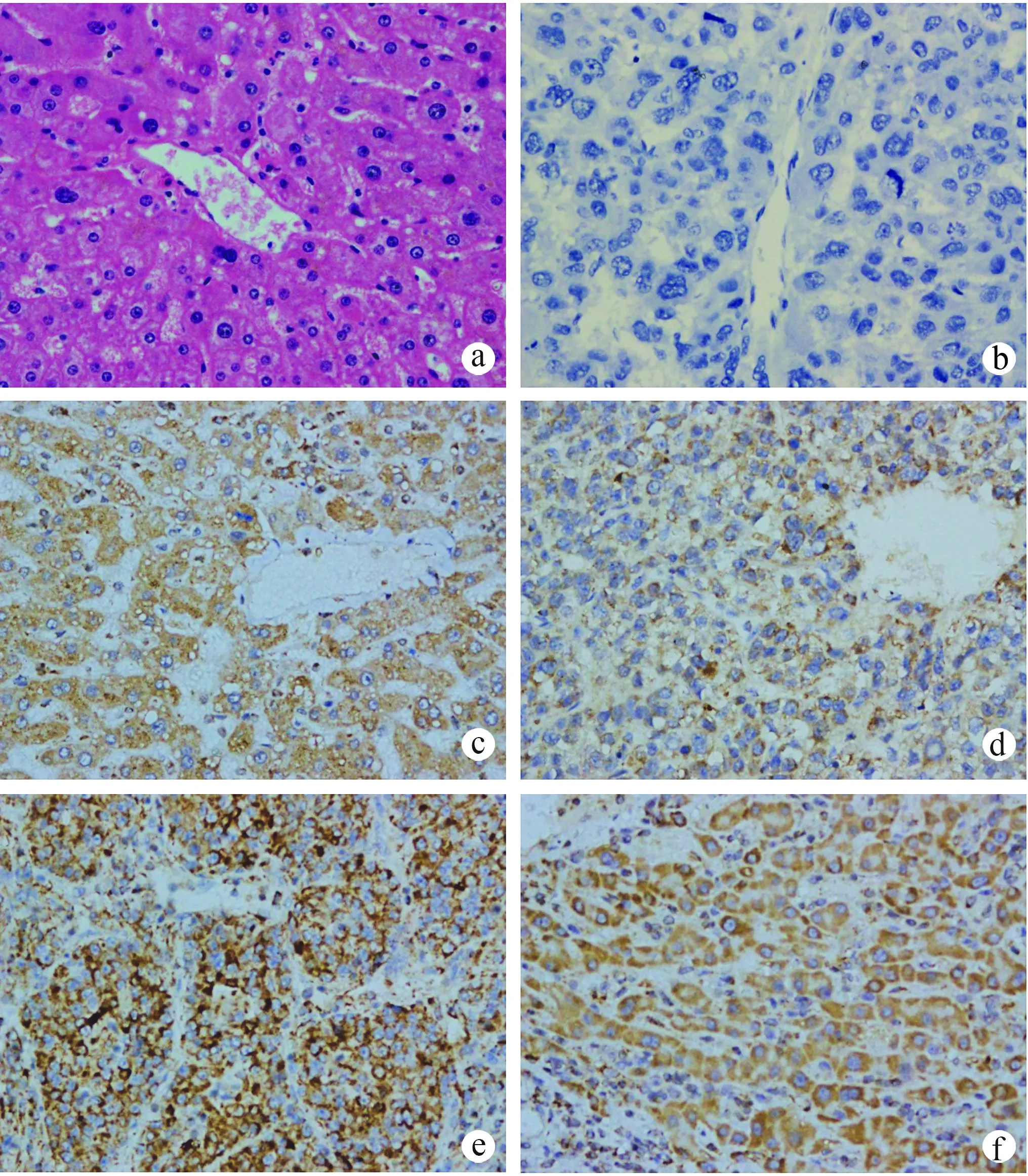
a:正常肝组织HE染色;b:阴性对照;c:正常肝组织中IFITM1的表达;d:高分化肝癌组织中IFITM1的表达;e:中分化肝癌组织中IFITM1的表达;f:低分化肝癌组织中IFITM1的表达
免疫组织化学法分析显示,60例肝癌组织中强阳性1例(1.67%)、阳性11例(18.33%)、弱阳性41例(68.33%)、阴性7例(11.67%),48例正常肝组织中强阳性1例(2.08%)、阳性40例(83.33%)、阳性7例(14.58%)。肝癌组织中IFITM1低表达或不表达,与正常肝组织相比,差异有显著统计学意义(χ2=46.292,P<0.01)。
2.2 IFITMI在肝癌患者中的表达与临床特征的关系
60例肝癌组织分为高、中、低分化癌,其中5例高分化肝癌组织中强阳性2例、阳性2例、弱阳性1例;15例中分化肝癌组织中强阳性3例、阳性7例、弱阳性5例;40例低分化肝癌组织中强阳性1例、阳性3例、弱阳性35例、阴性1例。肝癌组织中包膜完整16例,包膜不完整44例。16例包膜完整的肝癌组织中阳性3例、弱阳性7例、阴性6例;44例包膜不完整的肝癌组织中强阳性1例、阳性8例、弱阳性34例、阴性1例。肿瘤直径小于5 cm的肝癌组织16例;肿瘤直径大于或等于5 cm的肝癌组织44例。16例肿瘤直径小于5 cm的肝癌组织中阳性1例、弱阳性10例、阴性5例;44例肿瘤直径大于或等于5 cm的肝癌组织中强阳性1例、阳性10例、弱阳性31例、阴性2例。肝癌患者不同病理分级IFITM1表达水平比较差异有统计学意义(P<0.01),见表1。
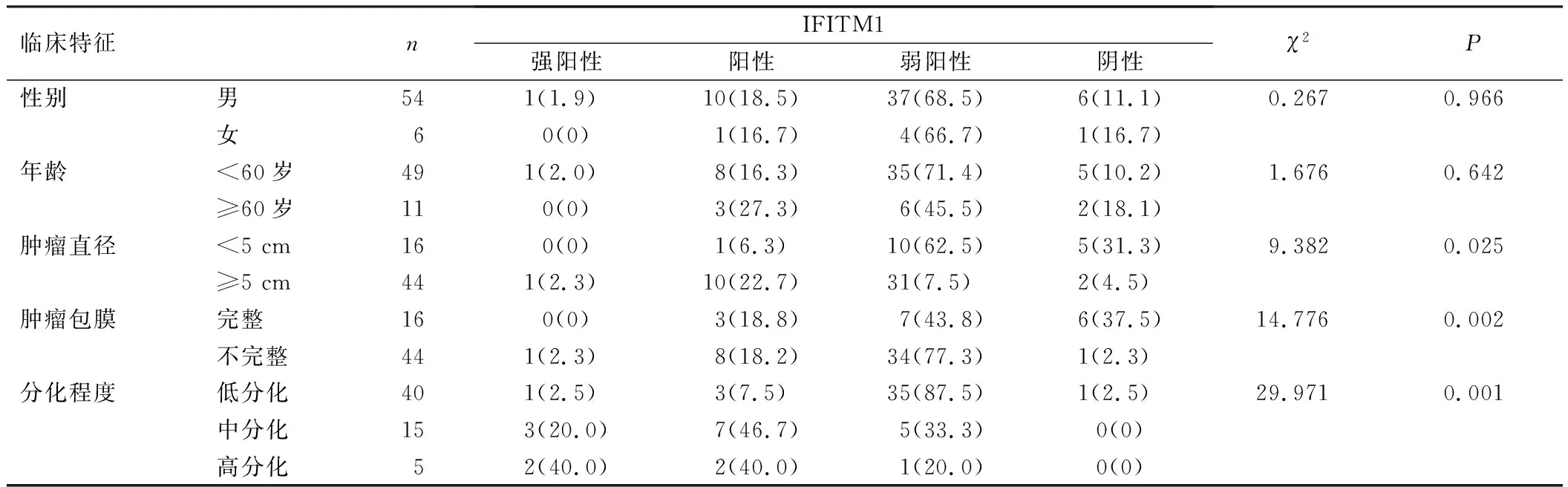
表1 IFITM1在不同病理分级肝癌患者中的表达与临床特征的关系[例(%)]
3 讨论
2018年全球消化道恶性肿瘤的患者死亡人数占全部肿瘤相关死亡人数的40%以上[9]。海南地区肝癌病死率居各类恶性肿瘤的第一位[10],其中海南南部地区少数民族人群的肝癌病死率较高,地域分布特征明显[11]。海南肝癌高发与病毒感染及生活环境、习惯等相关[11]。
干扰素诱导的跨膜蛋白(interferon-induced transmembrane protein,IFITM)是一个小的同源蛋白家族,定位于细胞浆和内溶酶体膜,可赋予细胞对许多病毒的抗性,IFITM家族有IFITM1、IFITM2、IFITM3,是抗多种RNA病毒的宿主效应蛋白。人类11号染色体pl5.5区域的缺失被认为与多种癌症的发病机理密切相关,而IFITM1定位于此区域[5],最初是作为淋巴细胞的表面抗原而被发现[12-14]。
Pan等[15]研究发现,IFITM1在维吾尔族妇女宫颈癌组织中低表达,但IFITM1在宫颈癌中的表达水平与病理分级无关。IFITM1在不同组织器官中的表达形式、表达水平不同[16]。IFITM1在卵巢癌[17]、子宫内膜异位症[18]、小细胞肺癌[19]、口腔癌及头颈部肿瘤[20]、胆囊鳞状细胞癌/腺鳞癌和腺癌[21]、直肠癌[22]、乳腺癌[23]等患者的肿瘤组织中呈高表达,但在胰腺癌[24]、低级别扩散的星型细胞瘤[25]等患者的肿瘤组织中呈低表达甚至不表达。在肝癌和乳腺癌中,miR-29a以及Ras-GTP酶激活蛋白SH3结构域结合蛋白均能与IFITM mRNA的3’-UTR结合,而IFITM mRNA的3’-UTR正向调控IFITM1表达[26-28],但其机制尚未明确。肝炎病毒感染是全球肝细胞癌和肝硬化发生的主要原因之一,Wilkins等[29]的研究证实IFITM1是一种肝细胞紧密连接蛋白,也是一种有效的抗丙型肝炎病毒的效应分子,IFITM1表达在Ⅰ型干扰素治疗肝细胞的早期被诱导,通过与丙型肝炎病毒共受体(包括CD81和occludin闭合蛋白)相互作用,从而破坏病毒进入的过程,提示IFITM1可通过阻断病毒共受体功能来控制丙型肝炎病毒感染。Xie等[30]研究显示,IFITM1作为p53的下游效应因子,可能受到p53介导的自噬及母参碱诱导的人肝癌细胞自噬的调控,使自噬转变为凋亡,对肝癌具有抑制作用。本研究结果显示,正常肝组织中IFITM1表达水平较高,而肝癌组织中IFITM1表达水平明显较低,IFITM1在肝癌中的表达与性别、年龄无关,但与肿瘤直径、肿瘤包膜完整性及分化程度有关。IFITM1肝癌组织病理分级及IFITM1表达水平与肝癌预后不良密切相关,肝癌的分化程度越高,IFITM1表达水平越高,肝癌的恶性程度相对越低;而分化程度越低,IFITM1表达水平相对越低,肝癌的恶性程度相对越高。由此,IFITM1表达与患者预后不良相关,IFITM1有可能是一个潜在的抑制肝癌发展的基因,可能成为肝癌诊断、治疗的标志物。
