lncRNA01535通过JAK/STAT3通路调节毛囊干细胞增殖和分化的作用研究*
2022-05-07姜金豆周建敏董温云黄亚奔王佳雯
朱 君,姜金豆,周建敏,董温云,黄亚奔,王佳雯
(1.温州医科大学温州市第三临床学院/温州市妇幼保健院/温州市人民医院整形外科,浙江温州325000;2.广东省妇幼保健院医疗美容科,广州 510010)
毛囊干细胞(HFSC)属于成年干细胞,在静态下显示出较强的增殖能力[1]。研究发现,HFSC具有多向分化潜能,可以分化为皮肤、毛囊、皮脂腺,并参与皮肤伤口的愈合过程[2]。研究表明,HFSC可以通过靶向Janus激酶(JAK)来诱导毛囊生长,HFSC通过上调信号转导与转录激活子3(STAT3)激活而分化为转运扩增细胞[3]。另1项研究表明,HFSC的体内转录调控可能受STAT3调控子调控:miR-128通过靶向STAT3来调节毛囊间充质干细胞向平滑肌细胞的分化[4]。长链非编码RNA(lncRNA)是指一类长度大于 200 nt但不编码蛋白的RNA分子,已被确定在细胞的增殖和分化中起作用。近年来,lncRNAs已成为许多人类疾病研究的重点,包括代谢和遗传性疾病、癌症和人类干细胞分化[5]。有证据表明,lncRNAs与细胞信号通路转导相关,也是细胞疗法的靶标[6-7]。分子信号传导机制已证实lncRNA通过调节HFSC的不同信号途径与多种细胞代谢过程相关[8]。截至目前,尚未见lncRNA01535在HFSC中的表达及其调控HFSC分化的机制研究,本研究拟分析lncRNA01535对HFSC增殖和分化的调控作用及JAK/STAT3通路在其中发挥的作用,为临床皮肤病的治疗提供理论依据。
1 材料与方法
1.1 主要试剂及仪器
胎牛血清、青霉素、链霉素、10%十二烷基钠硫酸-聚丙烯酰胺凝胶(SDS-PAGE)、JAK一抗(1∶1 000)、STAT3一抗(1∶1 000)、GAPDH一抗(1∶2 000)购自美国Sigma公司(批号:ER-54863、KJ-5874.63、BV-5489.64、VB-471.65、F1555.52、G584.63、V6363.52),lncRNA01535 mimics、lncRNA01535 inhibitor购自武汉金开瑞生物公司(批号:XS-474.36、VF-748.36),DMEM培养基购自美国Hyclone公司(批号:DE-5596.56);Lipofectamine2000购自美国Thermo Fisher Scientific公司(批号:WR-474.26),细胞计数试剂盒8(CCK-8)、PrimeScript RT Master Mix试剂盒购自日本希森美康公司(批号:XC469.52、ZA-478.36);油红O、细胞裂解液购自上海碧云天生物科技公司(批号:XQ-5858.45、XC-58.65);膜联蛋白V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒购自美国Vazyme公司(批号:XE-471.36);细胞周期检测试剂盒购自武汉AmyJet Scientific公司;TRIzol试剂盒购自美国Invitrogen公司(批号:SC-458.36),SYBR Select Master Mix、ABI 7300系统购自美国Applied Biosystems公司(批号:ED-585.36、EY-4741.65);聚偏氟乙烯(PVDF)膜、增强的化学发光(ECL)显影剂购自美国Millipore公司(批号:MN-69853.2、DC-4523.54);辣根过氧化物酶标记的山羊抗兔二抗(1∶10 000)购自美国Merck KgaA公司(批号:W098.34)。Synergy Mx-89多模式酶标仪购自日本希森美康,WE-98流式细胞仪购自美国BD Biosciences公司,NanoDrop紫外分光光度计购自美国Thermo Fisher Scientific公司。
1.2 细胞培养及分组
HFSCs细胞系购自中国科学院上海典型培养物保藏中心,在37 ℃、5% CO2、2% O2、93% N2培养箱中,用10%胎牛血清、1%青霉素和链霉素(100 IU/mL)的DMEM培养基(美国Hyclone)培养。细胞分为HFSCs组、lncRNA01535 mimics组、lncRNA01535 inhibitor组。HFSCs组细胞不做任何处理;lncRNA01535 mimics、lncRNA01535 inhibitor组细胞分别转染10 mL lncRNA01535 mimics、10 mL lncRNA01535 inhibitor。转染方法:取10 mL HFSCs液(细胞浓度为5×106/mL)接种于6孔板,分别取100 pmol的 lncRNA01535 mimics、lncRNA01535 inhibitor于200 μL DMEM培养基中,再加4 μL Lipofectamine2000混匀,室温孵育30 min,无菌PBS洗涤细胞,将上述混合液加入细胞孔内,6 h 后弃混合液,加入含10%胎牛血清的DMEM培养基培养。
1.3 细胞增殖存活的测定
CCK-8试剂盒分析细胞增殖。取对数期生长的HFSCs,将细胞以每孔5 000个细胞的密度接种于96孔板中,72 h后,将10 μL CCK-8溶液添加至每个孔中。在37 ℃下孵育1.5 h后,在酶标仪于450 nm处测量吸光度(A)值,存活率=(实验组A值-HFSCs组A值)/(实验组A值-蒸馏水空白调零组A值)×100%。
1.4 细胞分化水平测定
将HFSCs以5 000/孔的细胞密度接种于96孔板中。将细胞保持在1%琼脂包被上,分化18 d。10%甲醛溶液固定细胞1 h,随后用60%油红O染色10 min。分化率=油红O阳性细胞的比例/总细胞数×100%。
1.5 细胞周期、凋亡水平测定
将HFSCs与双重染色FITC/PI细胞凋亡检测试剂盒混合,在室温下孵育10 min,上流式细胞仪分析细胞凋亡情况。根据细胞周期检测试剂盒的操作说明,将收集的细胞在70%乙醇中固定过夜。将细胞与100 μL PI于4 ℃避光孵育30 min,上流式细胞仪检测细胞周期分布。
1.6 细胞lncRNA01535、JAK、STAT3 mRNA水平测定
TRIzol法提取细胞总RNA,并使用NanoDrop紫外分光光度计测量RNA的纯度和浓度。通过PrimeScript RT Master Mix将1.5 μg RNA反转录为cDNA,然后于-20 ℃保存。使用SYBR Select Master Mix在ABI 7300系统中进行实时荧光定量PCR(RT-qPCR)反应,GAPDH的表达水平作为标准化的内参。相关mRNA的表达水平通过2-ΔΔCt法计算。引物购自广州富伦根有限公司,引物序列如下:GAPDH正向5′-CCA GCC GAG CCA CAT CGC TC-3′,反向5′-ATG AGC CCC AGC CTT CTC CAT-3′;lncRNA01535正向5′-GGG CGG CAG GTC ACT GAC AC-3′,反向5′-GCC AGC AGC CGC TGG CTT AG-3′;JAK正向5′-GCA ATA CTC GCC TTA CGG CT-3′;反向5′-TAC ACA CCT TGT AGT ACG CC-3′;STAT3正向5′-ACA ACT TTG GTA TCG TGG AAG G-3′,反向5′-ATG AGC CCC AGC CTT CTC CAT-3′。
1.7 细胞JAK、STAT3蛋白水平测定
各组HFSCs用细胞裂解液裂解以提取总蛋白。BCA法测定蛋白浓度。通过水浴变性后,加入蛋白上样缓冲液,并使用10% SDS-PAGE电泳分离蛋白,将蛋白质转移至PVDF膜上,并在室温下用5%牛血清清蛋白封闭1 h。随后,添加JAK、STAT3、GAPDH一抗在4 ℃下孵育过夜,然后添加辣根过氧化物酶标记的山羊抗兔二抗,在室温下孵育2 h,然后借助ECL显影剂进行显影。使用ImageJ软件(美国马里兰州国立卫生研究院)量化条带强度。
1.8 统计学处理

2 结 果
2.1 各组HFSCs细胞存活率比较
与HFSCs细胞组[(60.85±9.56)%]比较,lncRNA01535 mimics组细胞存活率[(73.54±9.26)%]升高,lncRNA01535 inhibitor组细胞存活率[(52.21±5.33)%]降低(P<0.05);与lncRNA01535 mimics组比较,lncRNA01535 inhibitor组细胞存活率降低(P<0.05),差异均有统计学意义。
2.2 各组HFSCs细胞分化率、凋亡率及G1期细胞比例比较
与HFSCs细胞组比较,lncRNA01535 mimics组细胞分化率升高,细胞凋亡率和G1期细胞比例降低(P<0.05),lncRNA01535 inhibitor组细胞分化率降低,细胞凋亡率和G1期细胞比例升高(P<0.05);与lncRNA01535 mimics组比较,lncRNA01535 inhibitor组细胞分化率降低、细胞凋亡率和G1期细胞比例升高(P<0.05),差异均有统计学意义。见表1,图1、2。

表1 各组HFSCs细胞分化率、凋亡率及G1期比较
2.3 各组HFSCs细胞lncRNA01535、JAK、STAT3 mRNA表达水平比较
与HFSCs细胞组比较,lncRNA01535 mimics组lncRNA01535、JAK、STAT3 mRNA表达水平升高(P<0.05),lncRNA01535 inhibitor组lncRNA01535、JAK、STAT3 mRNA表达水平降低(P<0.05);与lncRNA01535 mimics组比较,lncRNA01535 inhibitor组细胞lncRNA01535、JAK、STAT3 mRNA表达水平降低(P<0.05),差异均有统计学意义。见表2。
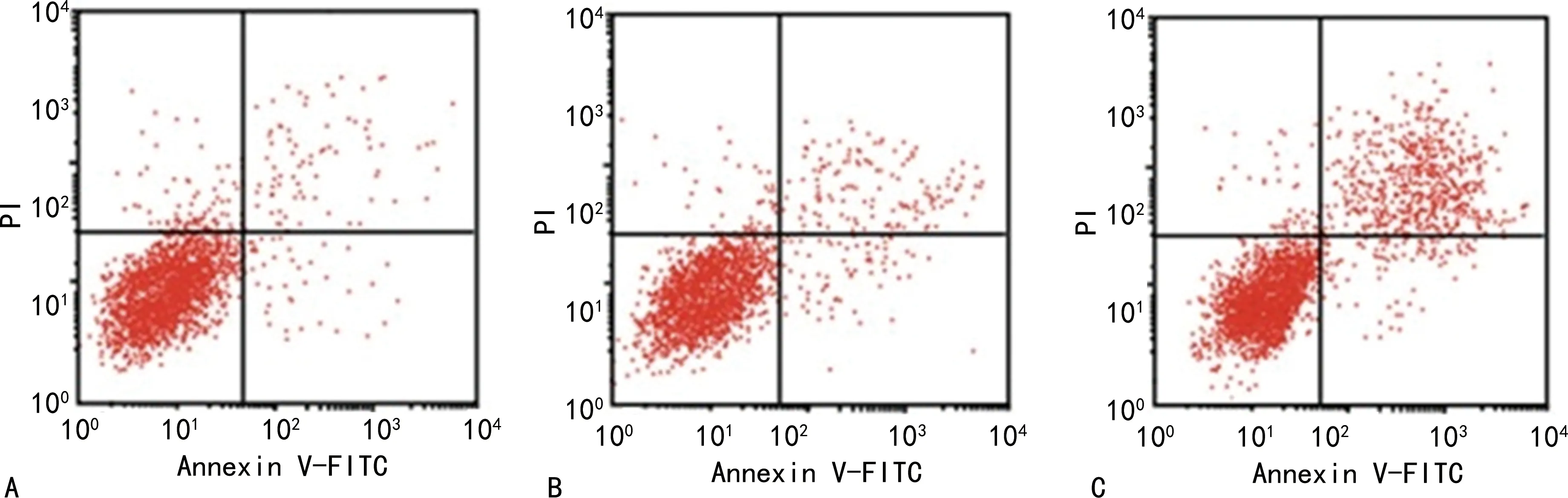
A:HFSCs细胞组;B:lncRNA01535 mimics组;C:lncRNA01535 inhibitor组。

A:HFSCs细胞组;B:lncRNA01535 mimics组;C:lncRNA01535 inhibitor组。

表2 各组HFSCs细胞lncRNA01535、JAK、STAT3 mRNA表达水平比较
2.4 各组HFSCs细胞JAK、STAT3蛋白表达水平比较
与HFSCs细胞组比较,lncRNA01535 mimics组细胞JAK、STAT3蛋白表达水平升高(P<0.05),lncRNA01535 inhibitor组细胞JAK、STAT3蛋白表达水平降低(P<0.05);与lncRNA01535 mimics组比较,lncRNA01535 inhibitor组细胞JAK、STAT3蛋白表达水平降低(P<0.05),差异均有统计学意义。见表3,图3。

表3 各组HFSCs细胞JAK、STAT3蛋白表达水平 比较

A:HFSCs细胞组;B:lncRNA01535 mimics组;C:lncRNA01535 inhibitor组。
3 讨 论
成体干细胞可以替代垂死的细胞并尽快修复受损的组织,因此在维持组织稳态方面起着至关重要的作用。HFSC对于毛囊的产生、维持和更新至关重要。除了体内正常的生理功能外,HFSC还被认为是深层皮肤损伤,组织工程和再生医学中伤口组织修复必不可少的干细胞。HFSC是血管工程和干细胞疗法的重要来源。更重要的是,HFSC具有增殖、集落形成、再生的特征,此外HFSC易于获取且侵入性小,因此备受关注。阐明HFSC增殖,分化,凋亡的分子机制至关重要。
LncRNA已证明在HFSCs多系分化进程中具有潜在作用。LncRNA PCAT1通过调节miR-329/Wnt10b轴参与间充质干细胞分化[9];LncRNA5322通过PI3K/AKT信号途径调节毛囊干细胞增殖和分化[10];lncRNA-H19被证明通过充当miR-199a-5p的内源性竞争RNA(ceRNA)来促进间充质干细胞的存活和血管生成能力[11]。有关基因治疗和新型伤口治疗的研究报道表明,有必要将表皮细胞和HFSCs视为不同的种群,lncRNA01535可以通过充当miR-19b-3p的诱饵来促进HFSCs的增殖[12];此外,lncRNA01535可促进毛囊源性神经干细胞向雪旺细胞分化[13]。本研究分析了lncRNA01535对HFSCs增殖和分化的调控作用。结果显示:与HFSCs细胞组比较,lncRNA01535 mimics组、细胞存活率、细胞分化率升高,细胞凋亡率、G1期细胞比例降低;lncRNA01535 inhibitor组细胞存活率、细胞分化率降低,细胞凋亡率、G1期细胞比例升高(P<0.05);与lncRNA01535 mimics组比较,lncRNA01535 inhibitor组细胞存活率、细胞分化率降低,细胞凋亡率、G1期细胞比例升高(P<0.05)。这表明lncRNA01535过表达刺激了HFSCs的增殖和分化,抑制了HFSCs凋亡,而lncRNA01535表达抑制了HFSCs的增殖和分化,促进了HFSCs凋亡;表明lncRNA01535可调控HFSCs的增殖和分化。
为了研究lncRNA01535调节HFSCs增殖和分化的机制,本研究评估了JAK/STAT3通路。结果表明,在lncRNA01535 mimics转染的HFSCs中JAK、STAT3基因与蛋白的表达显著增加。有研究报道JAK能够调节人骨髓干细胞中骨形态发生蛋白2诱导的β-catenin活化[14]。还有研究表明JAK/STAT3通路在人类神经干细胞向神经元分化中起关键作用[15]。本研究结果显示,与HFSCs细胞组比较,lncRNA01535 mimics组lncRNA01535 mRNA,JAK、STAT3 mRNA和蛋白表达水平升高,lncRNA01535 inhibitor组细胞lncRNA01535 mRNA,JAK、STAT3 mRNA和蛋白表达水平降低(P<0.05);与lncRNA01535 mimics组比较,lncRNA01535 inhibitor组细胞lncRNA01535,JAK、STAT3 mRNA和蛋白表达水平降低(P<0.05)。这说明lncRNA01535过表达导致HFSCs中JAK/STAT3通路的表达上调。JAK是胚胎成纤维细胞中lncRNA01535的直接靶基因[16]。此外,已有研究证明lncRNA01535可以与JAK特异性结合以调节人间充质干细胞的成骨分化[17]。此外,在肝细胞癌(HCC)中发现lncRNA01535表达与JAK表达呈正相关,并且JAK升高可预示HCC患者的预后不良[18]。此外已有研究证明lncRNA01535靶向STAT3参与人毛囊来源的间充质干细胞(HF-MSC)向平滑肌细胞(SMC)的分化过程,可作为SMC的组织工程和再生医学的潜在靶标[19]。综上所述,lncRNA01535促进HFSCs的增殖和分化;其机制可能与lncRNA01535激活HFSCs中JAK/STAT3通路有关。
