两株杆状细菌的分离及其风化能力初探
2022-05-07刘涛张爽王伟东晏磊
刘涛,张爽,王伟东,晏磊
(黑龙江八一农垦大学生命科学技术学院/黑龙江省寒区环境微生物与农业废弃物资源化利用重点实验室,大庆 163319)
五大连池火山群位于黑龙江省黑河地区五大连池市,是我国东部地区著名的第四纪火山群之一。老黑山是一座斯通博利型活火山,第一次喷发时间为1720 年1 月至1721 年3 月,最近一次喷发时间是1776 年,是五大连池火山带最年轻的火山之一,地质和生物的演变速度相对比较快[1-2]。老黑山中火山石的主要类型为钾质玄武岩,其主要成分包括二氧化硅、氧化铝、氧化铁、氧化亚铁、氧化钙、氧化钾等。老黑山属于温带大陆性季风气候区。年平均气温在-0.5 ℃左右,无霜期有121 d,年平均降水量476.33 mm,年平均相对湿度69.2%[3]。由于老黑山这一贫瘠而独特的环境与地球早期环境相似,致使老黑山成为岩石风化、地球早期土壤形成等科学研究的理想场地。
火山石风化是指暴露在山体表面的火山石,在各种环境因素(如风、雨水、太阳等)及生物的影响下发生的风化作用。火山石风化是一种非常重要的地质变化过程,是岩石向土壤演化的前提,也是土壤中矿物元素的重要来源之一。风化作用主要包括物理风化、化学风化、和生物风化。物理风化指在温度、湿度、压力等因素的作用下,使岩石矿物发生崩碎的现象,包括风蚀、晶盐风化、冷热风化、干湿风化等。不同于物理风化,化学风化可以使岩石矿物的化学组分发生变化,其风化方式有溶解、水解、碳酸化作用、氧化还原反应等[4]。生物风化主要体现在生物活动加剧岩石的物理或化学风化作用。细菌风化火山石的机制非常复杂,包括有机酸的腐蚀作用、螯合物的螯合作用、氧化还原作用、生物膜的作用等。有研究表明钙长石的溶解与细菌产生的有机酸有一定的相关性[5],Fe、Al 等[6]元素可以与有机酸形成络合物,降低阳离子浓度,从而改变风化反应的动力学条件,进而促使矿物元素溶出。在缺铁环境下,一些细菌可利用铁载体螯合Fe3+,从而通过破坏矿物的晶格的方式加快矿物风化[7]。细菌通过与矿物中的含铁氧化物进行样化还原作用获得自身生长代谢所需要的营养,从而破坏矿物的晶格[8-9]。细菌产生的生物膜对有机酸和一些无机离子具有吸附作用,有利于细菌从矿物中获取营养,同时增加了矿物表面的持水作用,促进岩石的风化[10-11]。
研究表明,芽孢杆菌属细菌对岩石风化具有促进作用 ,Bacillus amyloliquefaciens、Bacillus subtilis、Bacillus aerophilus 等芽孢杆菌对钾质粗面岩、硅酸盐、富钾页岩、钾长石等岩石具有一定的生物风化作用[12-13]。而对于金黄杆菌属细菌的风化能力研究相对较少,有报道称部分金黄杆菌属细菌对重金属有较强的耐受性[14],少数金黄杆菌属细菌(如Chryseobacterium sp.,保藏号:CCTCC M2017810)对岩石矿物等有一定的风化作用[15]。细菌对火山石的风化作用是地表及其附近发生的最重要的地球化学现象之一,促进了土壤的形成,是重要的地质化学现象之一,具有重要的研究意义。
基于上述问题,研究选择老黑山火山石为研究对象,采用平板分离和16S rRNA 基因测序的方法分离得到芽孢杆菌和金黄杆菌,研究其生理生化特性,及在合适生长因素下对火山石的风化情况,为探究火山石风化为土壤的微生物过程提供基础。
1 材料和方法
1.1 样品
火山石样品来自黑龙江五大连池老黑山。
1.2 主要试剂仪器
主要仪器:隔水式恒温培养箱(GSP-9080MBE型,上海博讯实业有限公司医疗设备厂),空气浴摇床(HZQ-C 型,哈尔滨市东联电子技术开发有限公司),PCR 仪(2720 Thermal Cycler),酶标仪(MB-580型,深圳市汇松科技发展有限公司),紫外可见分光光度计(721 型,中国上海菁华科技仪器公司),电泳仪(JY300C 型,北京君意东方电泳设备有限公司),盐度计(CNY28 型,杭州陆恒生物科技有限公司)。
培养基:LB 培养基,10 g·L-1NaCl,10 g·L-1胰蛋白胨,5 g·L-1酵母浸粉,pH 7.0。LB 半固体培养基,10 g·L-1NaCl,10 g·L-1胰蛋白胨,5 g·L-1酵母浸粉,12 g·L-1琼脂,pH 7.0。
1.3 实验方法
1.3.1 细菌分离
取 5 g 火山石置于 50 mL 无菌水中,120 rpm,30 ℃,富集2 h。
稀释涂布:将富集液稀释至 10-1,10-2,10-3,10-4倍,分别取200 μL 稀释液涂布于LB 半固体培养基上,28 ℃恒温培养箱中培养。
分离划线:挑取单菌落划线分离,分离3 次以上。
1.3.2 细菌的DNA 提取与PCR 扩增
四季平均相对湿度36.80%,春季22.18%,夏季32.15%,秋季46.78%,冬季46.49%,观测期间最高99.90%,最低3.68%。
DNA 提取试剂盒法:依照试剂盒说明书的步骤提取细菌DNA。
PCR 总体系为 25 μL,ddH2O 10.5 μL,上下引物各 0.5 μL,2 x Taq Mix 12.5 μL,细菌 DNA 1 μL。PCR 反应程序如表1 所示。

表1 PCR 反应程序Table 1 PCR procedure
1.3.3 细菌的分子鉴定
PCR 产物送至生工生物工程(上海)股份有限公司测序,测序结果使用DNAMAN 8 软件进行拼接后,应用 EZ BioCloud(https://www.ezbiocloud.net/identify)对扩增菌株的16S rRNA 基因序列比对,并在比对结果中下载标准菌株序列,利用MEGA X(https://www.megasoftware.net/)建立系统发育树。将细菌序列上传至NCBI 中GenBank 数据库,获取菌株序列登录号。
1.3.4 细菌生长的理化因素分析
分别配制不同盐度(5.0、7.5、10.0、12.5、15.0 g·L-1)、不同温度(15、25、28、30、35 ℃)、不同 pH(6.0、6.5、7.0、7.5、8.0)的 LB 培养基,接种不同接种量(0.5%、1%、2%、4%、8%) 的 Bacillus zanthoxyli LHS-LT20(B.zanthoxyli LHS-LT20),每个处理3 个重复。分别配制不同盐度(5.0、7.5、10.01、12.5、15.0 g·L-1)、不同温度(25、28、30、35、40 ℃)、不同 pH(6.0、6.5、7.0、7.5、8.0)的 LB 培养基,接种不同接种量(0.5%、1%、2、4%、8%)的 Chryseobacterium nepalense LHS-LT47(C.nepalense LHS-LT47),每个处理3 个重复。以LB培养基为对照。以培养相同时间的菌液OD600 为指标来考察各因素对B.zanthoxyli LHS -LT20 和C.nepalense LHS-LT47 的影响.
1.3.5 细菌风化能力测定
将火山石粉碎过筛至0.5~1.5 mm 左右,自来水清洗去除灰尘等杂质,蒸馏水冲洗3 次以上,至水溶液不浑浊,于60 ℃干燥箱中干燥恒重,紫外灭菌2 h,备用。
取1.000 g 火山石粉末装入100 mL 锥形瓶,加入 50 mL 的 LB 培养基,121 ℃,20 min 灭菌备用。将B.zanthoxyli LHS-LT20 和 C.nepalense LHS-LT47 的对数期菌液离心收集菌体,LB 培养基调节OD600 至0.8 左右。接种 B.zanthoxyli LHS-LT20 和 C.nepalense LHS-LT47,以LB 培养基为对照,接种量为1%,120 rpm,30 ℃,培养 3、6、9、12、15 d,每个处理 3 个重复。将培养基静止10 min,吸取上清液2 000 rpm 离心5 min 去除菌体对吸光度干扰,吸取上清液至5 mL离心管中,编号制得待测液。
火山石风化过程中,培养基中将会溶出一部分的 Fe、Ca、Al、Si、K 等元素。研究以培养基中 Fe 浓度反应火山石的风化风化程度,并采用邻菲罗啉法检测培养基中Fe 浓度[16-19]。以硫酸盐铁铵配制不同浓度Fe 标准液,分别取1 mL 不同浓度的标准液,依次加入10%盐酸羟胺1 mL,醋酸—醋酸钠(pH4.6)缓冲液5 mL,0.5%的邻菲罗啉2 mL,放置15 min 后,在510 nm 波长紫外分光光度计下,测定吸光度,得标准曲线 y=0.191 2 x+0.016 25,R2=0.999 5。取 1 mL 待测液,依次加入10%盐酸羟胺1 mL,醋酸—醋酸钠(pH4.6)缓冲液5 mL,0.5%的邻菲罗啉2 mL,放置15 min 后,在510 nm 波长紫外分光光度计下,测定吸光度,根据标准曲线计算待测液中Fe 浓度。
1.4 数据统计分析
应用 SPSS 26(https://www.ibm.com/) 对 OD600和Fe 浓度等数据进行单因素方差分析(Duncan,新复极差检验),并采用 Origin 2018(https://www.originlab.com/)对菌液的OD600 和Fe 浓度等数据进行统计分析及绘图。
2 结果与分析
2.1 细菌分离鉴定
老黑山火山石样品经平板分离纯化后得到两株细菌,B.zanthoxyli LHS-LT20 菌落呈淡黄色圆形,表面光滑,边缘完整,菌落直径0.9~1.5 mm(图1a);C.nepalense LHS-LT47 菌落为橙色圆形,表面光滑,边缘完整,菌落直径为1.0~1.8 mm(图1b)。将分离菌株 B.zanthoxyli LHS-LT20、C.nepalense LHS-LT47 的PCR 产物进行16S rRNA 双端测序,测序结果使用DNAMAN 8 软件拼接后得到长度分别为1 467 bp(GC 含量为 53.72%) 和 1 422 bp (GC 含量为50.07%) 的两条序列。将B.zanthoxyli LHS-LT20、C.nepalense LHS-LT47 序列上传至GenBank 数据库获得登录号NW535242 和NW535243。

图1 菌落形态(a:B.zanthoxyli LHS-LT20;b:C.nepalense LHS-LT47)Fig.1 Colonial morphology(a:B.zanthoxyli LHS-LT20;b:C.nepalense LHS-LT47)
将B.zanthoxyli LHS-LT20 序列提交至EZ Bio-Cloud 中的16S-based ID 比对可知,菌株B.zanthoxyli LHS-LT20 与Bacillus zanthoxyli 1433 相似度最高,为99.16%,登录号为KX865140;同时与Bacillus megaterium NBRC 15308(登录号:JJMH01000057)和Bacillus flexus NBRC 15715(登录号:BCVD01000224)亲缘性较高,相似度高达98.56%和97.54%。以16S rRNA 同源性为基础采用邻接法构建包括10 株Bacillus 属标准菌株的系统发育树。由图2a 可知,B.zanthoxyli LHS-LT20 与芽孢杆菌属细菌同源性较高。
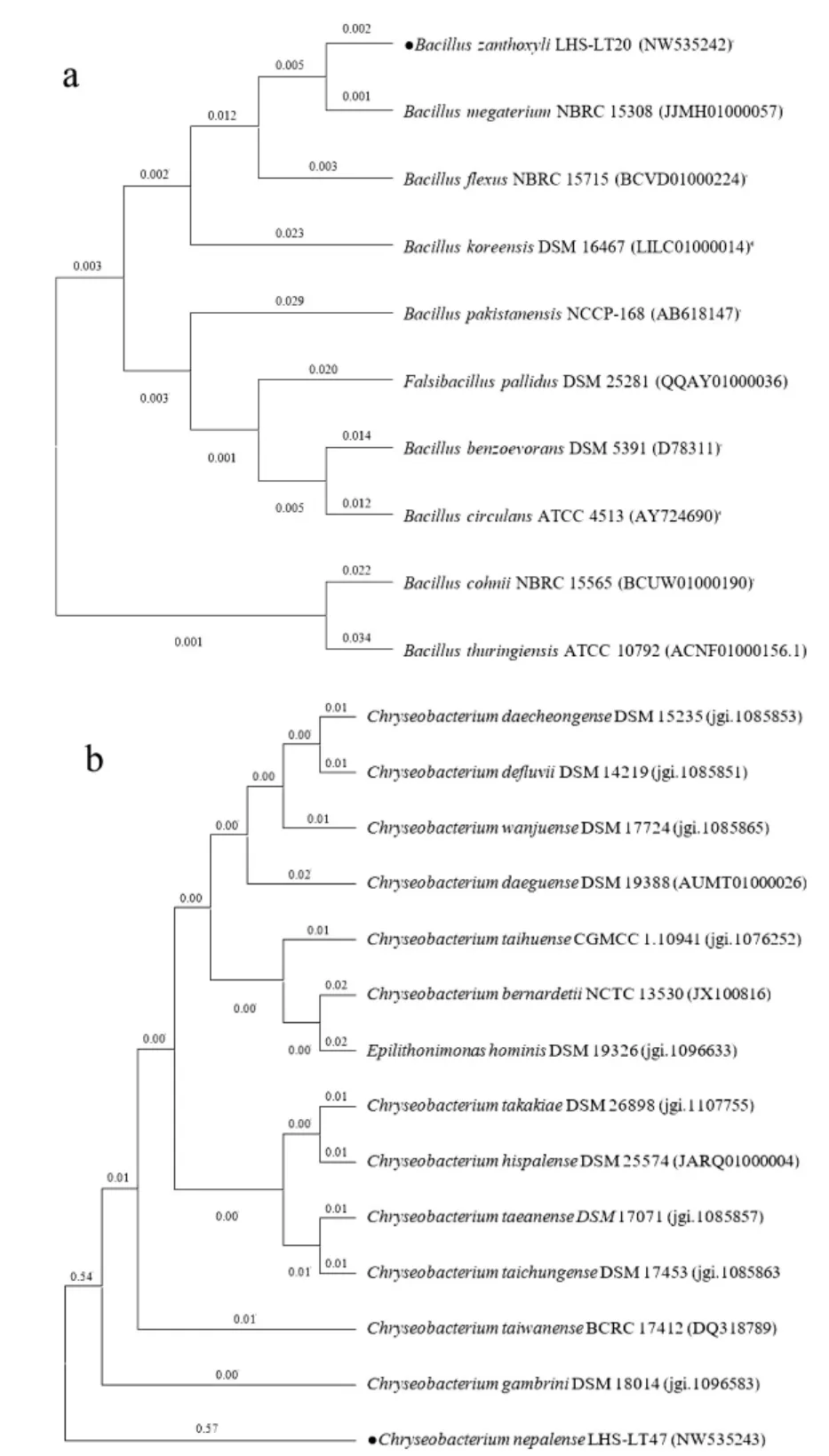
图2 系统发育树(a:B.zanthoxyli LHS-LT20 的系统发育树;b:C.nepalense LHS-LT47 的系统发育树)Fig.2 Phylogenetic tree(a:Phylogenetic tree of B.zanthoxyli LHS-LT20;b:Phylogenetic tree of C.nepalense LHS-LT47)
将C.nepalense LHS-LT47 序列进行比对可知,菌株 C.nepalense LHS -LT47 与 Chryseobacterium nepalense C-5-3 相似度最高,为97.95%,登录号为KX129820;同时与Chryseobacterium takakiae DSM 26898(登录号:jgi.1107755)和 Chryseobacterium taiwanense BCRC 17412(登录号:DQ318789)的相似度较高,分别为96.6%和96.44%。下载同源性较高标准株序列共16 条,采用邻接法构建系统发育树。由图2b 可知,C.nepalense LHS-LT47 与金黄杆菌属和Epilithonimonas 属的亲缘关系较高。
2.2 细菌生长的理化因素分析
培养10 h 后,将在不同生长因素培养的菌液移至96 孔板,使用酶标仪于600 nm 下检测菌液的吸光度,下B.zanthoxyli LHS-LT20 的菌液OD600 如图3 所示。B.zanthoxyli LHS-LT20 的菌液 OD600 随盐度和pH 变化先上升后下降,在盐度为7.5 g·L-1和pH 为 7.5 时显著高于其他盐度和 pH(图 3a、c);在温度为30 ℃时菌液的OD600 显著高于其他温度(图3b),有文献报道B.zanthoxyli 1443 最适生长温度为28~32 ℃,最适 pH 为 6.0~7.0,盐度为 0~30 g·L-1,其生长习性与研究成果相似[20]。接种量为1%时OD600 最高。综上,B.zanthoxyli LHS-LT20 在盐度为 7.5 g·L-1,温度为30℃,pH 为7.5,接种量为1%的条件下生长繁殖较快。
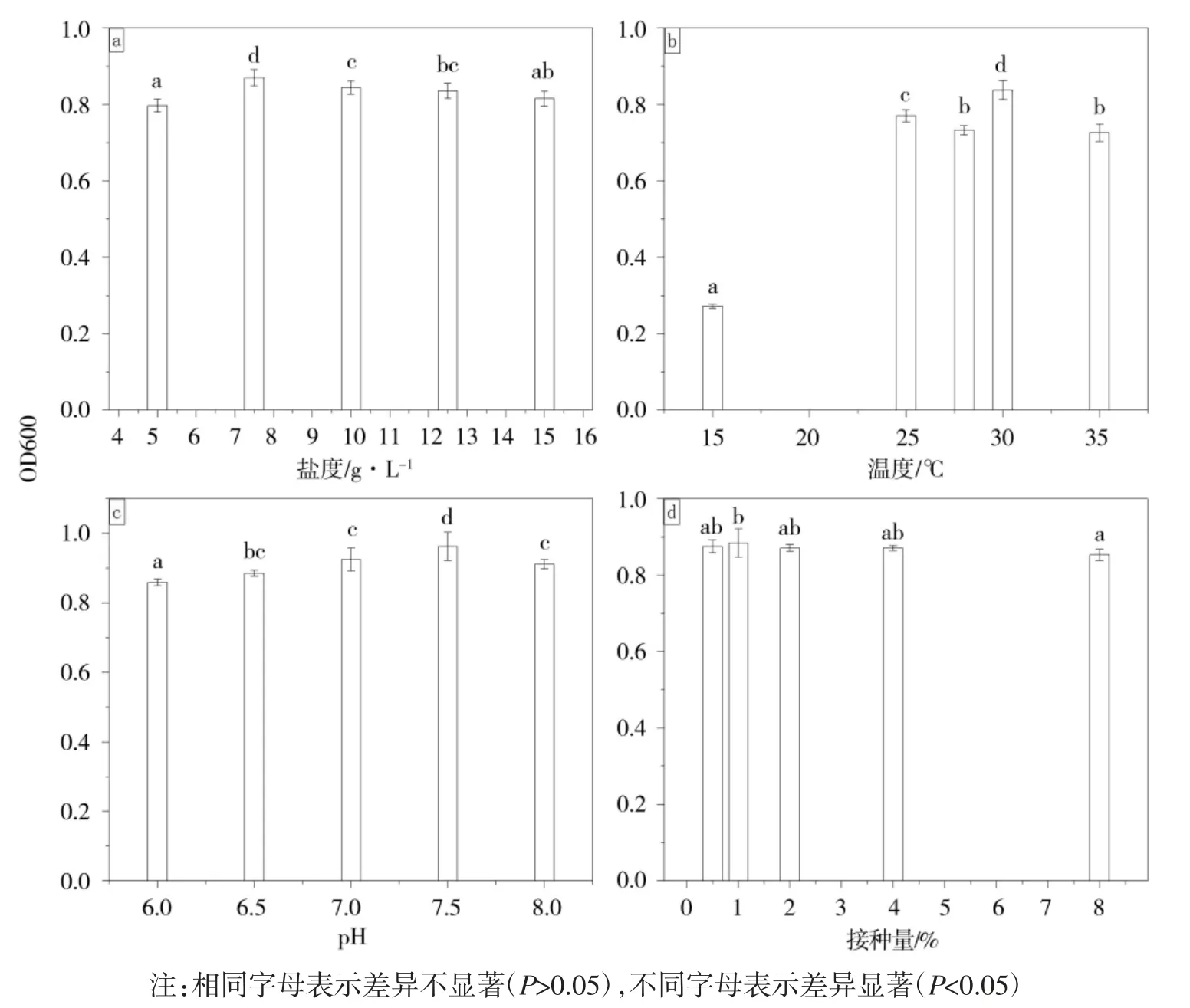
图3 不同因素下B.zanthoxyli LHS-LT20 的生长情况Fig.3 Growth of B.zanthoxyli LHS-LT20 under different factors
培养10 h 后,不同生长因素下C.nepalense LHS-LT47 的 OD600 如图 4 所示。C.nepalense LHSLT47 的 OD600 在盐度为 12.5 g·L-1和 pH 为 7.5 时显著高于其他盐度和 pH(图 4a、c);菌液OD600 在培养温度 35℃时显著高于 25、28、30 ℃时(图 4b);接种量在2%时,菌液OD600 显著高于接种量为0.5%和1%时(图4d)。有研究表明,一株分离自大熊猫兽舍的金黄杆菌Chryseobacterium chengduensis sp.nov.(CCTCC AB2015133)在盐度为0~20 g·L-1,温度为28~30 ℃,pH 为 7.0~8.0 的条件下生长情况较好[21]。综上,C.nepalense LHS-LT47 在盐度为 12.5 g·L-1,温度为35 ℃,pH 为7.5,接种量为2%的条件下生长繁殖较快。
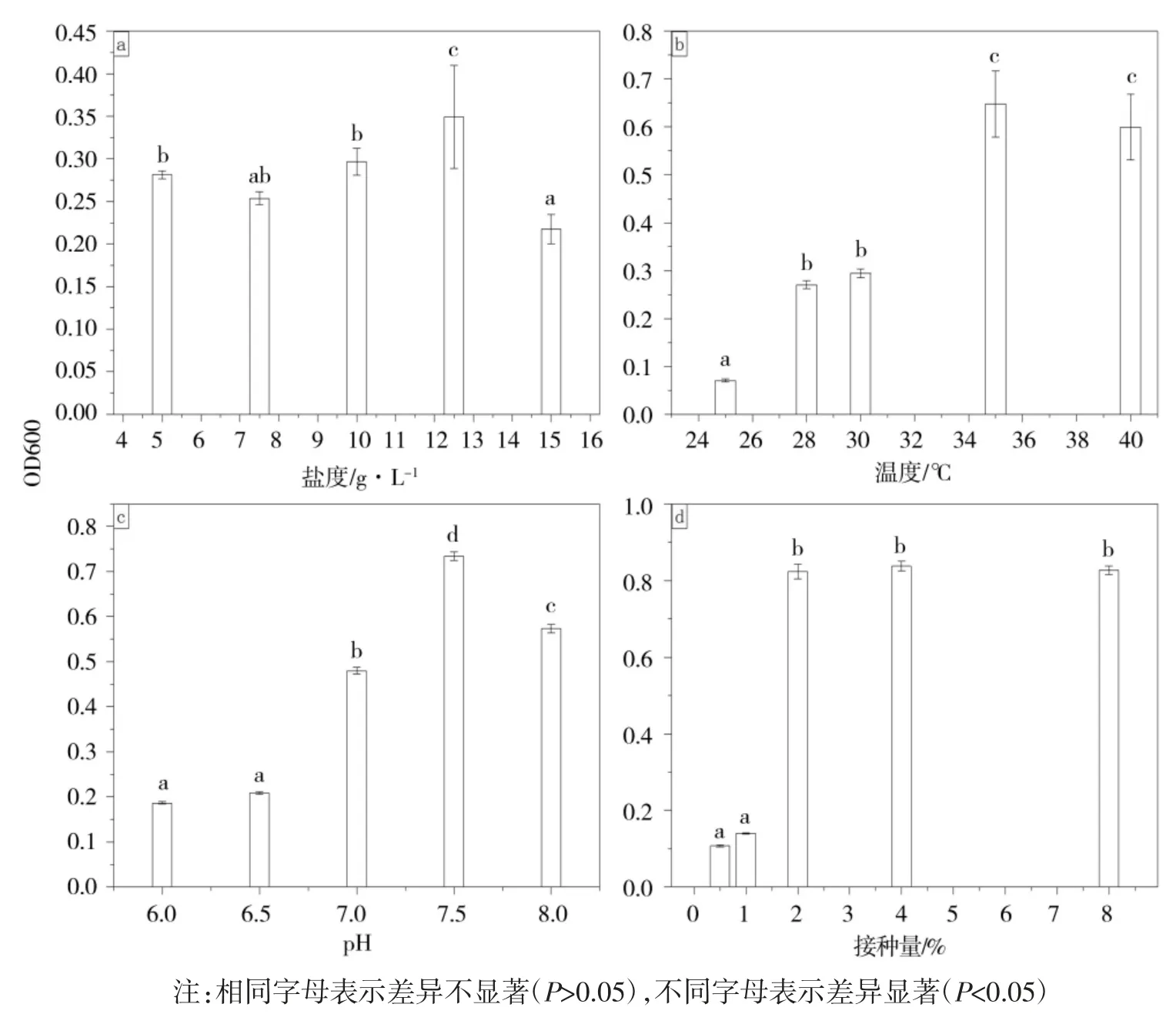
图4 不同因素下的C.nepalense LHS-LT47 的生长情况Fig.4 Growth of C.nepalense LHS-LT47 under different factors
2.3 两株细菌风化能力研究
以火山石中溶出的Fe 体现火山石风化程度,即培养基中Fe 浓度表示火山石的风化程度。将不同风化时间菌液的A510带入标准方程(y=0.191 2 x+0.016 25,R2=0.999 5)计算得到菌液的Fe 浓度。统计分析后得到风化过程中Fe 浓度变化如图4 所示。结果表明,在风化过程中试验组培养基中Fe 浓度明显高于对照组,B.zanthoxyli LHS-LT20、C.nepalense LHS-LT47均具有一定风化能力。其中,B.zanthoxyli LHS-LT20的初始风化速度略高于对照组,在3 d 时Fe 浓度达到0.18 mg·L-1;在3~6 d 火山石风化速度变化不显著;在 6~12 d 风化速度显著提升,12~15 d 火山石风化速度趋于平缓且不显著,15 d 时Fe 浓度达到0.34 mg·L-1,整个风化过程中培养基的 Fe 浓度呈“S”趋势Fe 浓度变化不显著。C.nepalense LHS-LT47 在3 d 时菌液中的 Fe 浓度达到了 0.62 mg·L-1;3~6 d 火山石风化速度逐渐降低;在6~12 d 时,Fe 浓度仅从0.74 mg·L-1上升至 0.80 mg·L-1,且 Fe 浓度变化不显著;12 d 后 Fe 浓度开始剧烈上升,15 d 时 Fe 浓度高达1.24 mg·L-1,其在 15 d 时明显高于 B.zanthoxyli LHS-LT20 和对照组。
3 讨论
火山极端环境中的火山石风化细菌种类及含量较低,但研究利用平板分离纯化和16S rRNA 测序鉴定鉴定技术出两株细菌属于芽孢杆菌和金黄杆菌属,经EZ BioCloud 中参考菌株的同源性比对和系统进化树分析确定了两株细菌的种属。B.zanthoxyli LHS-LT20 属于芽孢杆菌属,与Bacillus megaterium NBRC 15308 同源性较高(图 2a);B.zanthoxyli LHSLT20 的生长繁殖对盐度变化不敏感(图3a),对温度、pH 变化较敏感(图 3b、c),与同属的 B.zanthoxyli 1443 生长习性相似。C.nepalense LHS-LT47 为金黄杆菌属,与Chryseobacterium takakiae DSM 26898 同源性较高(图2b);C.nepalense LHS-LT47 的生长繁殖对盐度、温度、pH 变化敏感(图 4a、b、c),生长习性与同属的Chryseobacterium chengduensis sp.nov(.保藏号:CCTCC AB2015133)相似。接种量对两株菌生长发育影响较小(图3d、图4d)。
研究发现,B.zanthoxyli LHS-LT20 的初始风化速度略高于对照组,在9 d 后风化速度开始加快,15 d后Fe 浓度达到对照组1.8 倍以上(图5)。有研究表明,Bacillus cereus、Bacillus aryabhattai、Bacillus aryabhattai、Bacillus anthracis、Bacillus megaterium、Bacillus thuringiensis、Bacillus amyloliquefaciens、Bacillus subtilis、Bacillus aerophilus、Bacillus tequilensis、Bacillus mucilaginosus 等[22-24]芽孢杆菌对钾质粗面岩、硅酸盐、富钾页岩、钾长石等岩石具有一定的生物风化作用。从钾质粗面岩中分离得到的一些Bacillus megaterium 具有解磷的能力,可以风化煤矸石、磷矿石等岩石[22,25]。B.zanthoxyli LHS-LT20 与 Bacillus megaterium 同源性极高,风化能力相似,二者可能具有相同的风化相关基因以及相同的风化机制。C.nepalense LHS-LT47 的初始风化速度较快,在6~12 d 时风化速度趋于平缓,在12 d 后风化速度显著提升(图5)。推测0~3 d 菌体大量增殖,加快了火山石的风化速度,加速了火山石中Fe 的溶出;在3~12 d,C.nepalense LHS-LT47 大量增殖达到稳定期,培养基中营养成分大量消耗,菌体及其代谢物大量附着在火山石表面,减慢了火山石的风化速度。在12 d 后,经多日风化作用火山石表面发生裂解,大大增加接触面积,从而导致火山石风化加剧。综上所述,B.zanthoxyli LHS-LT20 和 C.nepalense LHS-LT47均具有一定风化能力。15 d 时C.nepalense LHS-LT47培养基中Fe 浓度约为B.zanthoxyli LHS-LT20 培养基中Fe 浓度的3.7 倍,是对照组Fe 浓度的6.7 倍。有研究表明,金黄杆菌(保藏号:CGMCC 17564)对铬、锰、铜等重金属有吸附作用(一种具有重金属抗性的金黄杆菌及其应用),金黄杆菌(保藏号:CCTCC M2017810)对煤矸石中的钾、磷、硅、钙、硫等元素有较好解离作用,煤矸石中的钾、硅、钙等成分与老黑山钾质玄武岩的组成相似,推测C.nepalense LHS-LT47 对火山石的较快的风化作用与金黄杆菌的解钾、解硅、解钙能力有关,其对火山石风化能力及风化机制有待进一步研究。
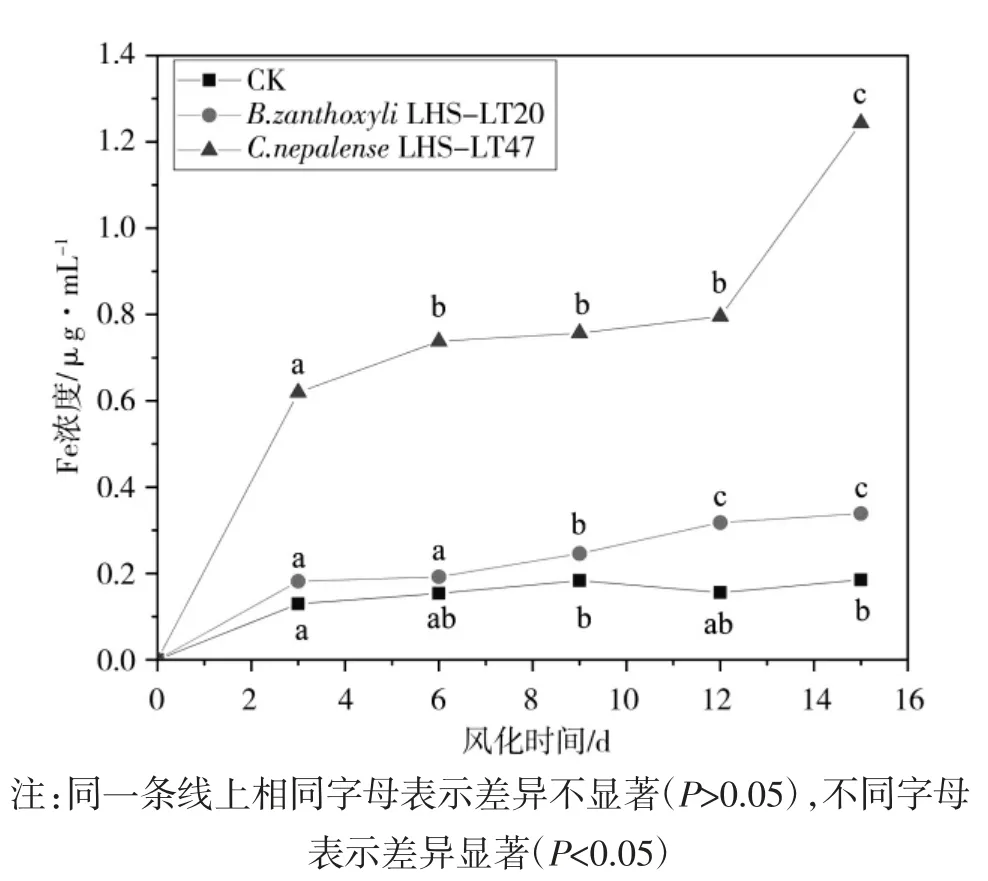
图5 风化过程中LB 培养基中Fe 浓度Fig.5 Iron concentration in LB medium during weathering
4 结论
(1)研究通过平板分离和16S rRNA 基因测序技术鉴定出一株芽孢杆菌和一株金黄杆菌,并通过系统发育树分析出B.zanthoxyli LHS-LT20、C.nepalense LHS-LT47 和其他具有风化能力的同属细菌的亲缘性和遗传进化规律。
(2)风化能力测定结果显示B.zanthoxyli LHSLT20、C.nepalense LHS-LT47 均具有一定的风化能力。C.nepalense LHS-LT47 的风化能力明显高于B.zanthoxyli LHS-LT20,且 C.nepalense LHS-LT47 在15 d 时仍具有较高的风化能力,培养基中Fe 溶出量是对照组的6.7 倍。
