亚精胺参与杂草对联吡啶类除草剂抗性机制的研究进展
2022-05-06沈雪峰
闫 甜,沈雪峰
(1.广东海洋大学教育信息中心,广东湛江 524088; 2.广东海洋大学滨海农业学院,广东湛江 524088)
农田草害是农业生产的主要生物灾害之一。然而,在长期使用化学除草剂的作用下,目前已报道苏门白酒草等30多种对联吡啶类(如百草枯等)除草剂产生了抗药性生物型杂草。抗药性生物型杂草群体的危害日益严重,给当地农业生产和杂草防控造成了巨大的负担[1]。亚精胺广泛分布于生物体中,参与多种细胞活动,在增强植物抗性方面发挥着重要作用。因此,本文通过探讨亚精胺与联吡啶类除草剂的相互关系,分析多胺及其转运体与联吡啶类除草剂的相互关系,揭示亚精胺是联吡啶类除草剂抗性研究的一个重要方向,为进一步明确杂草对联吡啶类除草剂抗性机制及综合治理提供参考。
1 亚精胺
亚精胺(spermidine,Spd),别称精眯,是由腐胺和腺苷甲硫氨酸生物合成的一种多胺。其化学名称为N-(3-氨基丙基)-1,4-丁二胺,化学式为C7H22N3。它广泛分布于生物体中,参与多种细胞活动过程,包括转录、RNA修饰、翻译、膜的稳定性以及调节细胞信号传导等[2],还控制着各种阳离子通道的活性[3],与植物生长发育密切相关,可以促进植物生长发育,延缓衰老,提高抗逆性[4-5]。
1.1 生物合成与分解代谢
多胺(polyamines,PAs)是生物代谢过程中产生的一类具有生物活性的低分子脂肪族含氮碱[6],除了亚精胺外,还包括腐胺(putrescine,Put)、精胺(spermine,Spm)、鲱精胺(agmatine,Agm)等,另外还有降精胺(norspermine,Nspm)、降亚精胺(norspermidine,Nspd)、高精胺(highspermine,Hspm)、高亚精胺(homospermidine,Hspd)和热精胺(thermospermine,Tspm)等稀有多胺[7]。它们不仅参与了植物的各种生长发育过程,还与其衰老及抗逆性都有密切关系[8-9]。
亚精胺是由腐胺在亚精胺合成酶(spermidine syathase,SPDS)的催化下得到的,可经精胺合成酶(spermine synthase,SPMS)催化生成精胺,也可经热精胺合成酶(ACL5)催化生成热精胺[7]。多胺氧化酶(polyamine oxidase,PAO)和二胺氧化酶(diamine oxidase,DAO)的氧化作用可以实现多胺的分解代谢。其中,PAO在单子叶植物中含量较高,而DAO在双子叶植物中含量较高[8]。PAO有多个家族,它们可以氧化多胺生成代谢终产物,也可催化多胺合成的逆反应。小麦PAO可以催化亚精胺和精胺氧化分解,分别生成 4-氨基正丁醛或3-氨丙基-4-氨基正丁醛,同时生成1,3-丙二胺和H2O2[10]。拟南芥PAO1和PAO4,类似于哺乳动物精胺氧化酶(spermine oxidase,SMO),催化精胺生成亚精胺,拟南芥PAO3可以催化精胺生成亚精胺,再生成腐胺。
1.2 在植物体内的作用
1.2.1 保护细胞膜 多胺可以和膜蛋白结合,从而保持细胞膜的完整及稳定,此外还具有平衡细胞分子组分和结构的功能。研究显示,喷施外源亚精胺后,玉米幼苗的细胞膜流动性降低,抑制水分胁迫下膜透性增加,阻止细胞内物质的渗透[11];在谷氨酰胺酶的作用下可以结合到红细胞膜蛋白中谷氨酸残基的羧基上,磷脂分子与蛋白分子发生交联,有稳定质膜结构的作用。
1.2.2 清除活性氧自由基 植物在长期的生长进化过程中形成了一整套非常高效的抗氧化系统来保护细胞,包括酶促反映系统和非酶促反映系统,负责清除植物体内的活性氧,使生物体中活性氧的产生和清除处于动态平衡中,但当植物受到外在条件胁迫时,系统清除活性氧的能力减弱,所以活性氧的动态平衡就会破坏,植物体内活性氧积累,使细胞膜质过氧化,膜功能受损,导致植物无法正常生长。
研究显示,外源亚精胺对环境胁迫下的植物具有保护作用,有助于提高植物对多种胁迫的耐受力,亚精胺与植物逆境胁迫抗性的关系最为密切[12]。外源亚精胺能减轻各种胁迫对植物的伤害,主要是因为亚精胺能够增强植物体内抗氧酶的活性,清除植物体内过多的自由基。外源亚精胺具有增强黄果柑果实抗氧化保护系统的能力,通过调控黄果柑果实抗氧化酶活性,来提高植株的防御能力[13];能够降低NaCl胁迫下黄瓜幼苗的活性氧、丙二醛(malonic dialdehyde,MDA)和过氧化氢的含量[14],增强过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的活性,来降低NaCl对植株的伤害[15];也可延缓光下玉米离体叶片衰老过程中CAT、POD、SOD活性下降,阻止MDA的累积,表明亚精胺延缓衰老与其维持消除自由基的能力有关。此外,亚精胺还可阻止可溶性蛋白和叶绿素的降解。
1.2.3 对胚胎发育的促进作用 亚精胺是细胞生长、分化和死亡的关键性调节者,同时还是DNA、RNA和生物膜的稳定因子,还可以作为抗氧化剂、营养素以及第二信使[16-17]。亚精胺是由亚精胺合成酶(SPDS)催化腐胺生成的,拟南芥中有2个亚精胺合成酶基因,当这2个基因中任何一个发生突变后植物可以正常生长,但是当这2个基因同时发生突变时会导致胚胎死亡,说明亚精胺合成酶在植物体胚胎发育中起着重要作用。研究表明,当把亚精胺合成酶基因转入到作物体内可使其亚精胺含量升高,使植物抗胁迫能力提高[18]。
1.2.4 与生物大分子作用 亚精胺可以调节复制、转录、翻译过程,通过亚氨基和氨基与DNA双螺旋上的磷酸基团结合,中和DNA分子中磷酸基团的负电荷,还可以提高DNA分子对酶和热的抵抗力,稳定DNA的二级结构。
2 联吡啶类除草剂
2.1 联吡啶类除草剂性质
联吡啶类化合物作为除草剂始于20世纪50年代中期,属于非选择性触杀性除草剂,其代表性产品为敌草快、百草枯[19]。联吡啶类除草剂是 PSⅠ 抑制剂,它们进入植物细胞后,截断PSⅠ及NADH2与NADPH2氧化的电子,而其本身的阳离子在拦截电子后被还原成自由基,在氧的参与下形成过氧化物,可使生物膜中的未饱和脂肪酸产生过氧化作用,最后造成细胞迅速死亡[20]。这类化合物的化学结构与其除草剂活性有关,联结2个氮原子的C为2个时,即2,2′-联吡啶的活性最高;C链为“3,4-”时,活性显著下降,3,3′-甲基取代时,化合物无活性。这类除草剂在植物体内通过电子还原产生游离基,然后进行氧化反应产生过氧化物,从而对植物产生毒害来发挥它的作用,在阴天黑暗或缺氧环境下其活性显著下降,联吡啶类除草剂对光合作用的抑制作用是通过分流光合电子传递链的电子和抑制光合磷酸化2种途径实现的。
2.2 联吡啶类除草剂的田间生物行为
联吡啶类除草剂对阔叶杂草有很强的防治清除能力,用在作物播种前后,出苗前灭杀已长出的杂草,或者在作物苗长大后定向喷施。有些联吡啶类除草剂如敌草快是一种接触性干燥剂,可以用作催枯剂和种子干燥剂。联吡啶类除草剂会受天气条件影响,但与其他除草剂相比,联吡啶类除草剂对天气条件的影响不是很敏感。
2.3 杂草对联吡啶类除草剂的抗性遗传
长期大面积使用除草剂会使杂草对除草剂产生抗性,如今已有大量关于抗性遗传事例的报道。用敌草快处理抗敌草快的南非金盏草(Arctothecacalendula)种群和其敏感种群的杂交F1代,用百草枯处理大麦草抗性和敏感种群的杂交F1代,F1代都仅表现出中等抗性,它们的F2代分离比都和预测的分离比1 ∶2 ∶1(抗性 ∶中抗 ∶敏感)相吻合,南非金盏草种群F1代与敏感种群回交的分离比为1 ∶1(中抗 ∶敏感)。这些结果证明,有1个不完全显性基因控制着这2种杂草对联吡啶类除草剂的抗性。这种显性或半显性抗性存在抗性频率迅速增加的潜能和风险[21]。2009年Wakelin等的研究[22]也证实了这一观点。同种或同属不同种百草枯的抗性和敏感型植株间可进行雌雄同株或异株的杂交,随花粉的移动传播抗性等位基因,增加除草剂抗性的进化效率[23]。
3 亚精胺对联吡啶类除草剂靶标杂草抗药性的作用机制
3.1 亚精胺与联吡啶类除草剂的相互关系
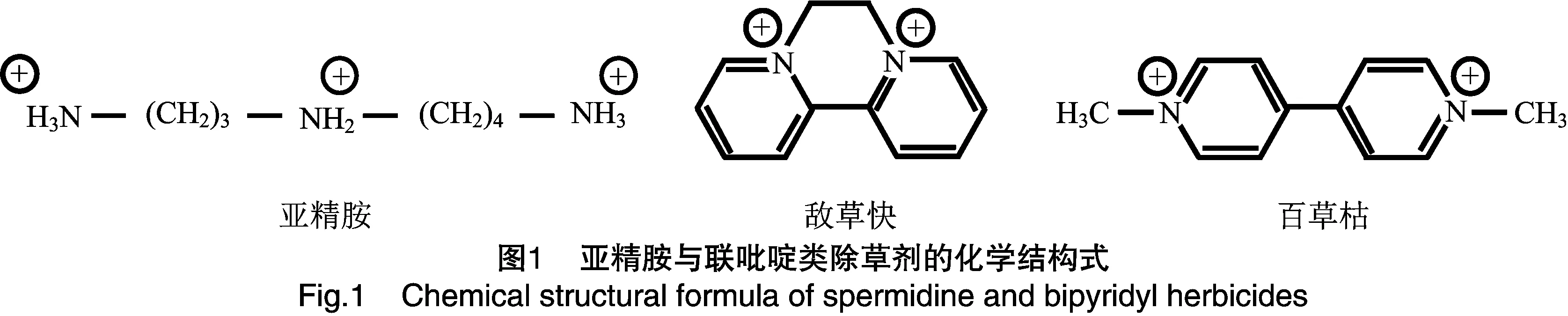
亚精胺与联吡啶类化合物在化学性质上具有一定的相似性,其中敌草快和百草枯是季铵盐类化合物,亚精胺为三胺盐类化合物,同时亚精胺与联吡啶类化合物具有非极性结构,空间位阻小,氮原子周围带最大正电荷等特征(图1)。由于亚精胺转运体对底物分子的结构要求不严格,使得联吡啶类化合物能够与其共用同一转运体[24-25]。所以,当植物体内存在大量联吡啶类化合物时,在细胞膜上可与亚精胺竞争转运体蛋白载体的结合位点而被细胞摄取,而在施加外源亚精胺条件下,亚精胺又可以竞争抑制联吡啶类化合物的吸收位点[26]。
3.2 亚精胺对联吡啶类除草剂毒性的缓解作用
亚精胺能够在一定程度上降低百草枯对植物的毒性,缓解百草枯产生的药害。经百草枯处理可以增加水稻(OryzasativaL.)体内腐胺的浓度,降低亚精胺和精胺的浓度;而经亚精胺黑暗处理离体水稻叶片6 h后,水稻体内亚精胺含量增加了10倍,使25 μmol/L百草枯水剂的伤害作用降低了30%,表明亚精胺能够降低百草枯在水稻叶片和细胞中转运,降低百草枯的毒性[27]。Kim等用1 mmol/L亚精胺预处理萝卜(RaphanussativusL.)子叶,发现其可以显著提高萝卜对50 μmol/L百草枯水剂的耐受能力[28]。用100 μmol/L百草枯水剂处理向日葵(HelianthusannuusL.)叶盘,发现百草枯可以抑制腐胺合成酶——精氨酸脱羧酶(arginase decarboxylase,ADC)和鸟氨酸脱羧酶(ornithine decarboxylase,ODC)的活性,降低向日葵叶盘中腐胺、精胺和亚精胺的含量;而外施亚精胺能够减轻百草枯对植株的伤害,恢复百草枯对SOD活性的影响[29]。Soar等通过测定抗药性和敏感生物型赛金盏(ArctothecacalendulaL.)体内多胺的含量,发现在抗药性生物型赛金盏体内腐胺和亚精胺的含量高于敏感生物型植株,而施用外源亚精胺处理敏感生物型赛金盏能有效降低植株体内百草枯的含量,增强植株对百草枯的抗性[30]。最新的研究也表明,植物体内亚精胺转运体在百草枯抗性产生过程中发挥着重要作用[31]。
3.3 多胺及其转运体与联吡啶类除草剂的相互关系
早期的研究显示,腐胺、精胺等多胺类物质能够通过细胞膜上转运体的作用,竞争性抑制植物对联吡啶类除草剂的吸收,减轻联吡啶类除草剂对细胞的损害,后来研究发现,这类转运体的天然底物即是多胺类物质,故这类转运体又被称为多胺转运体[24-25]。通过对玉米(ZeamaysL.)幼苗根部对百草枯、多胺[腐胺、尸胺(cadaverine,Cad)和精胺]吸收量的测定,发现百草枯和腐胺的浓度依赖性动力学是相似的,其动力学曲线显示,在低浓度下,玉米幼苗根部对百草枯和腐胺的吸收均呈直线上升状态,直至饱和,竞争试验结果表明,在饱和浓度下的玉米根部和幼苗中,腐胺可能通过竞争而抑制百草枯的吸收[32]。Jung等的研究结果表明,在原核生物如大肠杆菌中,多胺能够降低百草枯的伤害作用[33]。Kashiwagi等的研究表明,微生物中多胺转运蛋白是多胺特异性或多胺优先性转运蛋白[34]。大肠杆菌的多胺转运系统包括2个ATP结合盒(ATP-binding cassette,ABC)转运蛋白,并且这2个蛋白具有对腐胺和亚精胺特异的选择性[35]。
转运体是生物体内一类跨膜蛋白,主要参与离子以及一些小分子的吸收、转运和隔离。在原核和真核生物细胞的原生质体、液泡和线粒体中,都存在着大量转运体,如PrqA、PotE、EmrE、MvrA和CAT4等,它们以能量转运的方式主动转运并除去百草枯及大多数的其他毒性分子,以减少作用于靶标的药物浓度[6,26]。百草枯能被腐胺和氨基酸阳离子转运体所运输,多胺转运体在大肠杆菌和酵母等低等生物中对百草枯的抗性具有一定的作用,就其结构和功能而言,这些转运体都能够参与百草枯的转运、隔离,在杂草对百草枯抗性机制中起着重要作用[19]。郭书巧等从被百草枯污染的环境中分离得到抗百草枯的细菌——硝基还原假单胞菌(Pseudomonasnitroreducens)和人苍白杆菌(Ochrobactrumanthropi),并分别从中克隆了PnPQR和OaPQR基因,发现它们同属于转运体家族中主要的易化超家族(major facilitator superfamily,MFS)成员[36]。进一步对其进行原核表达和植物转基因研究,结果表明,二者均可使大肠杆菌对百草枯产生抗性,同时也能赋予T0代转基因烟草对百草枯的抗性[37]。Xi等通过筛选得到了1株拟南芥的抗性突变体pqt24-1,其T-DNA插入在基因Atlg66950第13个外显子中,该基因编码ATPDR11蛋白,属于ABC转运蛋白家族,该转运蛋白负责质膜中约50%百草枯的吸收,敲除该转运蛋白的基因则可降低细胞对百草枯的吸收量,从而使得相应的突变体具有较强的耐百草枯表型[38]。Fujita等发现RMV1的T-DNA突变体幼苗吸收百草枯速率降低了70%,这使突变体对百草枯的抗性提升了2~4倍,而野生型转入RMV1后对百草枯极度敏感[39]。最近又有2个与百草枯转运相关的拟南芥基因被报道,分别是At1g66950和At1g13830。其中,At1g66950编码的AtPDR11蛋白是ATP结合盒转运体超家族的一员,定位于细胞膜上。At1g66950的T-DNA插入突变体幼苗对百草枯的吸收量比对照减少了一半,导致其对百草枯的抗性提升了近2倍,而且At1g66950的转录水平受到百草枯的强烈诱导,这都表明AtPDR11可能是百草枯转运体[38]。另有报道指出,拟南芥抗百草枯突变体par1的At1g31830基因发生突变后,百草枯从体外进入体内的速率与野生型相比并无明显改变,但突变体叶绿体中百草枯积累量明显减少,而且At1g31830编码的蛋白亚细胞定位于高尔基体上,这说明其参与了将百草枯在细胞内转运至叶绿体的过程;在水稻中鉴定出了At1g31830同源基因——OsPAR1,超表达该基因会引起水稻对百草枯的超敏性,而RNAi干扰OsPAR1基因表达的水稻转基因株系对百草枯产生了抗性[40]。此外,在细菌中也发现了百草枯转运相关基因,有报道指出人苍白杆菌中存在1个编码膜转运体蛋白的抗百草枯基因PqrA,将其转入烟草中,可使转基因烟草对百草枯产生抗性[41]。
4 展望
由于植物对联吡啶类除草剂的抗性是受多因素调控的复杂过程,其抗性作用机制存在几种假说,而具体的作用机制尚不十分清楚。近年来,大量试验将百草枯的抗性机制集中到多胺及其转运体上,已有数据显示百草枯的进入和亚精胺的变化存在相关性(数据尚未发表),极有可能亚精胺和百草枯通过争夺电子而竞争叶绿体上的位点,以及亚精胺转运体参与了百草枯的转运,但这也是假设。因此,亚精胺及其转运体对百草枯的运输机制、抗性作用以及生理生化功能、代谢差异、基因克隆与表达、抗性材料的遗传转化等将是今后联吡啶类除草剂抗性研究的重要领域。
