霉鱼生产过程中品质特性变化研究
2022-05-06刘旭坤
刘旭坤,赵 利*
(1.江西科技师范大学生命科学学院,330013,南昌;2.江西省水产加工及安全控制研究中心,330013,南昌)
0 引言
传统自然发酵霉鱼风味独特、咸香适口,极具地方特色,是江西吉安抚州一带的特色美食。霉鱼的主要原料是鳙鱼块、辣椒粉和盐,经过晾干、腌制,在室温下厌氧发酵直到形成典型的香味[1-4]。加工过程中霉鱼的品质变化涉及肌肉组织中多种物质的氧化、合成、降解、相互作用等。蛋白质作为原料的主要化学成分,在加工中通过水解、氧化、产物互作等多种途径影响发酵和成熟过程中产品的风味、色泽和质构[3]。
通常在发酵10 d左右即可得到具有传统风味的霉鱼产品,然后一直处于油浸密封状态下继续发酵保藏,食用周期可至3个月甚至半年之久[4-5]。霉鱼现多由作坊加工生产,还未出现完善的企业标准。霉鱼在发酵保藏期间,可能会发生质地、风味品质改变,导致出现安全性问题。评价其品质和安全性显得尤为重要。本研究以不同加工阶段的霉鱼为研究对象,通过微生物、物理、化学以及感官4种评价方法以综合评价霉鱼在不同加工阶段的品质变化,并对蛋白质在加工过程中的结构间的变化及这些变化对品质的影响进行了深入研究,为寻找合理的发酵保藏时段及探究霉鱼的品质变化机理提供一定的理论依据,为霉鱼的安全食用及工业化生产提供基础研究数据。
1 材料与方法
1.1 材料与试剂
鲜鳙鱼:购自江西南昌乐买佳超市;三氯乙酸;乙醇;甲醛;三氯甲烷;亚铁氰化钾;硫氰酸铵;氯化亚铁;乙二胺四乙酸二钠;硫代巴比妥酸:化学试剂均为分析纯;平板计数培养基(PCA);孟加拉红琼脂;结晶紫中性红胆盐葡萄糖琼脂(VRGBA)。
1.2 仪器与设备
CT3-4500质构仪:美国Brookfield公司;Color i7色差仪:美国Xrite公司;TGL-16G高速离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 霉鱼制备与样品处理 鲜鳙鱼洗净,去鳞、内脏,在20 ℃条件下悬挂晾制2 d,除去部分水分,直至鱼皮皱缩,鱼肉水分含量达到60%,切成2 cm大小的鱼块,加入2%姜丝、5%酒精含量50%的白酒,4 ℃下腌制1 d,样品均匀沾裹3%盐和3%辣椒粉混合物,放置于玻璃罐中,加入菜籽油,油浸样品,放置于室温(28~32 ℃)中发酵,分别在发酵15 d、30 d、45 d、60 d、75 d取样。
1.3.2 实验方法
1)基本营养成分测定。蛋白质含量采用《GB5009.5—2010》凯氏定氮法测定;脂肪含量参照《GB 5009.6—2016》索氏抽提法测定;水分参照《GB5009.3—2010》中直接干燥法测定。
2)色泽测定。使用分光测色仪测定鱼块的亮度值L*、红绿值a*以及蓝黄值b*。其中L*为亮度值,L*值越大则样品光泽度越好,a*值越大样品越红,反之越绿,b*值越大则样品越黄,反之越蓝。
3)ATP质构分析。肉块切成厚度1.5 cm进行质构分析[6]。质构仪选择ATP模式测定,探头选择TA25/1000,压缩距离5 mm,数据频率50点/s,循环2次,每个样品测3组平行。
4)pH值的测定。采用《GB/T9695.5—2008》方法测定。
5)TVB-N值测定。采用《GB 5009.228—2016》方法测定。
6)亚硝酸盐测定。采用《GB 5009.33—2010》方法测定。
7)POV值的测定。参考Wang方法[7],有所改动。取2.00 g样品加入15 mL三氯甲烷甲醇混合液(2:1)和3 mL 0.5%NaCl均质1 min,震荡5 min,后以3 000 r/min离心5 min。取下层清液5 mL加入5 mL三氯甲烷甲醇混合液,一滴硫氰酸铵一滴氯化亚铁,反应5 min后于500 nm处测吸光度(A500)。
8)TBARS值的测定。取10.00 g样品加入50 mL 7.5%三氯乙酸溶液(内含有0.1%EDTA),分散机分散后震荡30 min,双层滤纸过滤。取5 mL滤液加入5 mL 0.02 mol/L的TBA溶液,90 ℃反应40 min,取出室温下冷却,加入5 mL三氯甲烷,涡旋1 min静置分层。取上层液体分别于波长532 nm(A532)以及600 nm(A600)处测吸光度,计算TBARS值[8]。
式中:155为丙二醛摩尔吸光系数,72.6为其相对分子质量。
9)微生物测定。菌落总数使用《GB 4789.41—2016》方法测定。肠杆菌使用《GB 4789.41—2016》方法测定。
10)肌原纤维蛋白及肌浆蛋白的提取。称量样品3.0 g,加入10倍体积的缓冲液A(0.02 mol/L磷酸缓冲溶液,pH6.5)在分散机1 500 r/min条件下分散10 min,4 ℃、10 000 r/min条件下离心15 min,上清液在15 000 r/min离心5 min,上清液为肌浆蛋白。取沉淀加入缓冲溶液B(0.1 mol/L pH6.5磷酸缓冲溶液,其中含 0.7 mol/L KI)分散机1 500 r/min条件下分散10 min,13 000 r/min离心15 min,上清液为肌原纤维蛋白,以双缩脲法测蛋白浓度[9]。
11)蛋白氧化指标的测定。1 mL蛋白溶液中加入1 mL 10 mmol/L DNPH(以2 mol/L HCl溶解),涡旋混匀,溶液37 ℃下保温1 h,加入1 mL 20%三氯乙酸后涡旋30 s,10 000 r/min离心5 min,沉淀用乙酸乙酯乙醇混合液(溶液体积比1:1)洗至无色,加入3 mL 6 mol/L盐酸胍溶液在37 ℃下保温20 min,沉淀溶解后10 000 r/min离心5 min,上清液在370 nm处测吸光度,计算羰基含量[10]。
1 mL蛋白溶液加入9 mL 0.2 mol/L缓冲溶液(含有8 mol/L尿素,2%SDS,10 gEDTANa2,pH6.8)混匀,取4 mL混合液加入0.4 mol 0.1%DTNB(0.2 mol/L缓冲溶液,pH8.0溶解)涡旋混匀,40 ℃中保温25 min,412 nm处测吸光度,计算巯基含量。
12)感官评价。邀请10位经专业培训的同学,对不同发酵阶段的霉鱼进行感官评价,评价从色泽、气味、质地、滋味(蒸熟)几个方面进行。评分标准如表1所示。

表1 感官评价标准表
1.3.3 数据处理 结果以平均值±标准差表示,使用Origin作图,SPSS22进行单因素方差方分析、相关性分析。P<0.01 表示极显著,P<0.05 表示显著。
2 结果与分析
2.1 不同加工阶段霉鱼基本营养成分变化
由表2可知,样品中水分、蛋白质、脂肪含量在加工过程中变化显著(P<0.05),蛋白质和脂肪在发酵过程中呈下降趋势,说明蛋白质和脂肪在发酵过程中发生了降解,蛋白质降解由鱼体内的内源性蛋白酶以及微生物产生的蛋白酶诱导形成低分子量化合物,如肽、氨基酸、醛、有机酸,从而影响产品的质地和风味。发酵过程中脂解释放的游离脂肪酸经过氧化产生醛和酮,更能促进发酵产品的典型风味形成[2]。水分在干燥和腌制过程中降至63.88%,发酵后有所回升并维持在69%~71%,可能是由于添加的白酒等腌料的水分影响。由于添加了3%的食盐利于水分析出,水分含量下降;pH值下降,鱼肉蛋白发生氧化和降解变化剧烈,使得鱼肉纤维变的紧密;同时,油封密闭环境,水分难以蒸发,发酵过程中水分含量变化较小。

表2 不同加工阶段霉鱼基本成分变化(g/100g湿基)
2.2 物理特性变化与霉鱼品质评价
2.2.1 质构(TPA)特性变化 TPA测试中各项指标可以反映霉鱼的感官品质和蛋白脂肪等主要成分变化。霉鱼在加工过程中质构特性变化见表3,咀嚼性与弹性、内聚性以及硬度有关,咀嚼性的变化是霉鱼品质变化的重要指标之一。在霉鱼各加工阶段,咀嚼性变化显著(P<0.05),在F3阶段达到最高值,分别是R的5.5~6.8倍,可能是由于盐和发酵产酸共同作用使得蛋白变性导致酸凝胶化加剧,形成霉鱼的特征质构。内聚性在腌制阶段降低至0.52可能由于加入腌料破坏了样品内部结合键强度,发酵阶段内聚性增加显著可能由于pH值下降引起的内部结合键强度升高[11-12]。

表3 不同加工阶段霉鱼的质构特性变化
2.2.2 不同加工阶段霉鱼色泽的变化 色泽是影响消费者对产品喜好程度的重要指标之一。霉鱼在不同加工阶段中色泽变化如表4所示,干燥(D)和腌制(S)过程中L*、a*和b*值变化不显著,在发酵过程中均变化显著(P<0.05),色度值变化可能与水分变化有关,随着样品水分含量下降则L*值升高,a*值随之减小,b*值升高[13-14]。此外颜色变化也与脂肪氧化、蛋白氧化相关[15]。

表4 不同加工阶段霉鱼的色差变化
2.3 化学特性变化与霉鱼品质评价
2.3.1 不同加工阶段对霉鱼pH值的影响 由图1可知,pH值整体呈下降趋势,可能由于微生物活动消耗碳源,代谢产物累积,总酸含量升高,F1发酵阶段迅速下降,F2、F3、F4发酵阶段变化不显著,pH下降导致蛋白酸变性和聚集,从而影响霉鱼口感,可能也会影响内源蛋白酶及微生物酶的水解作用,变化不显著可能与所产生的有机酸的缓冲能力有关。发酵后期pH值上升可能与内源性或微生物酶产生的氨等降解产物或挥发性碱化合物的形成有关[16]。

图1 不同加工阶段霉鱼的pH值变化
2.3.2 不同加工阶段霉鱼TVB-N值变化 不同加工阶段霉鱼的TVB-N值变化如图2所示。TVB-N含量在加工过程中呈不断上升趋势,在干燥(D)、腌制(S)阶段变化不显著,发酵阶段变化显著(P<0.05)。在F1阶段,TVB-N值略高于国家TVB-N 的一级淡水鱼鲜度(≤15 mg/100g);继续发酵,TVB-N含量持续上升,F3至F4阶段增长迅速,在F4阶段其含量达34.65 mg/100g,超出国家TVB-N二级鲜度限值(≤25 mg/100g)。在F1、F2和F3阶段TVB-N增长缓慢可能是由于pH值较低,发酵产生的抗菌素中和了一部分TVB-N。如果以欧盟订立的TVB-N在鱼肉中不得高于35 mg/100g标准为参考[17],则霉鱼以发酵方式保藏的可食用时间不超过60 d(F4),但这还需与其它指标结合综合判断。TVB-N值变化趋势与林城杏酸鱼一致[18]。
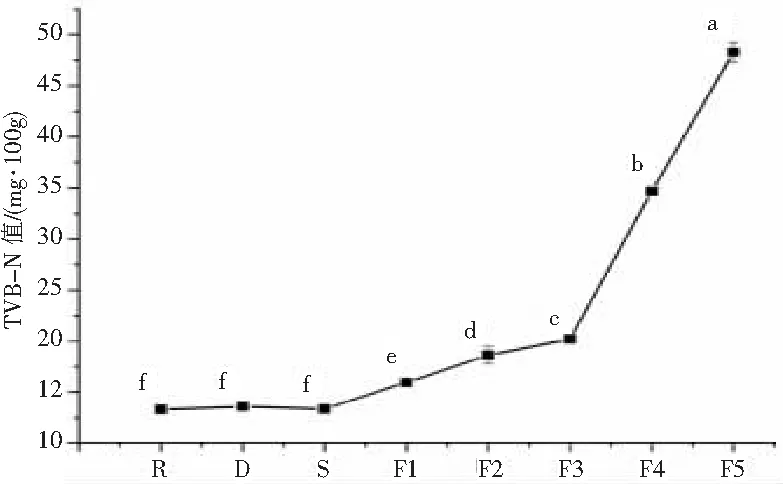
图2 不同加工阶段霉鱼的TVB-N值含量变化
2.3.3 发酵时间对亚硝酸盐含量的影响 发酵过程中霉鱼亚硝酸盐含量的变化见图3,发酵过程中霉鱼亚硝酸盐含量均远低于国标规定的安全标准(≤30 mg/kg), 符合国家食品卫生标准。F1、F2阶段亚硝酸盐增长较为缓慢,可能由于酸性条件下亚硝酸盐易被降解[19-20]。这结果与沈颖莹发酵鱼成品亚硝酸盐含量相似[21]。

图3 不同发酵时段霉鱼亚硝酸盐含量的变化
2.3.4 不同加工阶段对霉鱼脂质氧化程度的影响 脂肪氧化对肉的品质起决定性的影响。脂肪氧化对肉的影响有3个方面。首先是安全性,二级脂质氧化产物对人体有毒性;其次是生物利用度方面,必需脂肪酸的氧化会降低营养价值;最后会影响感官质量,风味和颜色发生了不期望的变化,出现特征劣变气味,颜色变黄[22]。
霉鱼加工过程中脂质氧化情况,以POV和TBARS值表示(图4)。POV值与TBARS值变化趋势基本一致,总体呈上升趋势。POV值通常被认为是初级脂质氧化产物,在加工过程中总体呈上升趋势,干燥样品的POV为0.020 6 mg/kg,与新鲜样品的POV无显著差异(P>0.05)。在腌制阶段(S)时达到第一个峰值即0.226 mg/kg,并在这之后的发酵阶段下降,而在发酵第60 d(F4)时升至0.382 mg/kg,其原因可能是初级氧化产物进一步氧化形成低分子形式的二级脂质氧化产物,如醛或酮等,同时氧化产物又不断累积,因此POV值在发酵阶段又重新升高[23]。
TBARS值是反映相对极性二级反应产物浓度的良好指标,特别是醛,是肉类产生异味的主要原因[24]。TBARS值在S阶段升至峰值达到1.203 7 mg/100g后又迅速下降,可能是形成的部分丙二醛与蛋白质水解的产物游离氨基酸发生反应或者醛类物质进一步氧化成有机醇和羧酸等小分子物质造成的。在发酵过程中TBARS值整体呈上升趋势,F2至F5阶段TBA值增长变缓,可能是因为微生物在该发酵阶段生长过程中产生较多过氧化氢酶,从而抑制肉制品中脂肪变质,或醛类物质自身或与其他化合物发生了反应,所以TBARS值增长趋势变缓[25-26]。该研究结果与赵珠莲等研究发现发酵肉制品脂肪氧化趋势相同[27]。

图4 不同加工阶段霉鱼的TBARS值、POV值变化
2.4 不同加工阶段霉鱼中微生物的变化
发酵过程中微生物的存在有助于蛋白质的降解以及风味和香气的形成[28]。以鳙鱼为原料的初始菌落总数为5.34 lgCFU/g,在干燥期间空气中的菌落附着,菌落总数升高至6.59 lgCFU/g。经过腌制处理后略有下降(P<0.05)。室温发酵时,菌落总数持续升高(P>0.05),发酵15 d后,菌落总数达到7.49 lgCFU/g,后开始出现小幅下降,但在F4到F5阶段后其含量又有所回升。在加工过程中,盐通过抑制腐败和致病微生物的生长,在保存中起着关键作用。腌制和干燥过程导致鱼肉的水分含量和pH值降低,这些条件有利于抑制腐败菌生长[29]。肠杆菌主要包括沙门菌属、志贺氏菌、大肠杆菌,是霉鱼发酵保藏过程中主要控制的致病菌。肠杆菌含量在发酵初期显著下降,可能由于微生物的基数已经处于很高水平,同种微生物之间亦存在生存空间的竞争。F3到F5阶段,肠杆菌数量上升至3.49 lgCFU/g,可能由于pH值上升,对肠杆菌产生的抑菌作用消失。参考霉豆腐肠杆菌标准《GB 2712—2014》和《GB 29921—2021》发酵鱼标准,在整个发酵过程中F1、F2和F3肠杆菌含量符合卫生标准(<31 000 CFU)。
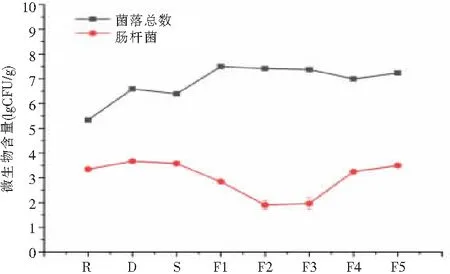
图5 相关微生物含量的变化/(lgCFU/g)
2.5 不同加工阶段中蛋白质氧化规律
如图6所示,加工过程中肌浆蛋白和肌原纤维蛋白含量变化均显著降低(P<0.05),在发酵阶段蛋白含量下降显著,肌原纤维蛋白在发酵75 d(F5)时降至7.18 mg/g,肌浆蛋白降至18.83 mg/g,分别是鲜肉(R)的9.16%和33.66%,可能是由于水分含量降低,pH值下降导致组织蛋白酶被激活,微生物酶协同水解鱼肉蛋白[24]。
蛋白羰基、巯基的含量可以反映蛋白的氧化程度[30]。加工过程中蛋白质羰基和巯基含量变化如图7所示。霉鱼加工过程中肌浆蛋白和肌原纤维蛋白的羰基含量显著上升(P<0.05),分别由鲜鱼的6.8 nmol/mg和3.07 nmol/mg,增长至19.17 nmol/mg和12.24 nmol/mg。羰基化合物的形成主要分为直接作用和间接作用,直接作用主要为赖氨酸、脯氨酸、苏氨酸等侧链直接氧化和肽主链的直接断裂,间接作用主要为还原糖的非酶催化反应即美拉德反应以及非蛋白羰基化合物如丙二醛共价结合、4-羟基-2-壬烯醛等[31]。
加工过程中巯基含量显著下降(P<0.05),F5阶段肌浆蛋白和肌原纤维蛋白的巯基含量仅为鲜肉的20.62%、17.61%。巯基含量的降低可能是由于氧化破坏了蛋白质空间结构,使巯基转化为分子之间、分子内二硫键或氧化成次磺酸,亚磺酸和磺酸,也可能是存在疏水相互作用等导致蛋白变性聚集,从而导致能检测到的巯基含量降低[31]。在加工过程中蛋白质表面的巯基被氧化,形成二硫键或二硫键发生-S-S-互换作用,使蛋白质与水分结合的能力减弱,导致了持水能力的降低,对产品品质产生间接影响[32-33]。此研究结果与曹辰辰等研究发酵香肠蛋白质巯基含量随时间变化的趋势相同[34]。

图6 不同加工阶段霉鱼肌原纤维蛋白和肌浆蛋白含量变化

图7 不同加工阶段霉鱼羰基和巯基含量的变化
2.6 发酵时长对霉鱼感官品质的影响
F5阶段TVB-N值超出标准,仅对发酵保藏的F1~F4阶段进行感官评价。由表5可知,在发酵45 d前色泽更接近鲜肉,得分较高,F4阶段色泽发黄暗淡,使得得分降低;组织形态评分随发酵进行而肉块变硬、组织松散,得分降低;气味和滋味得分均是先增加后降低;F2达到最高,后续下降明显。由感官评分可知F1、F2阶段品质良好F3、F4稍次,均可被消费者接受。
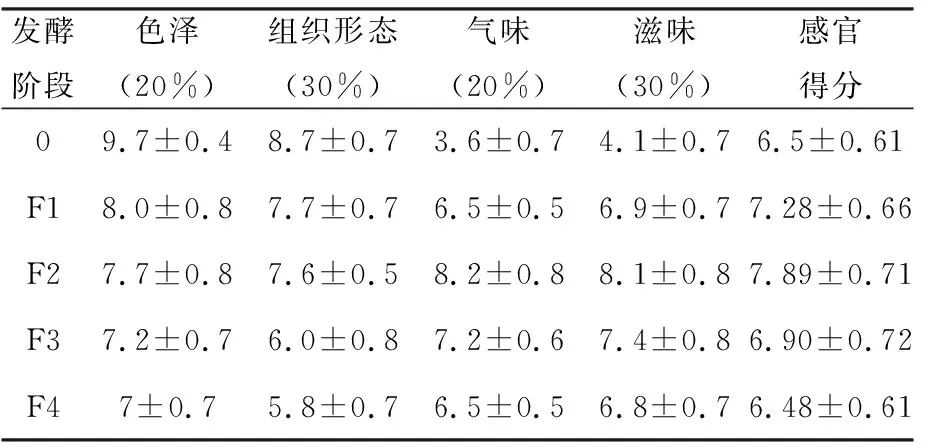
表5 不同发酵阶段霉鱼的感官评价结果
3 结论
本研究证实了霉鱼加工过程中品质变化及蛋白质氧化。蛋白质变化对霉鱼品质具有相关性,对霉鱼品质指标,如质构、色泽等,在发酵前期均产生积极作用。与新鲜鱼肉相比,霉鱼加工过程中肌浆蛋白和肌原纤维蛋白均发生显著降解,蛋白质、脂肪氧化持续加深;品质分析表明霉鱼硬度、咀嚼性、弹性升高增加了产品质构品质;加工中蛋白质持续氧化显著影响产品色泽的形成过程;蛋白质、脂肪氧化显著影响产品感官评分。在加工过程中各项化学指标、微生物指标均符合食品安全标准,结合感官评价,霉鱼发酵保藏最佳食用时间为30 d,发酵保藏最长时间为60 d。
