调味香料草果中多酚类化合物抗氧化活性成分的快速筛选
2022-05-06杜丽霞姜子涛周烜
杜丽霞,姜子涛,2*,周烜
(1.天津天狮学院 食品工程学院,天津 301700;2.天津商业大学生物技术与食品科学学院,天津 300134)
草果被人们誉为食品调味香料中的“五香之一”,被广泛应用于四川火锅、麻辣香锅、卤制菜品中,起到去腥、增香的作用。草果(Amomumtsaoko),别名红草果、草果仁、草果子,是姜科豆蔻属多年生草本植物,主要分布于中国云南、广西、贵州等省区。草果中含有多种活性成分,如挥发油[1-3]、甾醇类[4]和黄酮类[5-6]等,这些丰富的化学成分使其具有抗氧化、抗菌、抗炎镇痛、抗肿瘤等多种生物活性[7-10],在食品、药品、保健品及化妆品等行业具有良好的应用前景。目前,国内外对草果的研究主要集中在挥发油的分离鉴定及挥发油的抗氧化、抗菌等活性[11-14],而对其中的多酚类化合物研究较少,多酚类化合物活性的研究更少[15-17]。本文提出了一种未涉及复杂费时的单体分离前提下,对草果提取物中每一个酚类成分抗氧化活性进行评价的方法。作者采用乙醇溶液作为提取剂的微波辅助提取法从草果中提取多酚,通过单因素试验和正交试验确定了草果多酚的最佳提取条件;采用高效液相色谱-串联质谱法(LC-MS/MS)鉴定了草果多酚的化学成分;以1,1-二苯基-2-三硝基苯肼自由基(DPPH)为探针,对每一个多酚类化合物的抗氧化活性进行了评价,为复杂混合物中抗氧化剂活性成分的快速筛选开拓了一条新途径。
1 材料与方法
1.1 材料与仪器
草果:云南省保山市,粉粹后过40目筛,密封避光保存;DPPH:美国Sigma-Aldrich公司;芦丁标准品:上海源叶生物科技有限公司;无水乙醇:天津市风船化学试剂科技有限公司;D101大孔树脂:天津南大树脂科技有限公司,使用前按照文献[18]进行预处理;试验用水均为去离子水,所用试剂均为分析纯。
LC-15C高效液相色谱仪 岛津管理(中国)有限公司;CW-2000超声-微波协同萃取/反应仪 上海新拓分析仪器科技有限公司;Agilent G6410A LC-MSD QQQ液相色谱-质谱/质谱联用仪 美国Agilent公司;UV1000单光束紫外可见分光光度计 上海天美科学仪器有限公司。
1.2 试验方法
1.2.1 草果多酚的提取方法
精密称取定量粉碎过筛的草果粉末于超声-微波协同萃取仪配套的提取瓶中,加入定量浓度的乙醇溶液,置于超声-微波协同萃取仪中,关闭超声功能,开启微波功能,将微波功率调至400 W,调好提取温度和时间后进行微波辅助提取,提取完的溶液以4000 r/min的转速离心20 min,上清液即为草果多酚提取液。
1.2.2 草果多酚得率的测定方法
用参考文献[18]中的方法制作芦丁标准曲线,得到线性回归方程为y=0.4307x+0.0063,R2=0.9991。
准确吸取1.2.1中制备的草果多酚上清液5 mL,加蒸馏水10 mL,混匀后,准确吸取稀释后的上清液1 mL置于25 mL容量瓶中,从加水至6 mL开始,按照参考文献[18]中的方法进行显色和测定,最后按此公式计算。草果多酚得率(%)=(C×N×V)/10M。式中:C为样品吸光度值带入线性回归方程中计算出的多酚提取液浓度(mg/mL);N为稀释倍数;V为提取液体积(mL);M为样品质量(g)。
1.2.3 草果多酚提取工艺条件的优化
先进行四因素五水平的单因素试验,找到乙醇浓度、提取温度、料液比和提取时间这4个单因素下的最优水平,然后设计四因素三水平的正交试验L9(34),最后得到草果多酚最佳提取工艺条件。
1.2.4 草果多酚的纯化方法
以湿法装柱,制备D101大孔树脂层析柱,将1.2.1方法中制备的草果上清液稀释至多酚浓度为1.0 mg/mL,用0.1 mol/L的盐酸调节pH至4后,以2 BV/h(BV为树脂床体积)的流速进行上样,直至流出液吸光度达到泄漏点时停止,然后用蒸馏水洗涤层析柱至流出液无色、无醇味后,用70%乙醇溶液以2 BV/h的流速进行解吸,收集解吸液,将解吸液的多酚浓度稀释至0.5 mg/mL,备用。
1.2.5 草果多酚的定性分析
液相色谱条件:Zorbax SB-C18色谱柱(250 mm×4.6 mm×5 μm),柱温30 ℃,流动相A为甲醇,流动相B为0.1%甲酸溶液,梯度洗脱条件为0~30 min:40%~75% A,30~35 min:75% A,流速0.3 mL/min,进样量5 μL。
质谱条件:离子源为ESI负离子源,喷雾电压为4000 V;雾化气体为N2,雾化气压力为35 psi,雾化气流速为10 L/min,离子源温度为350 ℃;碰撞气体为N2,碰撞气压力为0.15 MPa。
1.2.6 草果多酚清除DPPH自由基有效成分的识别
取纯化后并经0.22 μm有机滤膜过滤后的草果多酚提取液两份:一份直接用HPLC分离测定;另一份与5 mL DPPH溶液混合均匀,反应1 h后,再用HPLC分离测定。两次测定的色谱条件均为:色谱柱C18柱;流动相为乙腈∶水为75∶25(V/V);流速0.8 mL/min;检测波长268 nm;色谱柱温度为室温(25 ℃),进样量5 μL。最后根据草果多酚提取液与DPPH溶液反应前后色谱峰面积的变化情况,计算出草果多酚提取物中每一成分清除DPPH自由基的清除率。
2 结果与分析
2.1 提取草果多酚的单因素试验结果
草果多酚的单因素试验结果见图1。
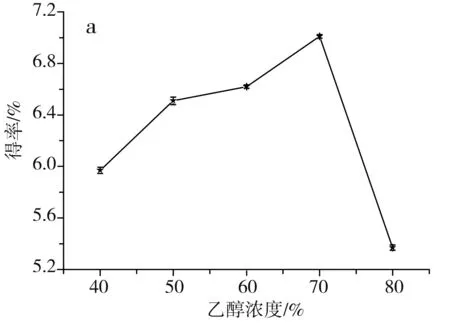
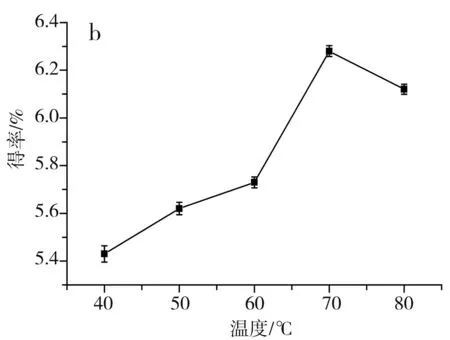
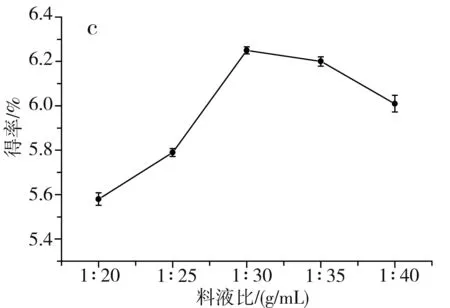
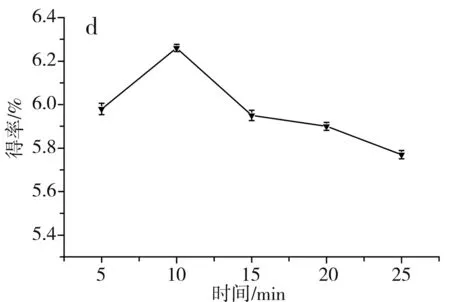
图1 单因素对草果多酚得率的影响Fig.1 Effect of single factor on the extraction yield of polyphenols from Amomum tsaoko注:a为乙醇浓度的影响;b为温度的影响;c为料液比的影响;d为时间的影响。
由图1中a可知,当乙醇浓度由40%升到70%时,醇溶性的多酚逐渐被提取出来,多酚得率随之升高,当进一步升高乙醇浓度至80%时,会导致部分水溶性的多酚不能被充分提取出来,多酚得率随之下降,当乙醇浓度为70%时,草果多酚的得率最高,因此选择70%为最佳乙醇浓度。由图1中b可知,当提取温度在40~70 ℃之间时,草果多酚的得率随着提取温度的升高而提高,这是因为升高提取温度,加速了分子的运动,更有利于多酚物质从细胞中溶出,当提取温度进一步提高到80 ℃时,多酚得率反而降低,这是因为过高的提取温度会使多酚氧化分解,因此选择70 ℃为最佳提取温度。由图1中c可知,当料液比为1∶30时,多酚得率最高;当料液比低于1∶30时,溶剂量过少,达到饱和后,多酚不再溶出;当料液比高于1∶30时,溶剂量过多,不利于微波的传导,使得多酚得率稍有下降。由图1中d可知,当提取时间为10 min时,草果多酚得率最高;当时间低于10 min时,时间过短,多酚未被充分提取出来;当时间高于10 min时,微波会加速多酚的氧化分解,所以随着微波时间进一步加长,多酚得率反而逐渐下降,因此选择10 min为最佳提取时间。
与文献[6]、文献[16]、文献[17]比较可知,微波辅助提取能够显著缩短草果多酚的提取时间,其提取时间为超声波辅助提取法的1/4,为传统溶剂提取法的1/15,同时微波辅助提取法的多酚得率也要高于这两种方法,这是因为微波能促使植物的细胞组织破壁或变形,使多酚成分更加快速且充分地溶出。
2.2 提取草果多酚的正交试验结果
正交试验结果见表1。
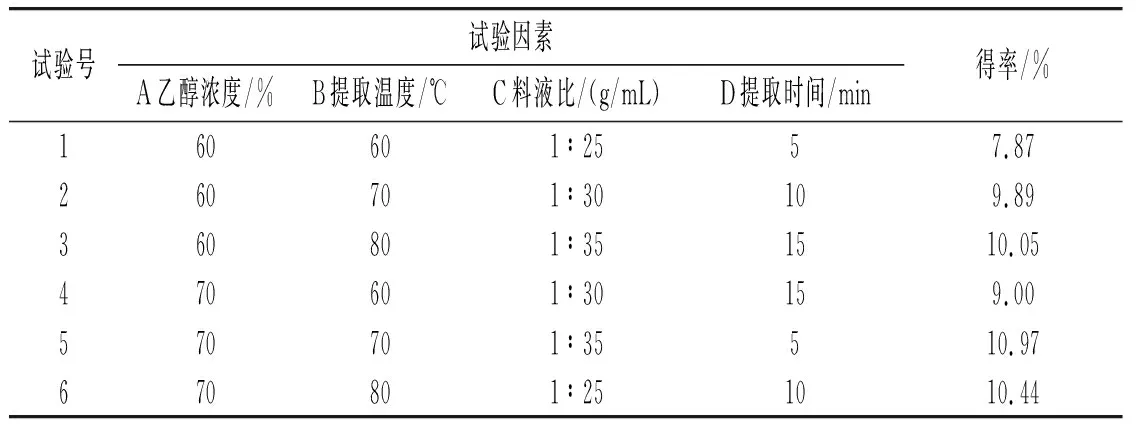
表1 正交试验结果Table 1 The results of orthogonal test
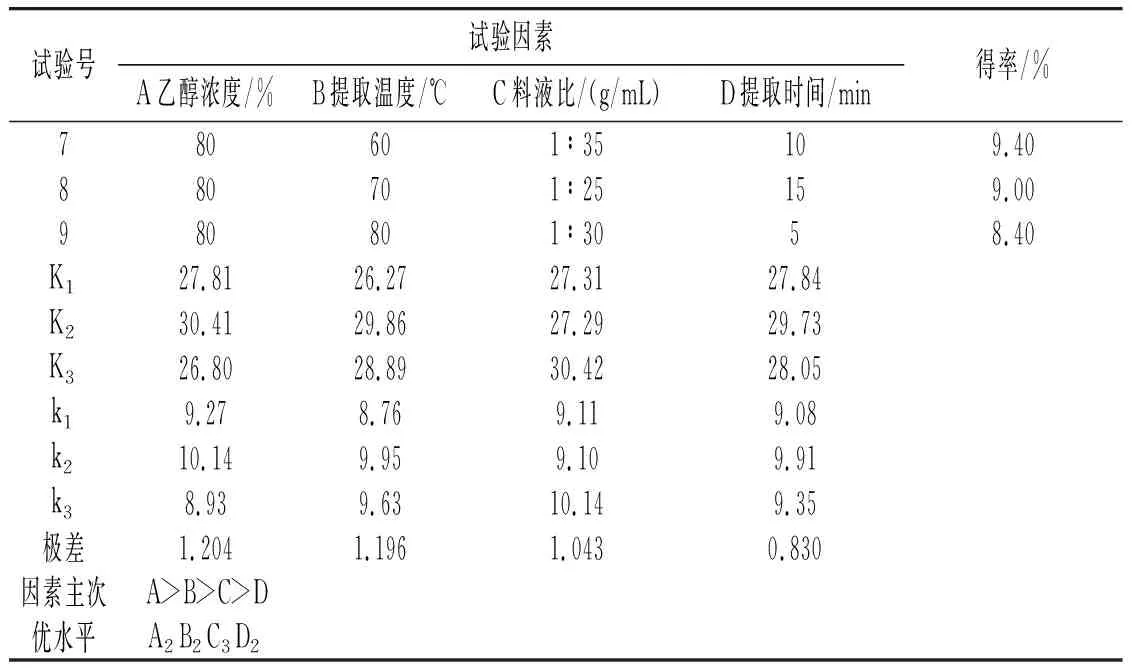
续 表
由表1可知,对草果多酚得率影响最大的因素是乙醇浓度,然后是提取温度,最后是料液比和提取时间。草果多酚的最佳提取工艺条件为:乙醇浓度70%、提取温度70 ℃、料液比1∶35(g/mL)、提取时间10 min。在此条件下平行提取3次,得到的草果多酚得率分别为11.08%、11.15%、11.17%,平均值为11.13%。
2.3 草果多酚成分分析
草果多酚的总离子流图见图2,在其质谱条件下分析得到草果中3种多酚类化合物的母离子和碎片离子信息,见表2。
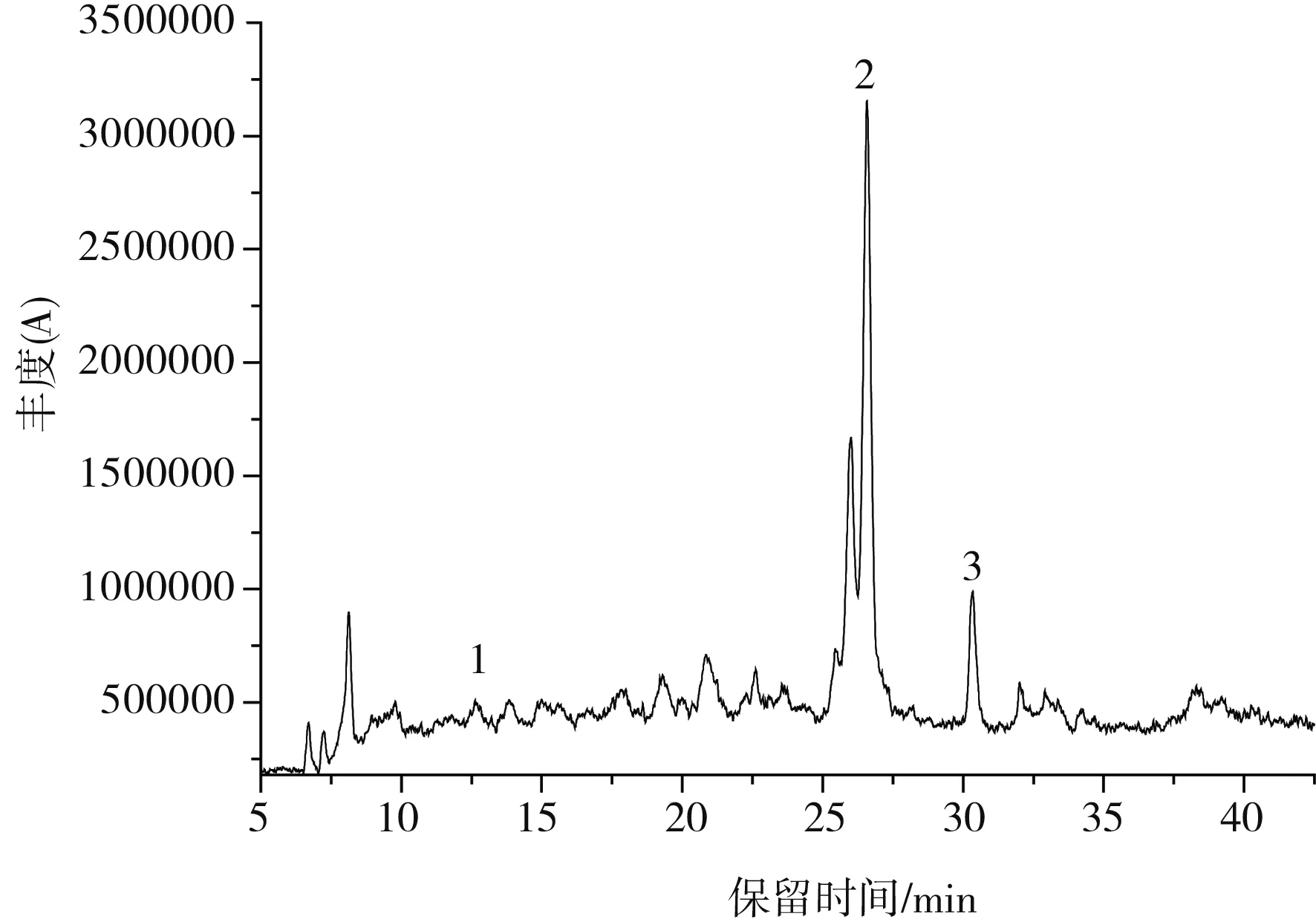
图2 草果多酚的总离子流图Fig.2 The total ion flow diagram of polyphenols from Amomum tsaoko
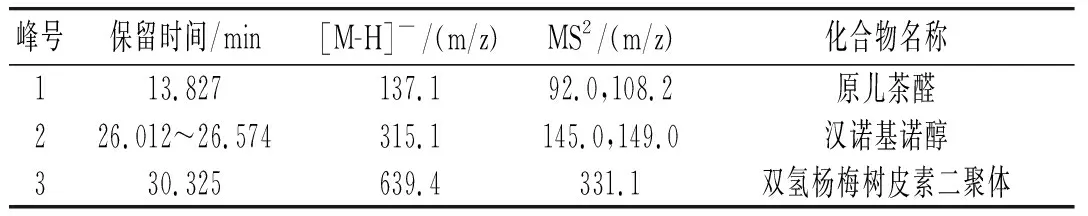
表2 草果多酚的LC-MS/MS数据Table 2 LC-MS/MS data of polyphenols from Amomum tsaoko
通过比对样品与标准品的保留时间、母离子及其碎片离子的数据以及图谱解析,确定出了草果多酚提取物中3种多酚类化合物,分别是原儿茶醛、汉诺基诺醇和双氢杨梅树皮素二聚体,分别占总量的7.2%、65.3%和17.3%。原儿茶醛样品(1号峰)及标准品的质谱图是非常吻合的(见图3中a);通过图谱解析和文献比对,确定2号峰为汉诺基诺醇,m/z 315.1是汉诺基诺醇的[M-1]准分子离子峰,其发生α-裂脱掉HO-C6H4-C4H7(OH)-基团,得到m/z 149的碎片离子,其裂解规律及其质谱图见图3中b,此结果和Martin等[19]和Zhang等的结果是一致的;3号峰 m/z 639.4为双氢杨梅树皮素二聚体的[M-1]准分子离子峰,m/z 331.1为双氢杨梅树皮素单体峰(含一分子水)。根据二级质谱图谱解析和文献比对,该成分被确定为双氢杨梅树皮素二聚体[20],其分子裂解规律及质谱图见图3中c。由表2可知,汉诺基诺醇为草果多酚的主要成分。
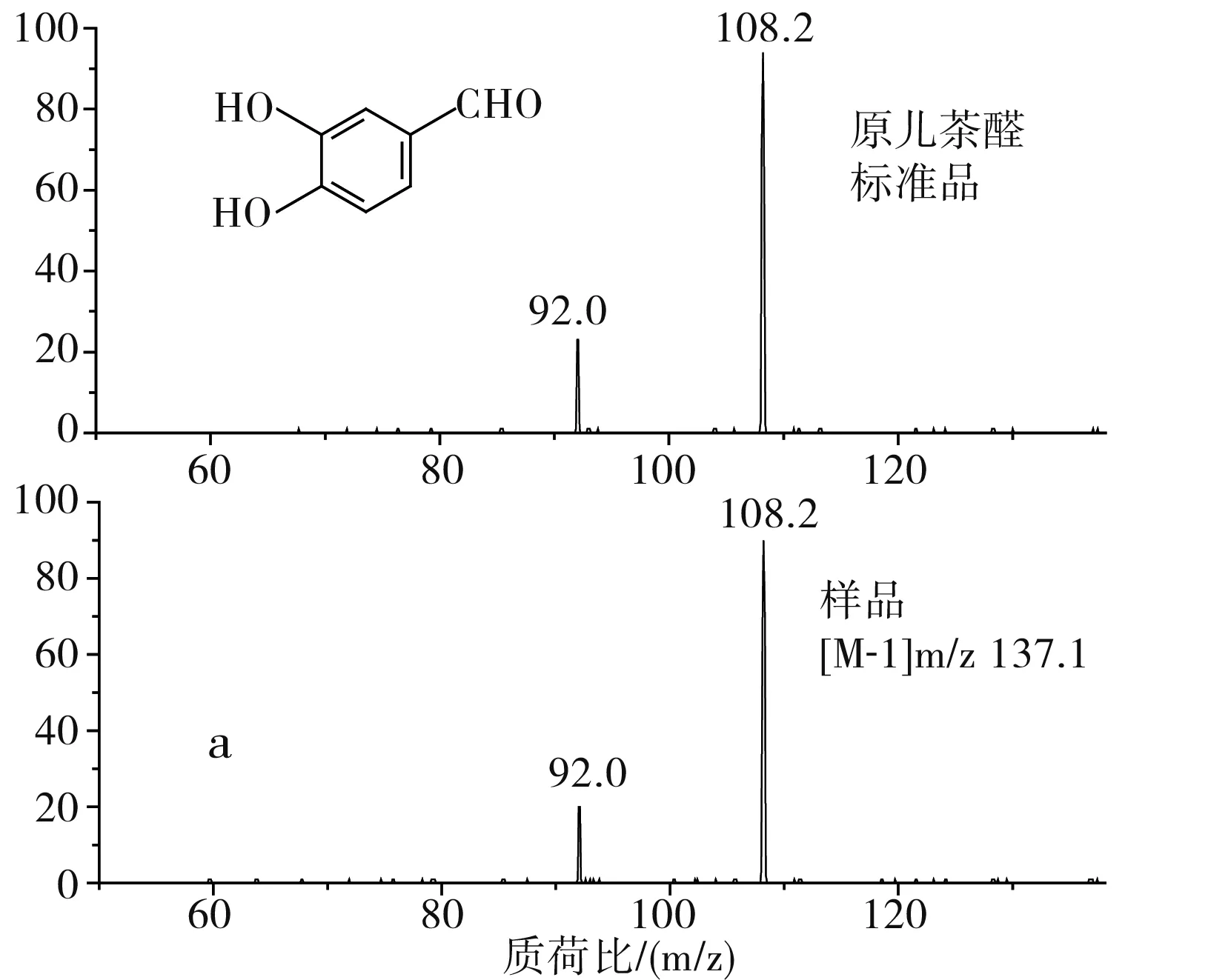
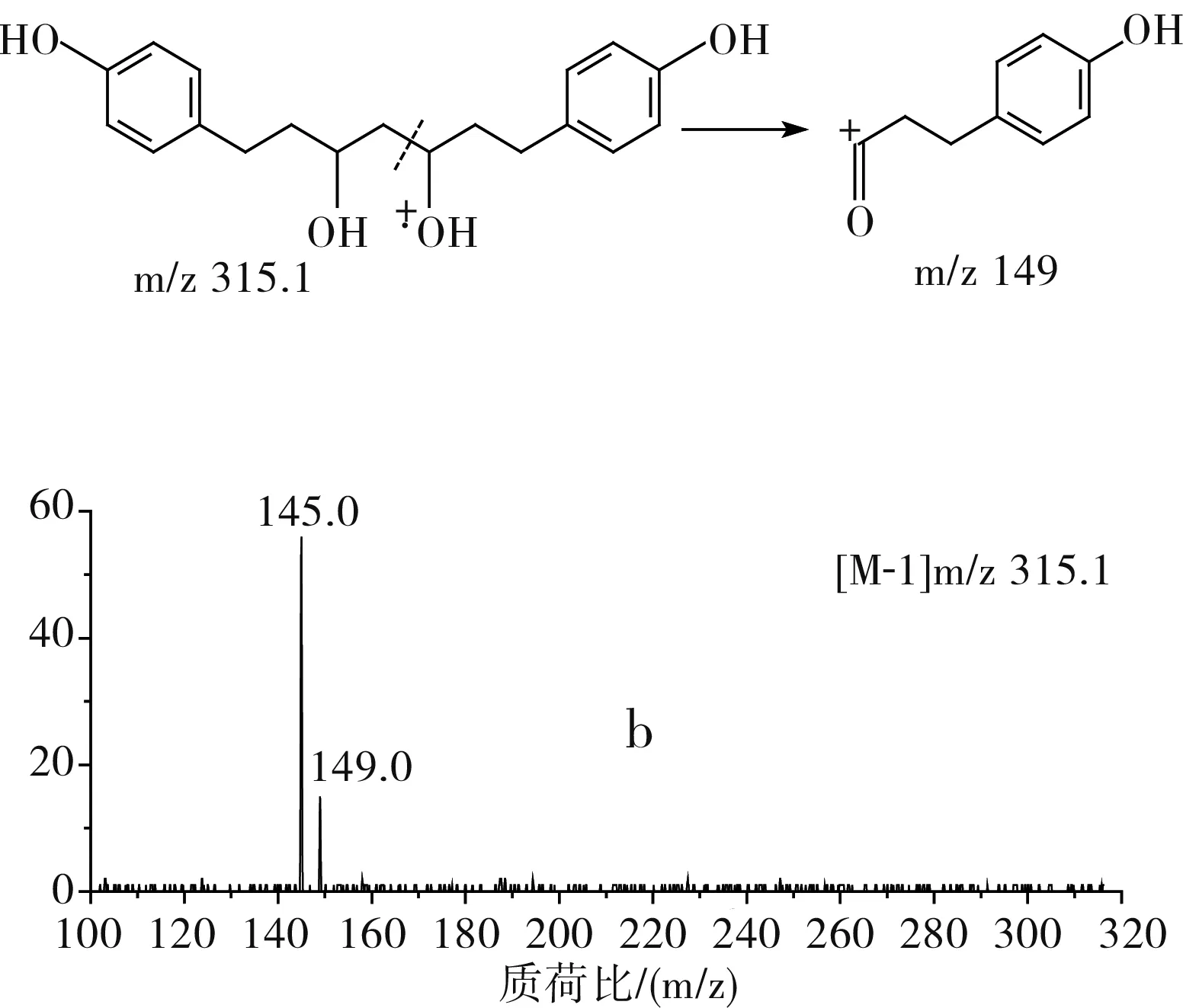

图3 草果多酚与相应标准品的二级质谱比对图Fig.3 Comparison of MS2 spectra of polyphenols from Amomum tsaoko and corresponding standard samples
2.4 草果多酚清除DPPH自由基有效成分的识别
草果多酚与DPPH反应前后的HPLC图见图4。抗氧化活性越强的多酚类化合物与DPPH自由基反应的能力就越强,而大量被消耗,反映到HPLC图上就是该多酚化合物与DPPH反应后的峰面积较反应前大大降低,所以峰面积下降越多的多酚化合物其清除DPPH自由基及抗氧化活性越强。
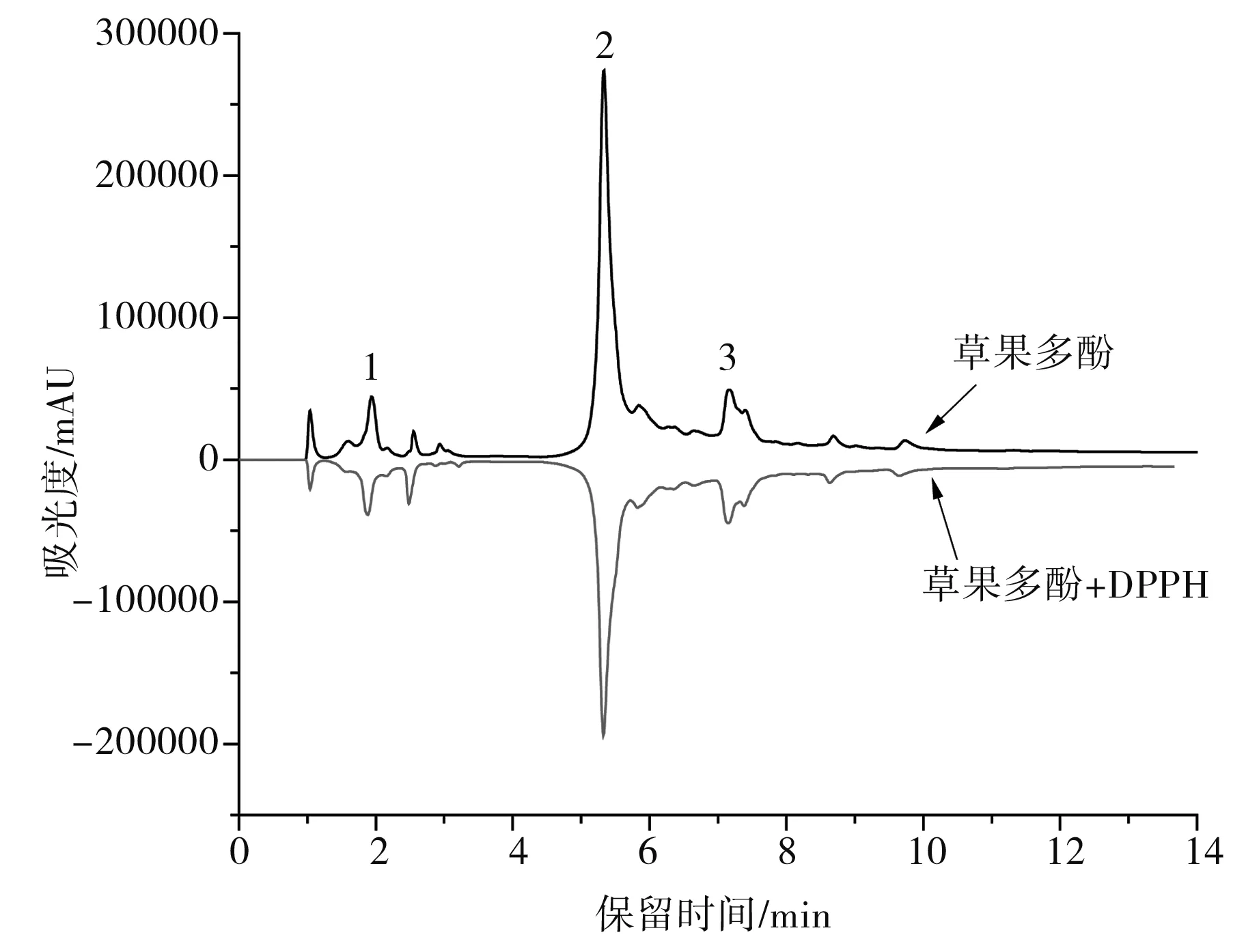
图4 草果多酚与DPPH自由基反应前后的HPLC图Fig.4 HPLC chromatogram of polyphenols from Amomum tsaoko before and after reacted with DPPH free radicals注:1为原儿茶醛,2为汉诺基诺醇,3为双氢杨梅树皮素二聚体。
试验结果显示:原儿茶醛与DPPH反应后,峰面积下降了4.56%,汉诺基诺醇与DPPH反应后,峰面积下降了24.02%,双氢杨梅树皮素二聚体与DPPH反应后,峰面积下降了21.84%。可见3种多酚类化合物均具有抗氧化及清除DPPH自由基的能力,但它们之间活性强度存在差异,其活性顺序依次为汉诺基诺醇>双氢杨梅树皮素二聚体>原儿茶醛,其中汉诺基诺醇的抗氧化及DPPH自由基的清除能力最强。另外,其余的一些微量成分也表现出一定的抗氧化能力。有研究表明,草果总多酚的抗氧化能力高于Vc。因此,草果总多酚所表现出来的较强抗氧化活性是所有多酚协同作用的结果,汉诺基诺醇起主要作用。
3 结论
采用微波辅助提取法从调味香料草果中提取多酚类化合物,确定了最佳提取条件为:乙醇浓度70%、提取温度70 ℃、料液比1∶35(g/mL)、提取时间10 min,草果多酚的得率为11.13%。用LC-MS/MS对草果多酚成分进行分析,鉴定出3种多酚类化合物:原儿茶醛、汉诺基诺醇和双氢杨梅树皮素二聚体。同时,采用DPPH自由基作探针识别出草果中抗氧化活性较强的多酚类化合物,从结果上看,草果多酚中起主要抗氧化作用的是主成分汉诺基诺醇,其余大部分都具有抗氧化活性,但活性强弱有较大差异,这些多酚在草果中由于含量较低,起到辅助的作用。
