基于传统分离培养和高通量测序不同孔径陶瓷膜过滤前后泡菜汁中微生物变化的研究
2022-05-06王玉梅李洋罗佳沂李凯毛瑞丰
王玉梅,李洋,罗佳沂,李凯,毛瑞丰
(广西大学 轻工与食品工程学院,南宁 530004)
泡菜是以新鲜果蔬为原料,辅以香辛料,添加或不添加发酵剂,采用盐水浸渍厌氧发酵制作而成的[1-2]。泡菜中含有丰富的矿物质[3]、氨基酸[4]、有机酸[5]、维生素[6]等营养物质,在发酵后期泡菜风味物质含量丰富,不仅能满足人体所需要的营养物质,而且具有酸、鲜、爽、脆、嫩等特点[7-9]。近年来,膜过滤技术发展相当迅速,已经广泛应用于各行各业,包括污水处理[10-11]、化工[12-13]、食品[14-15]、医疗、气体分离等。
陶瓷膜是以压力泵驱动带来膜内外的压力差,促使料液样品中的小分子物质和水在压力的驱动下透过膜,而一些大分子(胶体、酚类物质、蛋白及微生物等)且粒径远远大于膜孔径的物质被截留,从而达到除菌和澄清的效果[16-17]。本研究采用传统生物学以及高通量测序技术分析不同孔径陶瓷膜对泡菜汁微生物截留的种类、差异性及菌相的变化,并对陶瓷膜孔径不同对微生物截留的差异性进行讨论,为今后陶瓷膜处理应用于发酵类产品除菌的研究与应用提供了理论依据,也为泡菜汁的综合利用及多元化发展提供了优质原料。
1 实验材料与方法
1.1 实验原料
泡菜汁:由广西某泡菜厂提供。取得的泡菜汁经8层灭菌纱布过滤之后即可作为膜处理的原料液。分别在温度TEM=40 ℃,膜面流速为CFV=4~5 m/s, 跨膜压差为TMP0.008=0.5 MPa、TMP0.05=0.35 MPa、TMP0.2=0.3 MPa、TMP0.5=0.25 MPa的条件下过滤泡菜汁。
1.2 实验设备
孔径为0.008,0.05,0.2,0.5 μm的陶瓷膜及陶瓷膜中试设备。
1.3 实验方法
1.3.1 陶瓷膜处理前后细菌和真菌的分离纯化
取3 mL经陶瓷膜处理的泡菜汁及原泡菜汁样品于无菌平板中,用平板倾注法分别倒NA、PDA平板。待平板凝固后,将NA平板倒置放在37 ℃生化培养箱中培养48 h,将PDA平板倒置放在28 ℃生化培养箱中培养96 h,然后对平板内的细菌和真菌菌株分离纯化,分离纯化方法采用平板划线法,直到获得纯化的单菌落保存于-20 ℃冰箱中。
1.3.2 DNA的提取及PCR扩增
将分离的细菌于LB液体培养基中培养15 h,参考细菌DNA提取试剂盒说明书进行DNA提取、将分离的真菌于PDB液体培养基中培养72 h,参考真菌DNA提取试剂盒说明书进行DNA提取。PCR扩增采用50 μL反应体系:
细菌扩增引物:27F/1492R 27F:5′-AGAGTTT-GATCCTGGCTCAG-3′;
1492R:5′-TACGGCTACCTTGTTACGACTT-3′;
真菌扩增引物:ITS1/ITS4 ITS1:5′-TCCGTA-GGTGAACCTGCGG-3′;
ITS4:5′-TCCTCCGCTTATTGATATGC-3′。

表1 PCR扩增程序Table 1 PCR amplification program
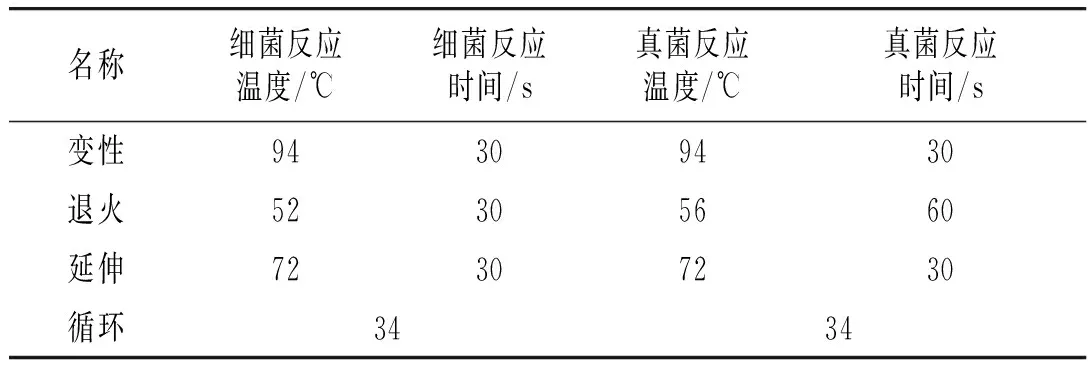
表2 PCR反应条件Table 2 PCR reaction conditions
1.3.3 DNA与PCR扩增产物的保存方法
DNA与PCR产物分别放置在灭菌的1.5 mL的离心管和PCR管中密封,-20 ℃保存备用。
1.3.4 DNA测序及序列相似性对比
对PCR扩增产物进行琼脂糖凝胶电泳,获得清晰明亮的条带, PCR产物委托生工生物工程(上海)有限公司进行测序。
16S rRNA和ITS序列分析:序列分析登录NCBI数据库,应用BLAST程序分别对所测得的16S rRNA 和ITS序列与GenBank中的核酸进行相似性比对。采用软件Clustal X1.83 进行多序列的比对,并将对位排列结果中5′和3′端的非对位排列区手动删除。预处理好的DNA序列利用MEGA 7.0软件[18]计算序列的碱基组成(compute nucleotide composition)[19]、计算遗传距离[20]、构建系统发育树[21]、检验各分支的置信度[22]。遗传距离基于Kimura 2-parameter模式计算、系统发育树基于neighbor-joining(NJ)法构建,各分支的置信度利用自展法(Bootstrap重复1000次)检验。
1.3.5 高通量测序
分别称取200 mg 4种不同孔径陶瓷膜处理前后的泡菜汁样品,放入灭菌后的2 mL离心管中,加入1 mL体积分数为70%的乙醇溶液,振荡混匀,以10000 r/min室温离心3 min,弃上层液体。加入磷酸盐缓冲液溶液(0.01 mol/L,pH 7.2),振荡混匀,以10000 r/min室温离心 3 min,弃上层液体。按照 Power Soil DNA Isolation Kit说明书分别提取4种不同孔径陶瓷膜处理前后的泡菜汁样品的细菌、真菌群的宏基因组DNA,利用 Qubit 3.0 DNA检测试剂盒对提取的基因组DNA进行精确定量。以提取的宏基因组DNA为模板,采用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌的16S rRNA(V3-V4)区序列进行PCR扩增。引物SSU0817F(5′-TTAGCATGGAATAATRRAATAGGA-3′)对真菌的ITS(ITS1-ITS2)区序列进行PCR扩增:PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,45 ℃退火20 s,72 ℃延伸45 s,共20个循环;72 ℃再延伸 10 min。PCR 扩增体系(20 μL):5×Fast Pfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,正向及反向引物(5 μmol/L)各 0.8 μL,Fast Pfu Polymerase 0.4 μL, BSA 0.2 μL,模板 DNA 10 ng,补双蒸水(ddH2O)至20 μL。利用Min Eluter PCR Purification Kit对PCR 扩增产物进行纯化,PCR 扩增产物经2%浓度的琼脂糖凝胶电泳检测,使用胶回收试剂盒对PCR目的条带进行纯化回收。利用 Tru-Seq rDNA PCR-Free Sample Preparation Kit制备测序文库并添加接头序列,经过Nano Drop 2000测定文库质量后,利用Illumina HiSeq 2500测序平台进行高通量测序。
1.4 实验数据分析
根据97%相似性[23],将非重复序列进行操作分类单元(OTU)聚类,然后采用RDP Classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,统计4种不同孔径陶瓷膜处理前后泡菜汁样品的微生物在不同水平的群落组成。利用Mothur软件绘制稀释性曲线进行Alpha多样性分析[24],利用QIIME软件计算样品的各种多样性指数,原始实验数据处理采用Excel软件,每组实验重复3次,实验数据采用Origin 2019b软件进行绘制。
2 结果与讨论
2.1 基因组DNA提取和PCR扩增
以提取的37株细菌、33株乳酸菌及14株真菌的DNA为模板,细菌和乳酸菌以27F和1492R为引物,进行16S rRNA扩增,真菌以ITS1和ITS4为引物,进行ITS扩增,并将得到的PCR扩增产物进行1%琼脂糖凝胶电泳检测,见图1。

注:图中1~37分别代表Q0-1、Q0-2、Q0-3、Q0-4、Q0-5、Q0-6、Q0-7、Q0-8、Q0-9、Q0-10、Q0-11、Q0-12、Q0-13、Q0-14、Q0-15、Q0-16、Q0-17、Q0-18、Q500-1、Q500-2、Q500-3、Q500-4、Q500-5、Q500-6、Q500-7、Q500-8、Q500-9、Q200-1、Q200-2、Q200-3、Q200-4、Q200-5、Q200-6、Q50-1、Q50-2、Q50-3、Q50-4。
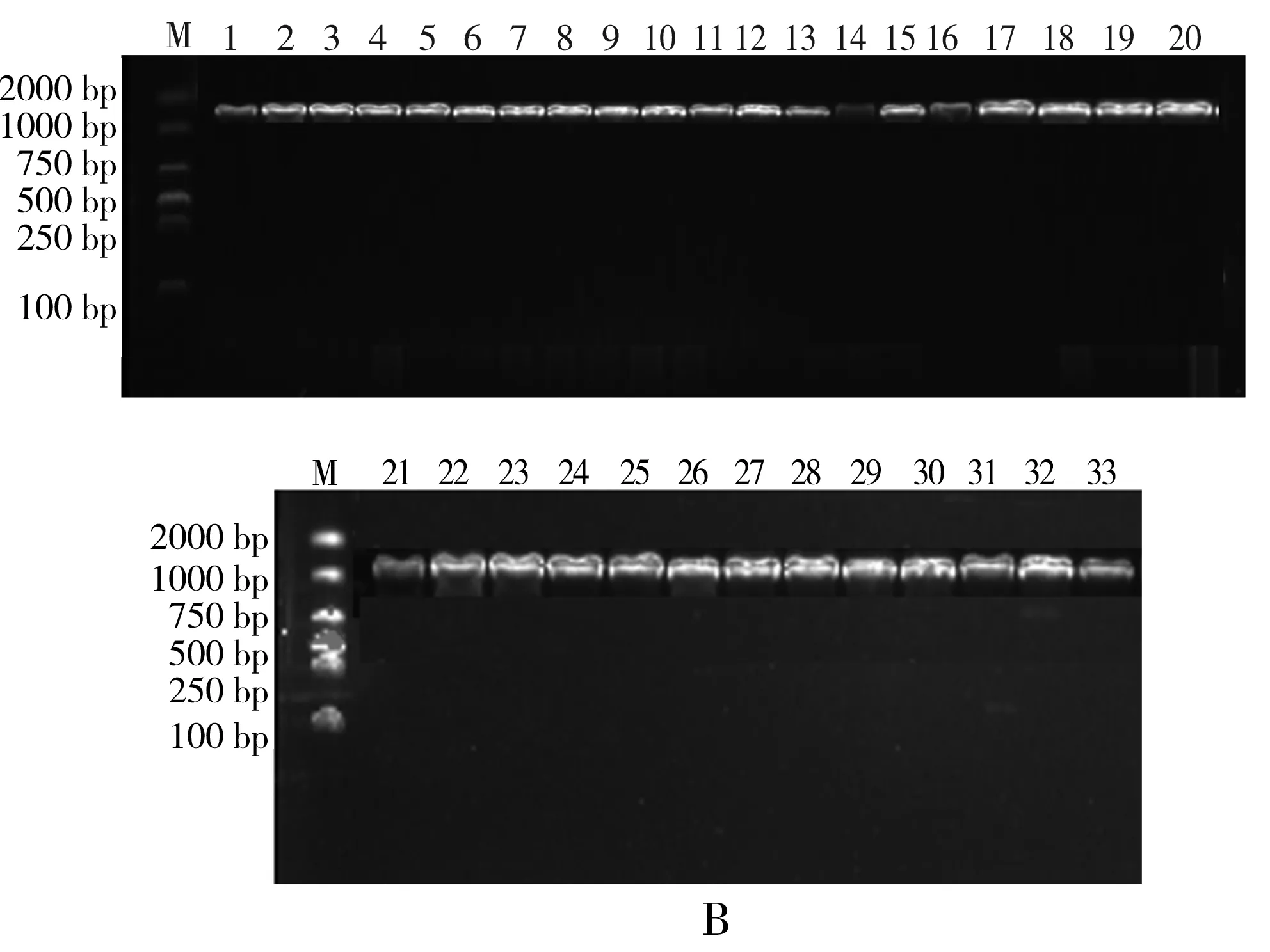
注:图中1~33分别代表M0-1、M0-2、M0-3、M0-4、M0-5、M0-6、M0-7、M0-8、M0-9、M0-10、M0-11、M0-12、M0-13、M0-14、M0-15、M500-1、M500-2、M500-3、M500-4、M500-5、M500-6、M500-7、M500-8、M200-1、M200-2、M200-3、M200-4、M200-5、M200-6、M50-1、M50-2、M50-3、M50-4。
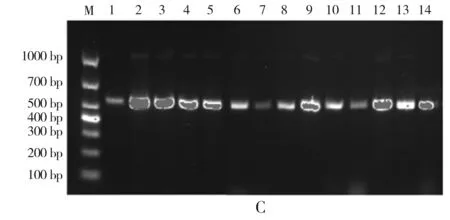
注:图中1~14分别代表P0-1、P0-2、P0-3、P0-4、P0-5、P0-6、P0-7、P0-8、P500-1、P500-2、P500-3、P500-4、P200-1、P200-2。
由图1可知,37株细菌、33株乳酸菌和14株真菌扩增产物都是条带明亮清晰且单一不拖尾,无非特异扩增现象,且细菌菌株和乳酸菌菌株的16S rRNA序列片段大小均在1200~1400 bp左右,真菌菌株的ITS序列片段大小均在600 bp左右,满足测序要求。
2.2 细菌分离鉴定结果
2.2.1 16S rRNA序列分析及遗传距离
将不同孔径陶瓷膜处理后泡菜汁中细菌分离纯化得58株细菌菌株及72株乳酸菌菌株,将其中37株(原泡菜汁中18株;0.5 μm陶瓷膜处理后泡菜汁9株;0.2 μm 陶瓷膜处理后泡菜汁6株;0.05 μm陶瓷膜处理后泡菜汁4株)细菌和33株(原泡菜汁中15株;0.5 μm陶瓷膜处理后泡菜汁8株;0.2 μm陶瓷膜处理后泡菜汁6株;0.05 μm陶瓷膜处理后泡菜汁4株)乳酸菌进行微生物菌种鉴定。测序结果显示:在去除两端16S rRNA引物序列后,应用MEGA 7.0软件将37个细菌和33个乳酸菌菌株16S rRNA基因序列进行多序列对比后计算得到GC含量表,见表3。

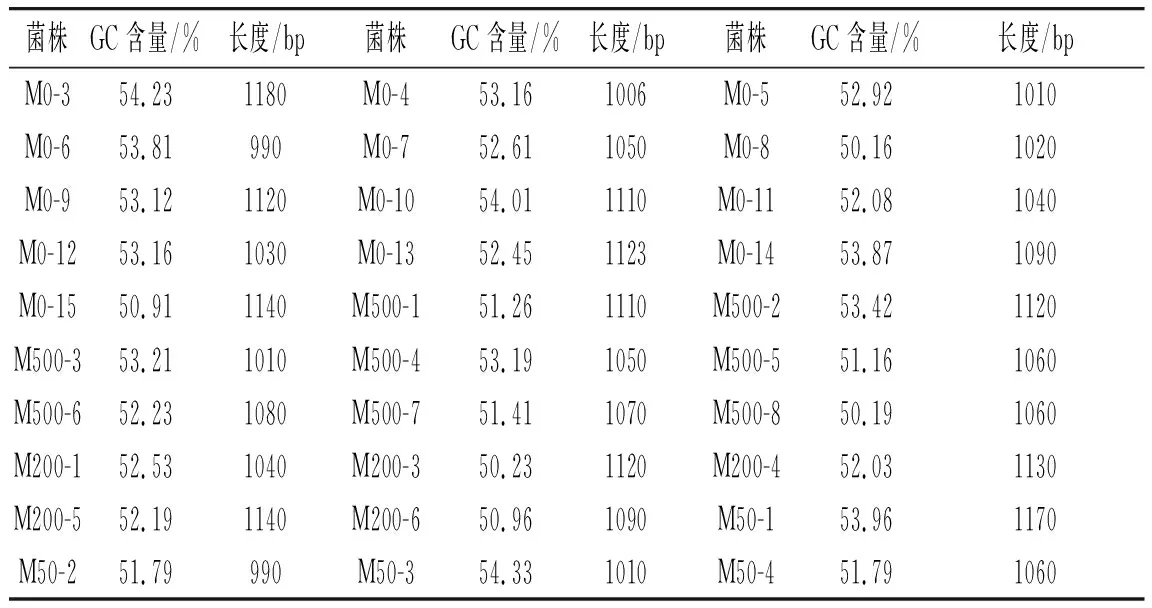
表3 细菌16S rRNA序列的GC含量及序列长度Table 3 GC content and sequence lengths of 16S rRNA of bacteria
续 表
由表3可知,37个细菌株GC含量在50.95%~58.03%。16S rRNA对齐序列长度在1005~1205 bp。此外,37个不同序列间的平均遗传距离(D)为0.0328。33个乳酸菌菌株GC含量在50.16%~54.23%。16S rRNA对齐序列长度在990~1180 bp。此外,33个乳酸菌不同序列间的平均遗传距离(D)为 0.6131。
2.2.2 16S rRNA系统发育分析
将37株细菌菌株和33株乳酸菌的基因序列,采用GenBank序列数据库,在NCBI上根据BLAST检索,搜索与上述所测得序列相似度较高的16S rRNA序列,分析比较后删除相同的序列,最终筛选最相似的16S rRNA序列与供试菌株序列的NJ法进行系统发育树的构建。
细菌结果见图2,细菌的NJ系统进化树各主分支的自举支持率范围在82%~100%,且各主分支的后验概率大部分在0.90~1.0之间。最终将37株供试菌株归为4个属,分别为芽孢杆菌(Bacillus)、放线菌属(Actinobacteriotas)、短波单胞菌属(Brevundimonas)和短杆菌属(Brevibacillus),以及14个种,分别为蜡样芽孢杆菌(Bacilluscereus)、婴儿芽孢杆菌(Bacillusinfantis)、贝莱斯芽孢杆菌(Bacillusvelezensis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、蝉杆菌(Bacillusciccensis)、放线菌(Actinobacteriabacterium)、马赛短芽孢杆菌(Brevibacillusmassiliensis)、橙色短波单胞菌(Brevundimonasaurantiaca)、堀越氏芽孢杆菌(Bacillushorikoshii)、Bacillusgottheilii、Brevundimonascaseigenomic strain、坚强芽孢杆菌(Bacillusfirmus)、短短芽孢杆菌(Brevibacillusbrevis)及丝状芽孢杆菌(Bacillusfilamentosus)。经过0.5 μm陶瓷膜处理后,泡菜汁中检测出8种细菌分别是蝉杆菌(Bacillusciccensis)、放线菌(Actinobacteriabacterium)、坚强芽孢杆菌(Bacillusfirmus)、蜡样芽孢杆菌(Bacilluscereus)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、短短芽孢杆菌(Brevibacillusbrevis)、婴儿芽孢杆菌(Bacillusinfantis)和贝莱斯芽孢杆菌(Bacillusvelezensis)。经过0.2 μm陶瓷膜处理后,泡菜汁中检测出5种细菌,分别是蜡样芽孢杆菌(Bacilluscereus)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、短短芽孢杆菌(Brevibacillusbrevis)、婴儿芽孢杆菌(Bacillusinfantis)和贝莱斯芽孢杆菌(Bacillusvelezensis)。经过0.05 μm陶瓷膜处理后,泡菜汁中检测出3种细菌分别是解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、短短芽孢杆菌(Brevibacillusbrevis)和贝莱斯芽孢杆菌(Bacillusvelezensis)。经过0.008 μm陶瓷膜处理后,未能成功分离鉴定出细菌。贝莱斯芽孢杆菌(Bacillusvelezensis)对病原菌和一些青霉有一定的抑制作用[25]。从基因组学上来说,解淀粉芽孢杆菌(Bacillusamyloliquefaciens)是贝莱斯芽孢杆菌(Bacillusvelezensis)的后期异形体[26]。短短芽孢杆菌(Brevibacillusbrevis)、贝莱斯芽孢杆菌(Bacillusvelezensis)和解淀粉芽孢杆菌(Bacillusamyloliquefaciens)微生物本身无毒无害且无污染,且对一些引起食品腐败微生物抑制产生积极作用[27-29]。

图2 基于16S rRNA序列的37株细菌的系统发育树Fig.2 Phylogenetic tree of 37 strains of bacteria based on 16S rRNA sequence
乳酸菌结果见图3,乳酸菌的NJ系统进化树各主分支的自举支持率范围在97%~100%,且各主分支的后验概率大部分在0.95~1.0之间。最终将33株供试菌株归为2个属,分别为乳杆菌属(Lactobacillus)和黏液乳杆菌属(Limosilactobacillus), 以及13个种,分别发酵黏液乳杆菌(Limosilactobacillusfermentum)、乳酸乳杆菌(Lactobacilluslactis)、发酵乳杆菌(Lactobacillusfermentum)和干酪乳杆菌(Lactobacilluscasei)。经过0.5,0.2,0.05 μm陶瓷膜处理后,泡菜汁中乳酸菌的截留率虽能达到89.396%以上,但泡菜汁中仍能检测出3种乳酸菌,包括乳酸乳杆菌(Lactobacilluslactis)、发酵乳杆菌(Lactobacillusfermentum)和干酪乳杆菌(Lactobacilluscasei)。

图3 基于16S rRNA序列的33株乳酸菌的系统发育树Fig.3 Phylogenetic tree of 33 strains of lactic acid bacteria based on 16S rRNA sequence
经陶瓷膜处理后,泡菜汁中的微生物种类减少,且随着陶瓷膜孔径的降低,泡菜汁中微生物的种类越少,且经过0.05 μm陶瓷膜处理后,泡菜汁中几乎未检出对人体产生毒害的细菌,而经过陶瓷膜处理的泡菜汁中含有的短短芽孢杆菌(Brevibacillusbrevis)、贝莱斯芽孢杆菌(Bacillusvelezensis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、乳酸乳杆菌(Lactobacilluslactis)、发酵乳杆菌(Lactobacillusfermentum)和干酪乳杆菌(Lactobacilluscasei)能对后续作为老汤再利用提供良好的抑菌效果,于此同时乳酸菌也能在一定程度上加快发酵速度,缩短发酵周期。
2.3 真菌分离鉴定结果
2.3.1 ITS序列分析及遗传距离
4种不同孔径膜过滤后泡菜汁中,分离纯化得30株真菌,将其中14株,原泡菜汁中8株、0.5 μm孔径膜过滤后泡菜汁4株、0.2 μm孔径膜过滤后泡菜汁2株,对其进行微生物菌种鉴定。测序结果显示:在去除两端ITS引物序列后,应用MEGA 7.0软件将14个菌株ITS基因序列进行多序列对比后计算得到GC含量,见表4。

表4 真菌ITS序列的GC含量及序列长度Table 4 GC content and sequence lengths of ITS of fungi
结果显示:14个菌株的GC含量在41.93%~51.35%。ITS对齐序列长度在472~498 bp。此外,14个不同序列间的平均遗传距离(D)为 0.0677。
2.3.2 系统发育分析
将14株真菌株的基因序列,采用GenBank序列数据库,在NCBI上根据BLAST检索,搜索与上述所测得序列相似度较高的ITS序列,分析比较后删除相同的序列,最终筛选最相似的ITS序列与供试菌株序列的NJ法进行系统发育树的构建。
由图4可知,真菌的NJ系统进化树各主分支的自举支持率范围在97%~100%,且各主分支的后验概率大部分在0.96~1.0之间。最终将14株供试菌株归为4个属,分别为曲霉菌属(Aspergillus)、掷孢酵母属(Sporobolomyces)、锁掷酵母属(Sporidiobolus)和毕赤酵母属(Pichias),以及4个种,分别为谢瓦曲霉(Aspergilluschevalieri)、卡尼克酵母菌(Sporobolomycescarnicolor)、锁掷孢酵母菌(Sporidioboluspararoseus)和库德里阿兹威毕赤酵母菌(Pichiakudriavzevii)。经过0.5 μm陶瓷膜处理后,泡菜汁中检测出3种真菌分别是卡尼克酵母菌(Sporobolomycescarnicolor)、锁掷孢酵母菌(Sporidioboluspararoseus)和库德里阿兹威毕赤酵母菌(Pichiakudriavzevii)。经过0.2 μm陶瓷膜处理后,泡菜汁中检测出3种真菌,分别是锁掷孢酵母菌(Sporidioboluspararoseus)和库德里阿兹威毕赤酵母菌(Pichiakudriavzevii)。经0.05 μm陶瓷膜处理后,泡菜汁中的真菌未达到检出限。
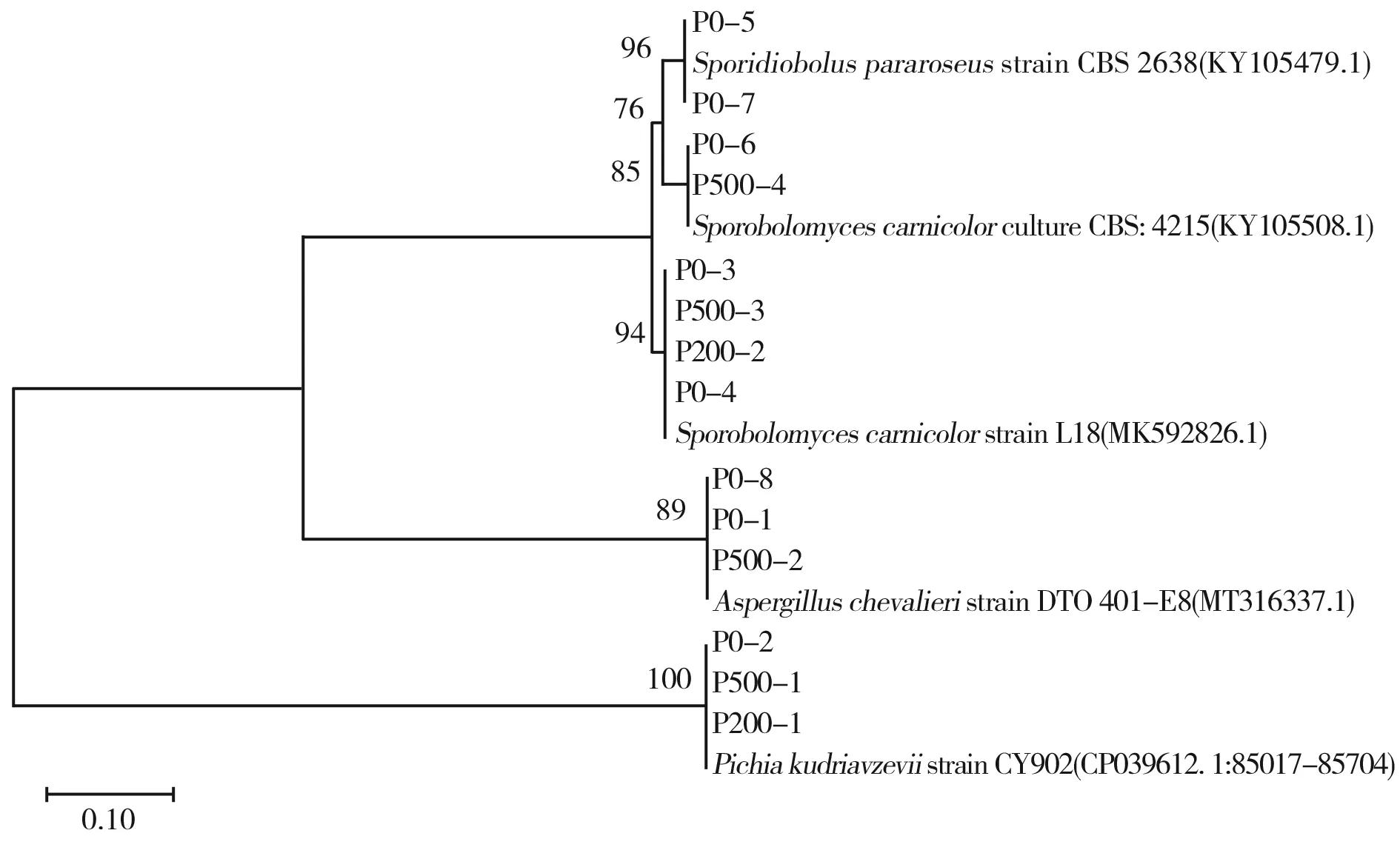
图4 基于ITS序列的14株真菌的系统发育树Fig.4 Phylogenetic tree of 14 strains of fungi based on ITS sequence
2.4 不同孔径陶瓷膜处理后泡菜汁中微生物多样性分析
2.4.1 基因组提取和PCR扩增
以提取的37株细菌、33株乳酸菌及14株真菌的DNA为模板,细菌和乳酸菌以27F和1492R为引物进行16S rRNA扩增,真菌以ITS1和ITS4为引物进行ITS扩增,并将得到的PCR扩增产物进行1%琼脂糖凝胶电泳检测,结果显示:37株细菌、33株乳酸菌和14株真菌扩增产物都是条带明亮清晰且单一不拖尾,无非特异扩增现象,且细菌菌株和乳酸菌菌株的16S rRNA序列片段大小均在1200~1400 bp左右,真菌菌株的ITS序列片段大小均在600 bp左右,满足测序要求(经过0.008 μm陶瓷膜处理后泡菜汁菌含量浓度较低,未能达到检出限)。
2.4.2 Alpha多样性分析
对不同孔径陶瓷膜处理前后5个泡菜汁样品的细菌和真菌进行Alpha多样性分析,结果见表5。

表5 泡菜汁经不同孔径陶瓷膜处理前后Alpha多样性指数统计表Table 5 Alpha diversity index statistics of pickle juice before and after treatment with ceramic membranes of different pore sizes
由表5可知,4个样品细菌和真菌覆盖度指数均大于99%,表明泡菜汁中微生物多样性组成且序列99%被检出。根据ACE与Chao1值可知泡菜汁中群落丰富度指数,根据ACE预估泡菜汁中群落OUT数目,根据Chao1指数预估泡菜汁中物种总数。由ACE与Chao1值可知,泡菜原汁中的细菌及真菌物种总数最大,经0.5 μm陶瓷膜处理后泡菜汁次之,其次是0.2 μm,0.05 μm物种总数最少。Shannon和Simpson指数表征群落内物种分布的多样性和均匀度,Shannon或Simpson指数越大,物种分布的多样性和均匀度越高,即群落的物种多样性越高。经陶瓷膜膜处理后,Shannon和Simpson指数下降,且陶瓷膜孔径越小Shannon和Simpson指数越小。泡菜原汁物种多样性和均匀度显著高于经陶瓷膜处理后的泡菜汁。
2.4.3 细菌和真菌结构相似性分析
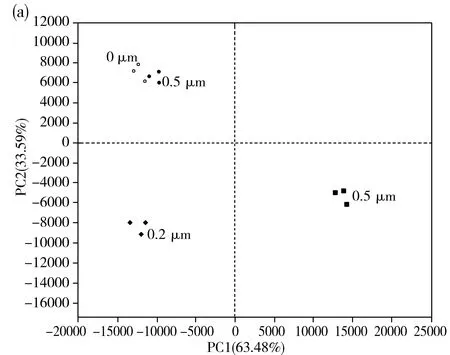
在多元统计分析中,主成分分析PCA(principal component analysis)是一种简化数据集的技术。主成分分析经常用于减少数据集的维数,同时保持数据集中对方差贡献最大的特征,从而有效地找出数据中最主要的元素和结构,揭示隐藏在复杂数据背后的简单结构(R软件)。由图5可知,样本间相似度越高则在图中越聚集。4个样品中基于细菌、真菌的OTU做PCA分析。采用PCA对陶瓷膜过滤前后泡菜汁中细菌和真菌群落结构的相似性进行分析,结果见图5,细菌第一主成分方差贡献率和第二贡献率分别为63.48%和33.59%,两个主成分覆盖泡菜汁样品中细菌97.07%的OTU差异。原泡菜汁与0.05 μm陶瓷膜处理后的泡菜汁距离较远,表明经过0.05 μm陶瓷膜处理后细菌群落结果差异较大,而原泡菜汁与与0.5 μm陶瓷膜处理后的泡菜汁样品聚集到一起,说明原泡菜汁0.5 μm陶瓷膜处理后的泡菜汁细菌群落组成最相似,其次是0.2 μm陶瓷膜处理后的泡菜汁。真菌第一主成分方差贡献率和第二贡献率分别为61.08%和22.7%,两个主成分覆盖泡菜汁样品中真菌83.78%的OTU差异。原泡菜汁与0.05 μm陶瓷膜处理后的泡菜汁距离较远,表明经过0.05 μm陶瓷膜处理后真菌群落结果差异较大,而原泡菜汁与0.5 μm陶瓷膜处理后的泡菜汁样品聚集到一起,说明原泡菜汁与0.5 μm陶瓷膜处理后的泡菜汁真菌群落组成最相似,其次是0.2 μm陶瓷膜处理后的泡菜汁。
2.4.4 细菌和真菌群落多样性
分别从域、门、纲、目、科、属这6个水平对5个样品进行细菌群落、真菌群落分析。
在门分类水平上,原泡菜汁及经过不同孔径陶瓷膜处理泡菜汁细菌的分类情况见图6中(a),其中厚壁菌门(Firmicutes)在原泡菜汁、0.5 μm陶瓷膜处理后的泡菜汁、0.2 μm陶瓷膜处理后的泡菜汁、0.05 μm陶瓷膜处理后的泡菜汁中占优势,丰度分别为44.41%、66.35%、98.38%、99.36%;变形菌门(Proteobacteria)在原泡菜汁、0.5 μm陶瓷膜处理后的泡菜汁中占优势丰度分别为21.59%、18.56%,0.2 μm和0.05 μm陶瓷膜处理后的泡菜汁未检测到;Actinobacteriota在原泡菜汁、0.5,0.2,0.05 μm陶瓷膜处理后的泡菜汁中丰度分别为7.47%、6.25%、0%、0%;Bacteroidota在各个样品中的丰度分别为2.64%、3.9%、1.42%、0%;绿弯菌门(Chloroflexi)在各个样品中的丰度分别为11.87%、0.54%、0%、0%; Gemmatimonadota在各个样品中的丰度分别为5.43%、0.03%、0%、0%;而拟杆菌门(Bacteroidota)、Myxococcota和Acidobacteriota经陶瓷膜处理后均未检测到。He等[30]采用高通量测序技术对发酵酸菜中的微生物研究发现,发酵酸菜的优势菌为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),与本文结果相一致。
在属水平上,原泡菜汁及经过不同孔径陶瓷膜处理泡菜汁细菌的分类情况见图7中(a),其中乳酸杆菌属(Lactobacillus)在原泡菜汁、0.5 μm陶瓷膜处理后的泡菜汁、0.2 μm陶瓷膜处理后的泡菜汁、0.05 μm陶瓷膜处理后的泡菜汁中占优势,丰度分别为48.25%、70.89%、80.24%、95.02%;芽孢杆菌属(Bacillus)在各个样品中丰度分别为21.3%、18.69%、13.25%、2.98%;短波单胞菌属(Brevundimonas) 在各个样品中丰度分别为10.9%、7.2%、4.8%、1%;Pseudomonas在各个样品中丰度分别为2.56%、1.02%、0.5%、0.3%;Weissella在各个样品中丰度分别为2.01%、1.32%、0.6%、0.2%;Brevundimonas和黏液乳杆菌属(Limosilactobacillus)仅在原泡菜汁中检测出。Peng等[31]通过传统生物学培养方法和高通量测序发现发酵蔬菜中主要的优势菌群为植物乳杆菌(Lactobacillusplantarum)和发酵乳杆菌(Lactobacillusfermentum)。Pardali等[32]研究发现,自然发酵的萝卜泡菜发酵后期主要优势菌为植物乳杆菌,且有短乳杆菌被检出,与本文结果相一致。
在门水平上,原泡菜汁及经过不同孔径陶瓷膜处理的泡菜汁真菌的分类情况见图6中(b),其中子囊菌门(Ascomycota)在原泡菜汁、0.5 μm陶瓷膜处理后的泡菜汁、0.2 μm陶瓷膜处理后的泡菜汁占优势,丰度分别为70.93%、76.9%、82.01%;担子菌门(Basidiomycota)在各个样品中分别占23.99%、20.1%、17.85%;毛霉门(Mucoromycota)在各个样品中分别占3.69%、2.1%、0%。经0.05 μm陶瓷膜处理后的泡菜汁中未检测出真菌。Chen等[33]研究泡菜发酵中有子囊菌门(Ascomycota)和担子菌门(Basidiomycota)等真菌的存在。
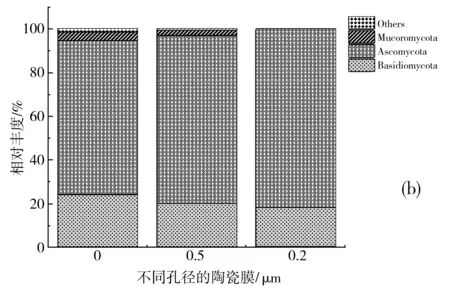
图6 不同孔径的陶瓷膜处理后泡菜汁中细菌(a)和真菌(b)在门水平群落组成 Fig.6 The compostion of bacterial (a) and fungal (b) community in pickle juice treated with ceramic membranes with different pore sizes at the phylum level
在属水平上,原泡菜汁及经过不同孔径陶瓷膜处理的泡菜汁细菌真菌分类情况见图7中(b),毕赤酵母属(Pichia)在原泡菜汁、0.5 μm陶瓷膜处理后的泡菜汁、0.2 μm陶瓷膜处理后的泡菜汁丰度分别为40.9%、31.5%、25.8%;锁掷孢酵属(Sporidioboluspararoseus)在各个样品中占比分别为28.6%、39.9%、60.2%;掷孢酵母属(Sporobolomycescarnicolor)在各个样品中占比分别为26.8%、25.4%、12.7%,曲霉属(Aspergillus)、Saccharomyces和Issatchenki仅在原泡菜汁中检出。Guan等[34]对广西酸笋和广西泡菜中的微生物多样性研究发现优势真菌为酵母菌,与本文泡菜中的优势菌结果相一致。
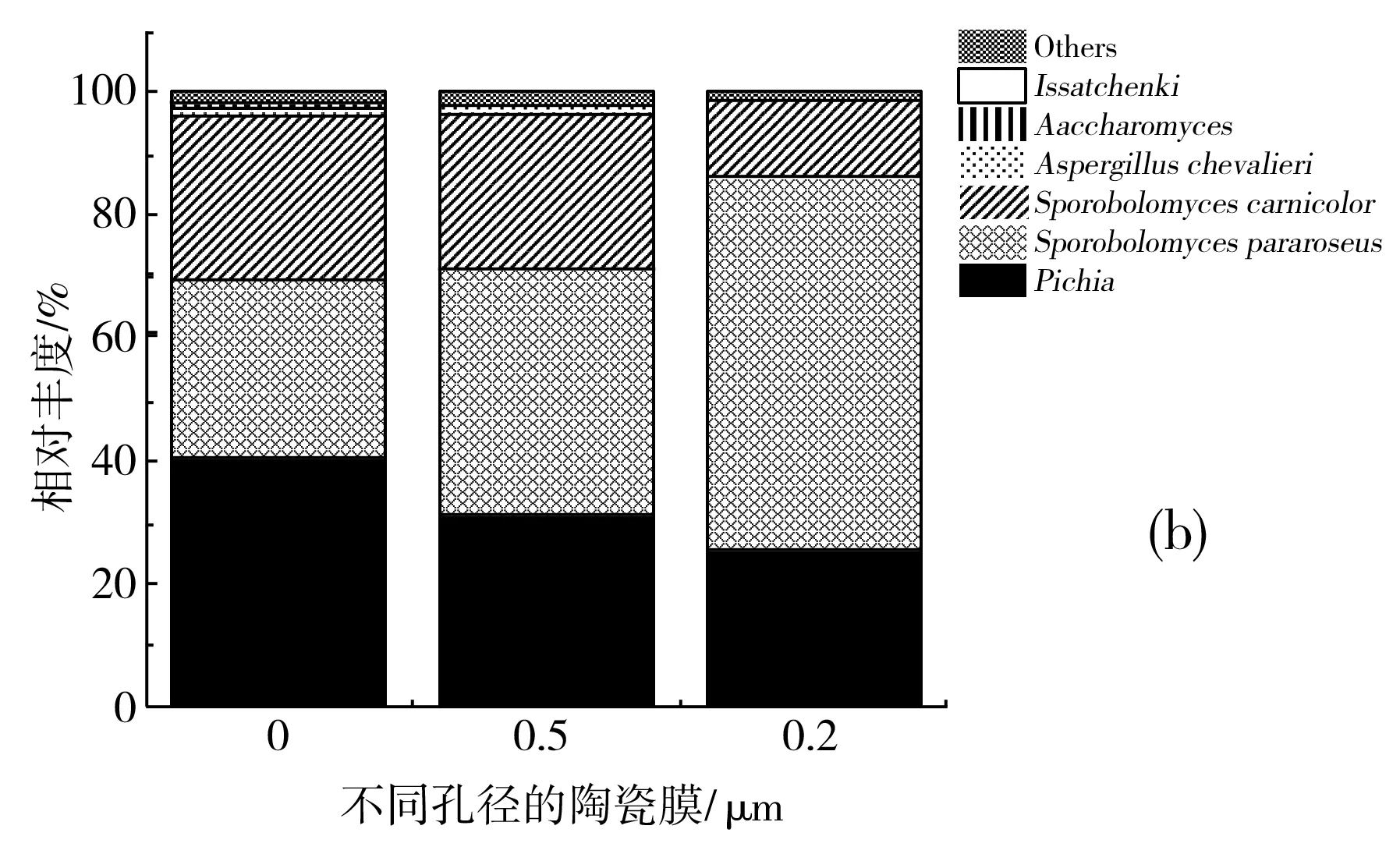
图7 不同孔径的陶瓷膜处理后泡菜汁中细菌(a)和真菌(b)在属水平群落组成 Fig.7 The compostion of bacterial (a) and fungal (b) community in pickle juice treated with ceramic membranes with different pore sizes at the genus level
采用高通量测序技术,经过0.008 μm陶瓷膜处理后的泡菜汁未检测到微生物。经过0.05 μm陶瓷膜处理后,泡菜汁中的细菌大部分被截留,从门水平上包括Actinobacteriota、Myxococcota、Gemmatimonadota、Chloroflexi、Bacteroidota和Acidobacteriota,从属水平上包括Limosilactobacillus、Brevundimonas;真菌被截留,从门水平上包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和毛霉门(Mucoromycota),从属水平上包括毕赤酵母属(Pichia)、锁掷孢酵属(Sporidioboluspararoseus)、掷孢酵母属(Sporobolomycescarnicolor)、曲霉属(Aspergillus)、Saccharomyces和Issatchenki。
采用传统微生物学培养方法,经过0.008 μm陶瓷膜处理后的泡菜汁,未能成功分离鉴定出微生物。经过0.05 μm陶瓷膜处理后,泡菜汁中的细菌大部分被截留,包括蜡样芽孢杆菌(Bacilluscereus)、婴儿芽孢杆菌(Bacillusinfantis)、蝉杆菌(Bacillusciccensis)、放线菌(Actinobacteriabacterium)、马赛短芽孢杆菌(Brevibacillusmassiliensis)、橙色短波单胞菌(Brevundimonasaurantiaca)、堀越氏芽孢杆菌(Bacillushorikoshii)、Bacillusgottheilii、Brevundimonascaseigenomic、坚强芽孢杆菌(Bacillusfirmus)及丝状芽孢杆菌(Bacillusfilamentosus);真菌分别是谢瓦曲霉(Aspergilluschevalieri)、卡尼克酵母菌(Sporobolomycescarnicolor)、锁掷孢酵母菌(Sporidioboluspararoseus)和库德里阿兹威毕赤酵母菌(Pichiakudriavzevii)。
3 结论
通过传统培养方法和高通量测序技术结合较真实、全面地分析不同孔径陶瓷膜处理对泡菜汁中微生物截留的种类的差异性及菌相的变化。结果显示:经不同孔径陶瓷膜处理后,泡菜汁中细菌和真菌的多样性降低,膜孔径越小微生物被截留的效果越好。泡菜汁中细菌和真菌群落组成差异性较大, 孔径为0.008 μm 和0.05 μm的陶瓷膜对微生物有良好的截留作用。0.05 μm陶瓷膜处理后的泡菜汁虽然有微生物检出,但都是乳酸菌以及一些本身无毒、无害、无污染且具有一定抑菌效果的细菌,而且0.05 μm陶瓷膜的膜通量远远高于0.008 μm陶瓷膜。综上所述,可选择0.05 μm 陶瓷膜应用于泡菜汁的膜处理。
