控制性低中心静脉压技术对腹腔镜肝切除术患者脑氧饱和度的影响*
2022-05-06吕华燕胡崇辉蓝志坚
吕华燕,胡崇辉,蓝志坚
(浙江大学金华医院麻醉科,浙江金华321000)
目前,腹腔镜下肝切除术已广泛应用于临床,此手术的最大风险是发生大出血。腹腔镜肝切除术治疗肝细胞癌中国专家共识(2020版)[1]推荐术中使用控制性低中心静脉压(controlled low central venous pressure,CLCVP)技术,可最大限度地减少术中出血量。虽然CLCVP 技术的安全性在很多研究中得到证实,但是罕见的严重神经系统并发症仍有报道[2]。实现CLCVP 的主要措施是限制循环血容量和扩大血管容积,获得CLCVP的同时伴随动脉血压降低,心、脑和肾等重要器官会不可避免地处于不同程度的低灌注,加上术中需要使用反Trendelenburg 体位,即约30°头高脚低位,该体位会导致脑血供进一步减少,故而增加了患者神经系统并发症的风险[3-4]。
使用近红外光谱仪测得的脑氧饱和度(cerebral oxygen saturation,rSO2)是脑低灌注的敏感指标,其能够连续无创地反映脑组织缺血缺氧状态,立即识别术中患者脑去氧饱和事件(cerebral desaturation events,CDE),现已广泛应用于评估高风险手术(存在神经系统并发症)中的CDE 发生率,如:心脏外科、肝移植和胸外科等手术[5]。运用CLCVP技术的腹腔镜肝切除术,术中存在脑低灌注的风险,但临床上关于该类患者术中rSO2的研究较少。本研究拟在采用CLCVP 技术的腹腔镜肝切除术患者中,使用rSO2评估该类患者术中CDE 的发生情况,并了解术后早期恢复情况。
1 资料与方法
1.1 一般资料
选择2019年11月-2021年1月在浙江大学金华医院行择期腹腔镜下肝切除术的患者94 例,采用随机数表法分为CLCVP 组(A 组)和非CLCVP 组(B组),各47 例。年龄38~76 岁,体重46~94 kg,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ级或Ⅱ级。A 组1 例患者术中因脏器粘连严重中转开腹,1例患者术中不能维持收缩压(systolic blood pressure,SBP) ≥90 mmHg,终止使用CLCVP 技术,予以排除,最终纳入45 例;B 组有1 例患者术中出血量大于1 000 mL,予以排除,最终纳入46例。两组患者一般情况比较,差异无统计学意义(P>0.05),具有可比性。见表1。纳入标准:心功能、肝肾功能未见明显异常者;未合并脑血管疾病者。排除标准:术中中心静脉压(central venous pressure,CVP)不能达到目标范围或术中不能维持SBP ≥90 mmHg者;严重腹腔脏器粘连者;大出血(出血量≥1 000 mL)者;中转开腹者。本研究已获医院伦理委员会批准(No:2019伦审第168号),并与患者及家属签署知情同意书。
1.2 处理方法
1.2.1 麻醉诱导入室后常规面罩吸氧,监测生命体征,开放外周静脉,局麻下行桡动脉穿刺及右侧颈内静脉穿刺,置入双腔颈内静脉导管,分别监测有创动脉血压及CVP。采用FORESIGHT 近红外线光谱仪(CAS 公司,美国)监测患者rSO2,将电极分别置于前额两侧,眉弓上缘约1 cm。麻醉诱导:依次静脉注射舒芬太尼0.8 μg/kg、依托咪酯0.3 mg/kg和顺苯磺酸阿曲库铵0.3 mg/kg。气管插管后行机械通气,设定潮气量8 mL/kg,吸呼比1∶2,调节通气频率使呼气末二氧化碳分压(partial pressure of end-tidal carbondioxide,PetCO2)维持在35~45 mmHg。麻醉诱导后和手术开始前采用反Trendelenburg 体位,约30°头高脚低位。
1.2.2 A 组采用限制性补液减少循环血容量、利尿、扩张容量血管等方法,将CVP控制在5 cmH2O以内,在切肝前严格控制输液量,输入液体为乳酸钠林格氏液。在麻醉诱导前输液量控制在100~250 mL,麻醉诱导后至肝实质完全离断前控制在1.0~2.0 mL/(kg·h)。手术开始后分离肝脏时,根据患者CVP给予适量利尿剂,以进一步减少循环血容量,如果还不能达到目标值,在切肝前以0.5~1.5 μg/(kg·min)的速率静脉泵注硝酸甘油,将CVP控制至目标范围。在控制CVP 的过程中,如SBP 低于90 mmHg 超过1 min,给予静脉注射升压药(麻黄碱5 mg 或去氧肾上腺素100 μg)。当尿量少于20 mL/h 或SBP 低于90 mmHg 超过1 min 发生3 次时,用200 mL 液体冲击治疗。肝切除完毕并完成止血后,输液速度提升至1 000~1 500 mL/h,快速恢复血容量,使CVP恢复至5 cmH2O以上。
1.2.3 B 组术中以8~10 mL/(kg·h) 的速度按2∶1 的比例输入晶体液和胶体液,使CVP 维持在正常范围(6~12 cmH2O)。术中给予瑞芬太尼、顺苯磺酸阿曲库铵和丙泊酚维持麻醉,使用脑电双频指数(bispectral index,BIS)监测麻醉深度,控制BIS值在45~65。
1.2.4 CDE术毕拔除气管导管后送麻醉后监测治疗室(post-anesthesia care unit,PACU)。rSO2基础值为诱导插管后患者情况平稳[平卧位,平均动脉压(mean arterial pressure,MAP)波动不超过基础值的20%, PetCO2为35~45 mmHg, 吸入氧浓度为50%]1 min内rSO2的平均值[6]。CDE为rSO2下降≥基础值的20%或≤55%。当发生CDE 时,可采取静脉注射升压药(麻黄碱5 mg 或去氧肾上腺素100 μg)或用液体冲击治疗。
1.3 观察指标
观察两组患者术前(T0)、麻醉诱导气管插管后5 min(T1)、患者置于30°头高脚低位后5 min(T2)、手术切皮后5 min(T3)、切肝前5 min(T4)(A 组实施CLCVP,CVP 控制在5 cmH2O 以内,B 组维持CVP在正常范围)、切肝结束后5 min(T5)和术毕(T6)的血流动力学变化情况,记录rSO2和血管活性药物使用情况。记录CDE 的发生情况,记录拔管时间、PACU 复苏时间、PACU 复苏时视觉模拟评分(visual analogue scale,VAS)≥4分、术后躁动、恶心和呕吐的发生情况。拔管时间:从术毕停用麻醉药物至患者拔除气管导管的时间。
1.4 统计学方法
选用SPSS 25.0 统计软件分析数据,样本量采用PASS 11.0.10 计算,根据预实验,A 组术中低rSO2发生率约为25%,B 组约为5%,设置检验水准为0.05,检验效能为0.8,估计样本量约94 例。计量资料经Shapiro-Wilk 检验符合正态分布,以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,组内各时点比较采用重复测量方差分析;计数资料以例(%)表示,采用χ2检验或Fisher 确切概率法。采用多因素Logistic 回归分析筛选腹腔镜肝切除术患者术中恶心和呕吐发生的危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者围术期相关指标比较
两组患者手术时间、麻醉时间、拔管时间、复苏时间、术中输注晶体液及胶体液、术中出血量及尿量无明显差异。见表2。
表2 两组患者围术期相关指标比较 (±s)Table 2 Comparison of perioperative related indexes between the two groups (±s)
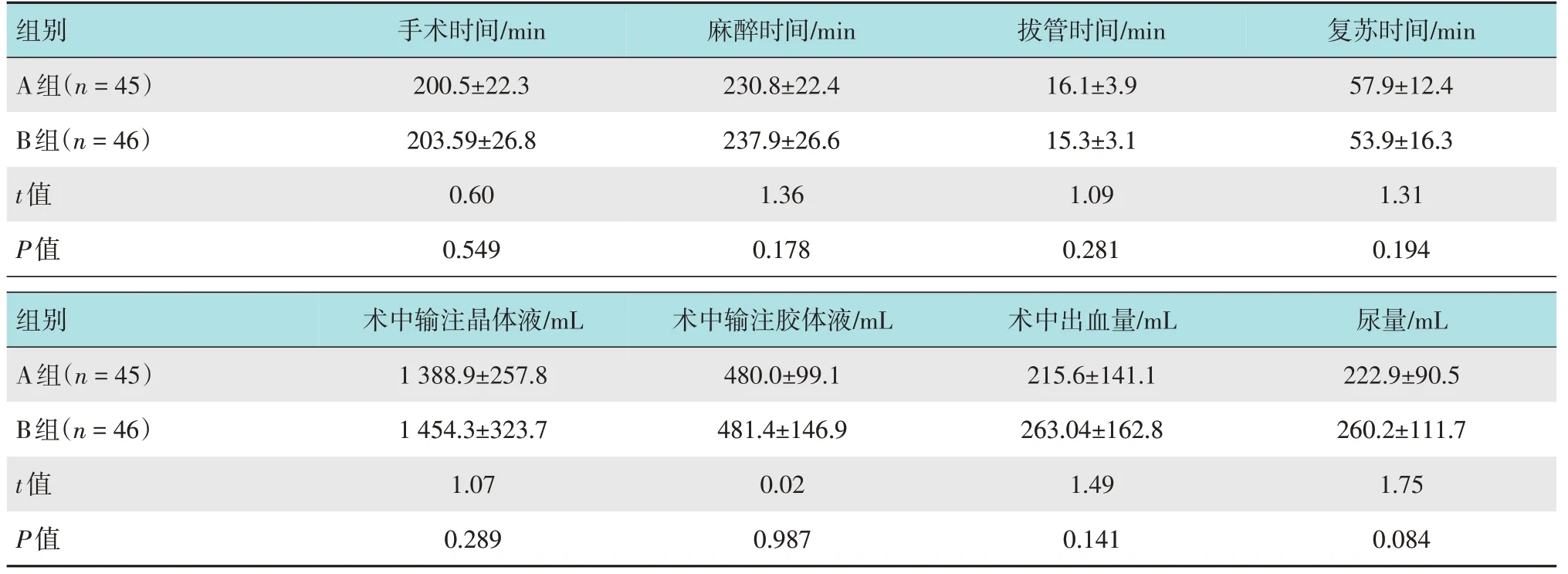
表2 两组患者围术期相关指标比较 (±s)Table 2 Comparison of perioperative related indexes between the two groups (±s)
组别A组(n=45)手术时间/min 200.5±22.3麻醉时间/min 230.8±22.4拔管时间/min 16.1±3.9复苏时间/min 57.9±12.4 B组(n=46)t值P值203.59±26.8 0.60 0.549 237.9±26.6 1.36 0.178 15.3±3.1 1.09 0.281 53.9±16.3 1.31 0.194组别A组(n=45)术中输注晶体液/mL 1 388.9±257.8术中输注胶体液/mL 480.0±99.1术中出血量/mL 215.6±141.1尿量/mL 222.9±90.5 B组(n=46)t值P值1 454.3±323.7 1.07 0.289 481.4±146.9 0.02 0.987 263.04±162.8 1.49 0.141 260.2±111.7 1.75 0.084
2.2 两组患者不同时点血流动力学及rSO2变化情况
两组患者的MAP 在T4、T5和T6时点均较T0时点低,且在T4时点A 组MAP 下降更明显,差异有统计学意义(P<0.05)。A 组T1、T2、T3和T4时点心率(heart rate,HR)较B 组更快,差异有统计学意义(P<0.05)。两组患者CVP 在T2、T4和T5时点较T0时点低,且在T4和T5时点A组明显更低,差异有统计学意义(P<0.05)。两组患者的rSO2在T4、T5和T6时点较T1时点降低,且A组降低更明显,差异有统计学意义(P<0.05)。见表3。
表3 两组患者不同时点血流动力学及rSO2变化情况比较 (±s)Table 3 Comparison of perioperative hemodynamics and rSO2 changes between the two groups (±s)
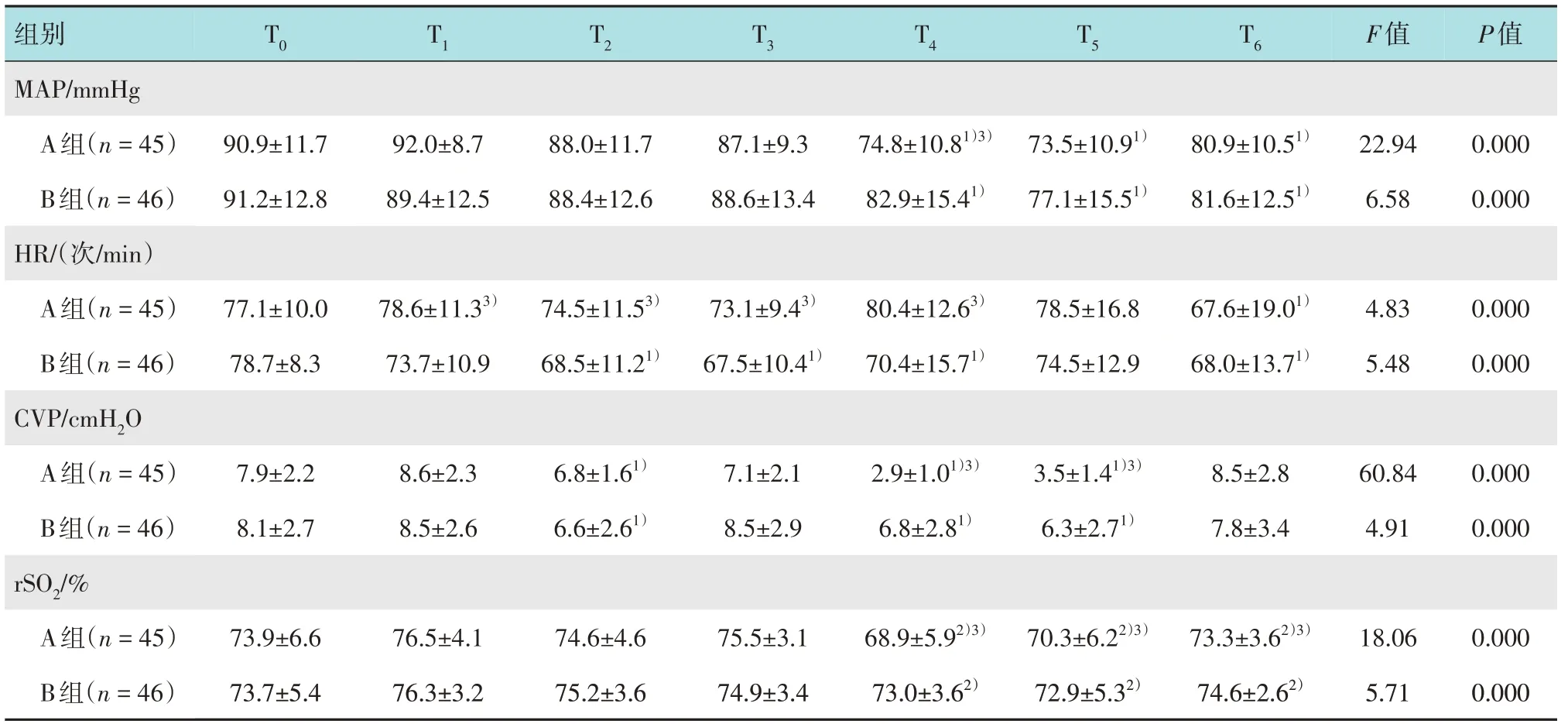
表3 两组患者不同时点血流动力学及rSO2变化情况比较 (±s)Table 3 Comparison of perioperative hemodynamics and rSO2 changes between the two groups (±s)
注:1)与T0比较,差异有统计学意义(P<0.05);2)与T1比较,差异有统计学意义(P<0.05);3)与B组比较,差异有统计学意义(P<0.05)
组别T0 T1 T2 T3 T4 T5 T6 F值P值MAP/mmHg A组(n=45)B组(n=46)90.9±11.7 91.2±12.8 92.0±8.7 89.4±12.5 88.0±11.7 88.4±12.6 87.1±9.3 88.6±13.4 74.8±10.81)3)82.9±15.41)73.5±10.91)77.1±15.51)80.9±10.51)81.6±12.51)22.94 6.58 0.000 0.000 HR/(次/min)A组(n=45)B组(n=46)77.1±10.0 78.7±8.3 78.6±11.33)73.7±10.9 74.5±11.53)68.5±11.21)73.1±9.43)67.5±10.41)80.4±12.63)70.4±15.71)78.5±16.8 74.5±12.9 67.6±19.01)68.0±13.71)4.83 5.48 0.000 0.000 CVP/cmH2O A组(n=45)B组(n=46)7.9±2.2 8.1±2.7 8.6±2.3 8.5±2.6 6.8±1.61)6.6±2.61)7.1±2.1 8.5±2.9 2.9±1.01)3)6.8±2.81)3.5±1.41)3)6.3±2.71)8.5±2.8 7.8±3.4 60.84 4.91 0.000 0.000 rSO2/%A组(n=45)B组(n=46)73.9±6.6 73.7±5.4 76.5±4.1 76.3±3.2 74.6±4.6 75.2±3.6 75.5±3.1 74.9±3.4 68.9±5.92)3)73.0±3.62)70.3±6.22)3)72.9±5.32)73.3±3.62)3)74.6±2.62)18.06 5.71 0.000 0.000
2.3 两组患者手术相关情况比较
A组较B组有更高的CDE发生率和升压药物使用率,差异有统计学意义(P<0.05)。两组患者术后疼痛、躁动、恶心和呕吐发生率比较,差异均无统计学意义(P>0.05)。综合考虑恶心及呕吐发生率,A组较B 组更高,差异有统计学意义(26.7%和8.7%,χ2=5.07,P=0.024)。见表4。
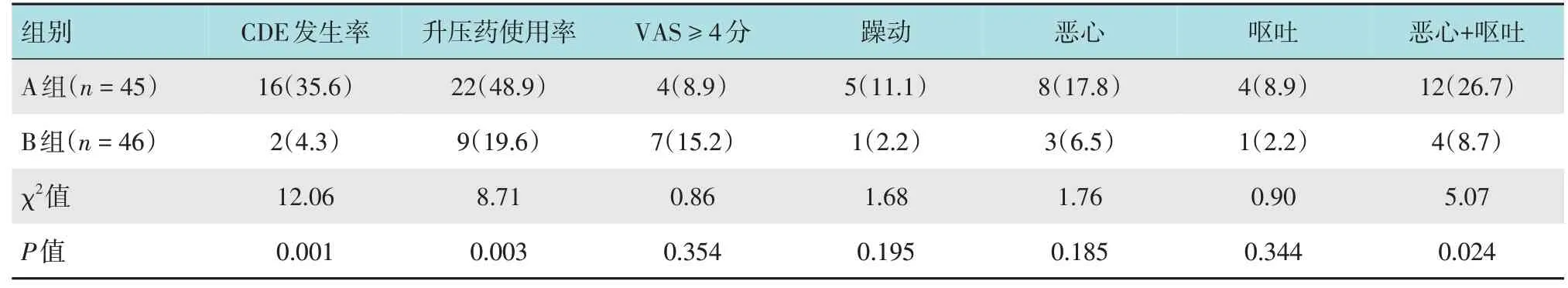
表4 两组患者不良反应情况比较 例(%)Table 4 Comparison of adverse effects between the two groups n(%)
2.4 影响患者术后恶心呕吐的多因素分析
纳入组别、性别、年龄、术中发生CDE、术中低血压(SBP 低于90 mmHg 1 min 发生3 次及以上)等因素,构建多因素Logistic回归分析方程。结果发现:术中低血压及发生CDE 对腹腔镜肝切除术患者术后发生恶心和呕吐无明显影响(P>0.05)。见表5。

表5 腹腔镜肝切除术患者术后恶心呕吐多因素Logistic分析Table 5 Multivariate Logistic analysis of postoperative nausea and vomiting in patients undergoing laparoscopic hepatectomy
3 讨论
运用近红外光谱学方法对大脑局部区域混合血进行rSO2测定,可很好地反映局部脑氧供需平衡情况,常用于心胸外科、神经外科和器官移植手术中。近年来,其在骨科手术中的运用亦逐渐增多[7]。有研究[8]显示,通过rSO2监测并进行早期干预,可降低神经系统并发症发生率。腹腔镜肝切除术中使用CLCVP 技术及反Trendelenburg 体位,可能使患者脑灌注压下降,从而使神经系统并发症的风险增加。目前,rSO2技术在腹腔镜肝切除术中的应用较少。本研究显示,在运用CLCVP 技术的腹腔镜肝切除术患者中,CDE事件的发生率为35.6%,较普通腹腔镜肝切除术高。两组患者rSO2在T4、T5和T6时点较T1时点降低,且A组降低更明显,差异有统计学意义(P<0.05)。
有研究[9]显示,围术期rSO2可能受一些因素影响,如:使用麻醉药物、麻醉方式、麻醉深度、吸入氧浓度、PetCO2水平、血红蛋白、手术体位和血压等。本研究中两组患者均采用全凭静脉麻醉,术中运用BIS监测麻醉深度,尽量将其维持在45~65,术中吸入氧浓度维持在50.0%,PetCO2尽量控制在35~45 mmHg,术前术后血红蛋白无明显差别,术中采用相同的手术体位。本研究采用了严格的条件,尽量控制术中血流动力学平稳,但A组术中HR较B组更快,MAP较B组更低(A组在T1、T2、T3和T4时点HR较B组更快,在T4时点MAP 更低),差异有统计学意义。本研究还发现,两组患者rSO2下降的时点刚好与MAP 下降的时点吻合,两者关系密切,可能与MAP是决定脑灌注压和脑氧供的直接因素有关[10]。
有研究[11]表明,腹腔镜手术反Trendelenburg体位会导致患者术中MAP 及双侧大脑中动脉脑血流速度降低。本研究发现,两组患者由平卧位改为反Trendelenburg 体位后(从T1到T2),两组患者CVP 平均下降1.9 cmH2O,而MAP 及rSO2无明显变化,与国外研究[12]结果一致。目前,较多的研究[6-13]显示沙滩椅位会导致患者术中rSO2下降, 而探讨反Trendelenburg体位对rSO2影响的研究不多,尚需进一步的研究。
笔者观察了两组患者术后早期恢复情况,A组躁动发生较B组多,但差异无统计学意义。A组恶心及呕吐总发生率较B 组多,差异有统计学意义。有研究[13]提出,在麻醉复苏期间术中发生CDE是导致患者恶心和呕吐的独立危险因素。笔者初步探讨了两组患者术后恶心和呕吐的危险因素,纳入组别、性别、年龄、术中发生CDE 及术中低血压等因素,构建多因素Logistic 回归分析方程,结果显示:术中发生CDE和低血压对腹腔镜肝切除术患者术后恶心和呕吐无明显影响,但可能与本研究病例数较少有关。笔者难以对更多影响因素进行全面的探讨,仍需进一步研究来佐证。近红外光谱仪监测rSO2,可反映脑灌注及脑组织氧合情况,但在非心脏手术,特别是全身麻醉下的常规手术中,其作用未被证实。
综上所述,运用CLCVP技术的腹腔镜肝切除术,较常规腹腔镜肝切除术可明显降低患者术中rSO2,增加术中CDE发生率。
