瓜表皮有刺毛和无刺毛佛手瓜转录因子SeTTG1的分离及表达分析
2022-05-06谭国飞吴小玉王孝敬李裕荣钟秀来孟平红
谭国飞,吴小玉,罗 庆,王孝敬,李裕荣,钟秀来,孟平红*
(1贵州省农业科学院园艺研究所,贵阳 550006;2安顺学院农学院,安顺 561000;3贵州大学茶学院,贵阳 550025)
佛手瓜(Sechium edule)别名捧瓜、安南瓜、丰收瓜、寿瓜、洋瓜等,是一种多年生具蔓性的葫芦科佛手瓜属草本植物。佛手瓜原产于中美洲、墨西哥及印度群岛,19世纪初传入中国[1]。佛手瓜在中国多地均有种植,在山东省,佛手瓜产量在67 500 kg/hm2以上,产品销往全国各大城市[2]。伴随山区佛手瓜栽培技术的提高,佛手瓜逐渐在贵州省部分地区大规模种植,种植面积达1.07万hm2,主要分布在贵州省惠水县、紫云县和织金县[3]。
佛手瓜营养丰富,富含锌、铁、钙、镁、维生素E、维生素C等多种有益于人体的维生素和矿物质[1]。另外,佛手瓜性凉味甘,归肺、胃、脾经,具有祛风解热,健脾开胃的功效,对风热犯肺、头痛、咽干、咳嗽、胃湿热诸症有一定的功效,适宜于消化不良、胸闷气胀、呕吐、肝胃气痛以及气管炎咳嗽多痰者食用[4]。佛手瓜清脆无怪味可作水果生吃,炒菜凉拌亦可煮汤、作馅等;其嫩梢、卷须、嫩叶可作为叶用菜食用,其地下块根肥大,也可食用。此外佛手瓜瓜形独特,分枝性强,具有蔓性,适于在庭院内作为观赏性棚架种植[5]。
佛手瓜瓜表皮有肉刺(皮刺)能够保护瓜不被外来生物侵害。但表皮有刺的佛手瓜不便于采摘、食用,尤其在运输途中瓜与瓜之间容易相互摩擦,不利于储存和销售,逐渐被表皮光滑无刺的佛手瓜种淘汰。研究表明,表皮毛的起始和发生由多个转录因子相互作用完成,特定转录因子,如GL2(GLABRA2)、GL3(GLABRA3)和TTG1(TRANSPARENT TESTA GLABRA 1)是细胞产生表皮毛的主要调节物[6-7]。其中,转录因子TTG1是影响植物茎、叶片、种子、果实等表皮毛发育的重要调控因子之一[7-8]。在绝大多数植物组织中,TTG1缺失的突变体无表皮毛,但当TTG1在植株中过表达时会使得原本没有根毛的表皮细胞上产生多余的根毛。刘凯歌等[9]研究表明,TTG1-1广泛存在于油菜营养组织和发育的种子中,在ttg1-13突变体背景下,异源表达TTG1-1能够恢复该突变体的多个表型。甘蓝型油菜TTG1-1与拟南芥TTG1在植物生长发育的多个生物学过程中具有类似的功能[9-10]。谭国飞等[8]研究表明,转录因子TTG1与胡萝卜种子刺毛的发育相关。在佛手瓜中,TTG1因子与瓜表皮的研究未见报道。本研究通过对分离的SeTTG1进行生物学分析,以期初步确定其与佛手瓜表皮刺毛发育的关系。
1 材料与方法
1.1 试验材料与种植
有刺佛手瓜来源于贵州省荔波县洞长村,无刺光滑的佛手瓜来源于贵州省都匀市茶农村。将2种佛手瓜材料种植于贵州省农业科学院园艺研究所,于2020年9月20日分别采集表皮有和无刺毛的佛手瓜根、茎、叶、瓜,快速切成小片段,装入50 mL冷冻管中,液氮速冻后-80℃超低温冰箱中保存。重复3次。
1.2 佛手瓜RNA提取与cDNA合成
使用RNA Simple Total RNA Kit(Tiangen,北京)试剂盒提取各材料的总RNA。用1.2%的琼脂糖凝胶检测总RNA完整性,用微量分光光度计Nanodrop 1000(Nanodrop Technologies Inc.,DE,USA)测定样品的总RNA浓度。使用PrimeScript RT Reagent Kit with a DNA Eraser Kit(Perfect Real-Time)(TaKaRa,日本)进行反转录。将产物保存于-20℃冰箱。
1.3 佛手瓜SeTTG1的克隆
以瓜皮有和无刺毛佛手瓜反转录成的cDNA为模板,根据贵州省农业科学院园艺研究所建立佛手瓜转录组数据库(未公布),以佛手瓜SeTTG1(序列编号:TRINITY_DN36982_c0_g1)为参考序列,设计引物(SeTTG1-F和SeTTG1-R,表1)克隆目的转录因子SeTTG1。反应体系为:15μLExTaq、1μL cDNA、正反引物各1.0μL、12μL灭菌的ddH2O。反应程序为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸3 min,34个循环;72℃延伸10 min;4℃保存。

表1 引物序列Table 1 Primers sequences
利用1.2%的琼脂糖凝胶分离目的条带,并用琼脂糖凝胶DNA回收试剂盒(DP209-180801,Tiangen)回收目的产物,将其连接到pMD18-T克隆载体上,热激法(42℃,60 s)转化到大肠杆菌DH5a上。利用含AMP(氨苄青霉素,100 mg/L)的平板筛选,倒置于37℃黑暗培养箱培养14 h后,挑取单菌落摇菌,进行PCR鉴定。鉴定正确的菌液送到南京金斯瑞生物科技有限公司测序。
1.4 佛手瓜SeTTG1的进化及其保守结构域分析
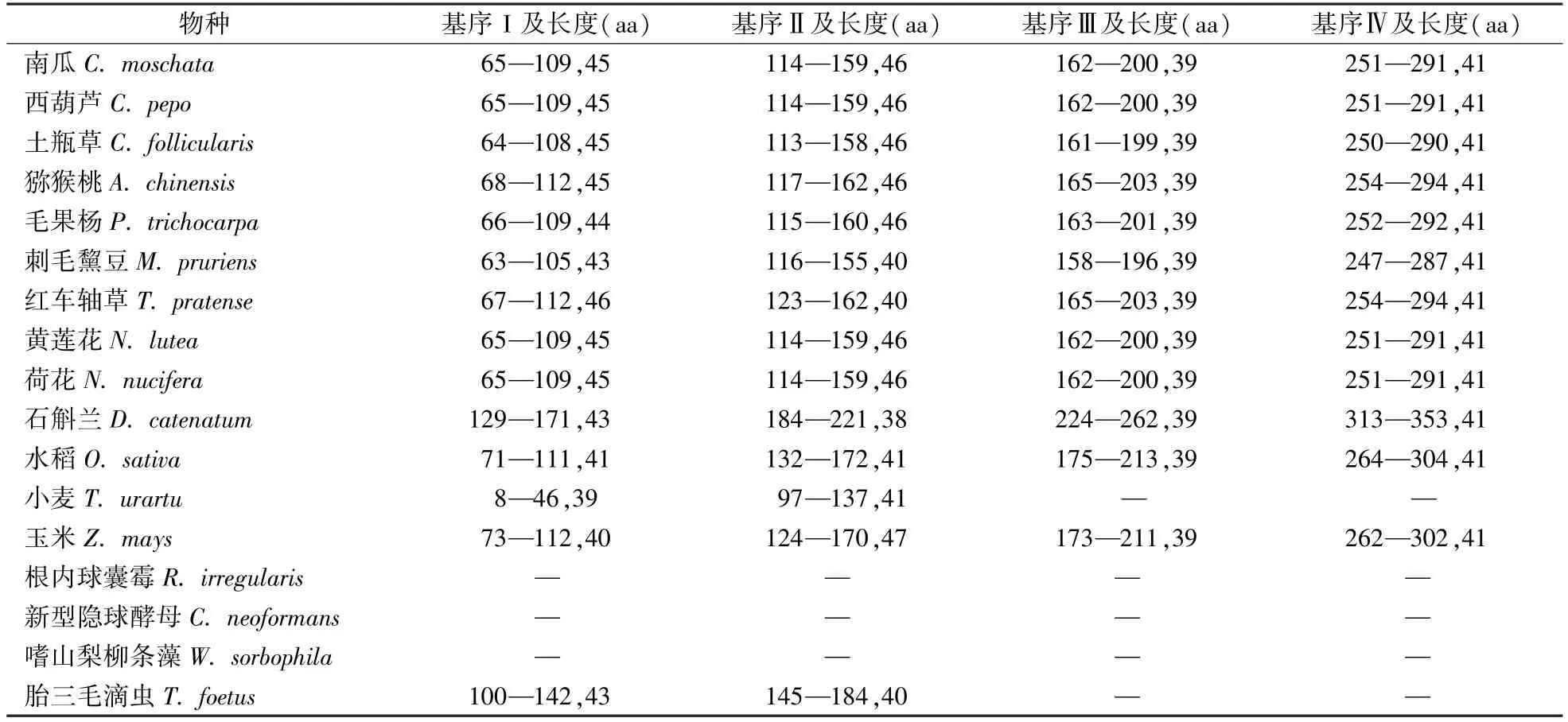
根据佛手瓜SeTTG1转录因子可翻译的阅读框,推导对应的氨基酸序列并翻译得到对应蛋白序列。下载NCBI蛋白数据库中刊载的30个其他物种(26个植物,3种真菌和1种原生生物,其中小麦TTG1为不完全序列)的TTG1序列(表2),用MEGA5.2软件邻接法(Neighbor Joining,NJ)构建系统进化树。Bootstrap检验值设为1 000[11]。利用SMART在线数据库(http://smart.embl-heidelberg.de/)分析各物种保守基序。

表2 各物种TTG1蛋白Table 2 TTG1 proteins from different species
1.5 佛手瓜不同部位SeTTG1的表达分析
设计引物(SeTTG1-qF和SeTTG1-qR,表1),利用实时荧光定量PCR检测2种佛手瓜不同部位SeTTG1转录因子的表达水平,所用仪器为CFX Connect PCR仪(Bio-Rad,Hercules,CA)。荧光PCR试剂盒为AceQ qRCR SYBR Green Master Mix(南京诺唯赞生物科技有限公司)。检测体系:10μL荧光酶,正反引物各0.5μL,7μL灭菌的ddH2O,2μL的cDNA。反应程序为:95℃30 min;95℃5 s,55℃10 s,40个循环;72℃2 min;8℃保存。以佛手瓜ACTIN为内参基因(引物为:ACTIN-qF和ACTIN-qR,表1)。
1.6 数据分析
SeTTG1表达数据分析参照基因相对定量ΔCT法,表达差异量为2-ΔCT,ΔCT=CT-Cactin。相对定量是基于处理和对照之间,目标基因对参考基因的表达量的比较[12]。用Microsoft Excel 2007软件作数据统计分析,用IBM Statistics 20.0软件作显著性分析,显著水平设置为P<0.05和P<0.01。
2 结果与分析
2.1 佛手瓜SeTTG1转录因子的分离
2种类型佛手瓜表皮形态上存在明显的差异(图1)。以2种类型佛手瓜获得的cDNA为模板,均克隆得到了1条ORF长度为1 026 bp的SeTTG1转录因子,但在421、466、594、683和780位点存在差异(图2)。

图1 表皮无刺(左)与表皮有刺(右)佛手瓜Fig.1 S.edule fruit with peel hairless(left)and peel hairy(right)geotypes

图2 表皮有和无刺毛佛手瓜SeTTG1转录因子序列比对Fig.2 Sequence alignment of SeTTG1 in S.edule fruit with peel hairless and peel hairy
2.2 佛手瓜SeTTG1氨基酸分析
对2种类型佛手瓜克隆得到的SeTTG1转录因子对应的蛋白序列分析,结果显示有3处存在差异,分别为141、156和228处(图3)。前人对植物TTG1氨基酸保守区域预测表明,植物中TTG1存在4个保守的WD40区域(Ⅰ、Ⅱ、Ⅲ和Ⅳ)[8,13]。SMART在线分析表明瓜皮有刺和无刺毛佛手瓜SeTTG1均含有4个WD40区域(图3)。

图3 表皮毛有和无佛手瓜SeTTG1蛋白序列比对Fig.3 Alignment of amino acid sequences of SeTTG1 in S.edule fruit with peel hairless and peel hairy
2.3 佛手瓜SeTTG1进化分析
佛手瓜为葫芦科植物,由图4可知,SeTTG1蛋白与葫芦科植物南瓜、黄瓜、西葫芦和苦瓜TTG1蛋白同源性较高;禾本科、豆科、莲科、蔷薇科植物关系较近;真菌中的3种生物与植物关系较远,单细胞原核生物位于进化树底端,与植物、真菌关系较远。

图4 不同物种TTG1蛋白进化树Fig.4 Phylogenetic tree of TTG1 proteins from different species
TTG1蛋白结构域分析表明,小麦(不完整序列)和胎三毛滴虫只有Ⅰ和ⅡWD40基序结构。根内球囊霉、新型隐球酵母和嗜山梨条藻等3个真菌中无WD40基序,表明植物与真菌及单细胞动物之间TTG1进化差异大。25种植物的第Ⅰ个WD40基序存在差异,豆科第Ⅱ个基序上为40个碱基,其余为46个,第Ⅲ和第Ⅳ个基序长度一致(表3)。说明TTG1在物种之间相对保守,在植物、真菌和单细胞生物中存在特异性。

表3 不同物种TTG1蛋白序列WD40基序及长度预测Table 3 Prediction of WD40 motifs and length of TTG1 proteins from different species
(续表3)
2.4 佛手瓜转录因子SeTTG1在不同部位表达分析
荧光定量PCR结果显示,2种佛手瓜根和叶中,SeTTG1表达水平无显著差异;在茎中SeTTG1在有刺毛佛手瓜中表达水平显著(P<0.05)高于无刺毛佛手瓜,为1.36倍;而在瓜中SeTTG1表达量在有刺毛中表达量极显著(P<0.01)高于无刺毛佛手瓜,为35.64倍(图5)。
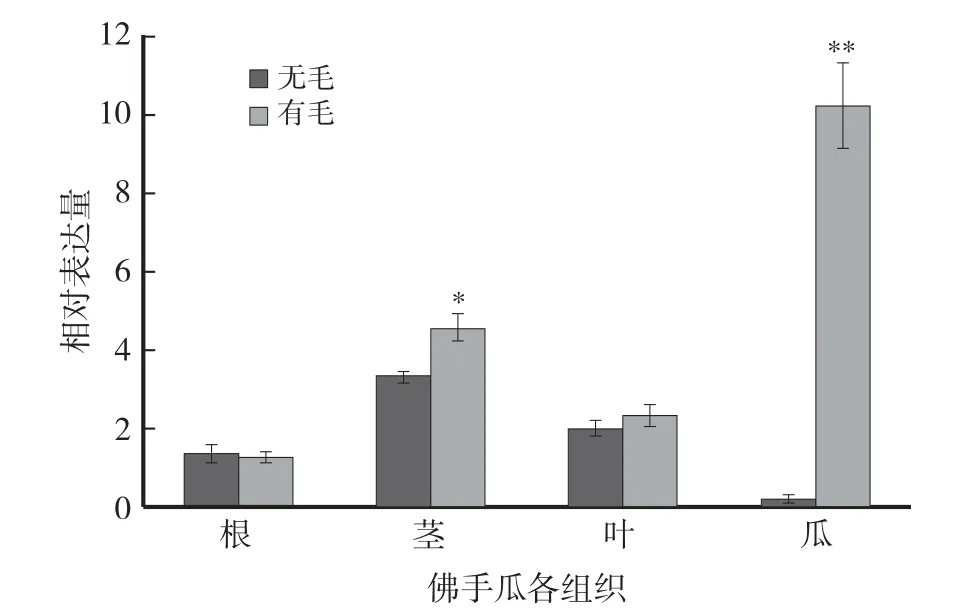
图5 瓜表皮有刺毛和无刺毛佛手瓜不同组织SeTTG1表达分析Fig.5 Different tissue expression analysis of SeTTG1 in S.edule fruit with peel hairless and peel hairy
3 讨论
表皮毛对植物抵抗不利的外界环境,如高温、低温、辐射、干旱、病虫害具有重要作用[7,14-16]。同时,植物表皮毛能够为人类提供特殊的产品,如棉纤维是人类重要的纤维来源[17];茶叶中叶片表皮毛(茶毫)能够分泌多酚、多糖物质,增加茶叶风味[18-19]。同时,植物表皮毛的存在也影响人类的健康生活,如悬铃木叶片表皮毛和种子毛、杨树及杨柳的柳絮等,已成为很多城市的主要污染物之一,可引起人类的呼吸道感染、肺部感染、发热和流感等[20]。而一些园艺产品,如白菜、芥菜、茄子、菠菜、胡萝卜、西红柿、花椒等,叶片、种子中刺毛的存在影响播种、采收及食用。为此,无刺毛品种的培育具有一定的现实意义[8,21-22]。
对贵州省主要种植区域进行调研发现,绝大部分种植的佛手瓜表皮光滑无刺。本研究中,有刺佛手瓜商品性状差,采摘易伤手,采摘后瓜与瓜之间易碰伤,且有刺的佛手瓜瓜表皮易木质化和纤维化,影响食用品质。植物TTG1作为调节表皮毛发育的主要转录因子之一,对植物叶、茎、种子、瓜等表皮刺毛的发育具有重要作用[7,23-25]。本研究中,在有刺毛和无刺毛瓜中,SeTTG1核苷酸序列有5个位点不同,推导氨基酸存在3处差异,有刺毛的瓜SeTTG1表达量极显著高于无刺毛的瓜。观察发现,在2种类型佛手瓜的叶、茎表皮中均含有表皮毛,但有刺毛的佛手瓜茎中表达量显著高于无刺毛佛手瓜,叶片中无差别。根毛作为植物表皮刺毛中的一部分,在2种类型瓜中均有表达,但无显著差异,本研究结果与胡萝卜种子DcTTG1表达分析结果相似[8]。说明佛手瓜中SeTTG1因子影响瓜皮刺毛的发生。
植物表皮毛的发育受到各种因素影响[7,14-16],在贵州栽培表皮无刺的佛手瓜过程中,特殊的天气下,如高温、低温、干旱等天气,瓜表皮刺毛易产生。将表皮无刺的佛手瓜品种种植在高海拔或者低海拔高温地区,其瓜皮上可能也会产生刺毛。佛手瓜在成熟过程中,特别是瓜表皮在老化过程中,往往也会形成一些明显的瓜表皮刺毛。为此,筛选性状稳定的无刺毛佛手瓜品种,将是新品种培育的方向之一。
