基于SIRT1-ERK1/2通路研究白藜芦醇对环孢菌素A诱导高血压的作用及机制
2022-05-06王钰莹史永恒刘继平
王 川,王钰莹,王 婷,史永恒,刘继平,王 斌,卫 昊,刘 航
基于SIRT1-ERK1/2通路研究白藜芦醇对环孢菌素A诱导高血压的作用及机制
王 川1, 2,王钰莹1,王 婷1,史永恒1, 2,刘继平1, 2,王 斌1, 2,卫 昊1, 2,刘 航3*
1.陕西中医药大学药学院,陕西 咸阳 712046 2.陕西省中医药管理局中药药效机制与物质基础重点研究室,陕西 咸阳 712046 3.陕西中医药大学附属医院,陕西 咸阳 712000
研究白藜芦醇对环孢菌素A(cyclosporine A,CsA)诱导高血压的作用及其机制。采用离体血管培养技术和微血管张力描记技术研究CsA对5-羟色胺(5-hydroxytryptamine,5-HT)介导的平滑肌收缩量效曲线变化。大鼠sc CsA诱导血压升高,给予白藜芦醇进行干预,研究白藜芦醇对血压的影响;采用微血管张力描记观察5-HT引起的动脉收缩量效曲线的变化;采用Western blotting检测5-HT1B受体、沉默信息调节因子1(sirtuin 1,SIRT1)、细胞外信号调节激酶1/2(extracellular regulated kinase 1/2,ERK1/2)蛋白表达。离体血管培养结果表明,白藜芦醇通过激活SIRT1-ERK1/2通路抑制CsA诱导的收缩。动物实验表明白藜芦醇可以显著降低CsA引起的血压升高(<0.05、0.01);抑制5-HT引起的收缩反应(<0.05、0.01);降低5-HT1B受体和p-ERK1/2蛋白表达(<0.05、0.01),增加SIRT1蛋白表达(<0.01)。白藜芦醇通过SIRT1-ERK1/2信号通路下调5-HT受体,从而抑制CsA诱导的高血压。
白藜芦醇;高血压;环孢菌素A;5-羟色胺;沉默信息调节因子1
环孢菌素A(cyclosporine A,CsA)是临床上常用于预防器官移植排斥的免疫抑制剂,可防止器官移植患者体内的免疫排斥,在器官移植治疗中发挥了重要的作用[1-2]。目前临床上CsA也被用于治疗类风湿性关节炎、再生障碍性贫血等自身免疫性疾病[3-6]。伴随着CsA的广泛使用,也暴露出较多的不良反应,高血压是CsA重要的不良反应,临床研究表明使用CsA的肾脏移植患者中高血压发生率高达20%~25%[7-8]。CsA可以引起人和动物的血压升高,然而其机制尚不清楚[9-10]。
5-羟色胺(5-hydroxytryptamine,5-HT)是一种内源性的神经递质,5-HT可以引起血管收缩,通过激活5-HT1B等受体介导血管收缩[11]。研究表明,在蛛网膜下腔出血、脑缺血以及高血压等病变中,5-HT1B受体的表达上调[12-13]。临床上化学药虽然降压效果显著、疗效肯定,但仍有部分患者血压不能得到有效的控制,也会产生一些严重的不良反应,如利尿降压药可引起电解质紊乱,血管紧张素转换酶抑制剂引起干咳,钙通道阻滞剂引起心率失常,α受体阻滞剂引起体位性低血压等[14-15]。某些中药单体、中药提取物和中药复方等均可降低血压,降压作用缓和,且可以改善各类症状[16-17];在降压的同时,还具有改善微循环、调血脂、抗氧化、保护血管内皮、调节血管活性物质等多重作用,具有广阔的应用前景。
白藜芦醇多存在于藜芦、虎杖、葡萄、花生等植物中,属于一种多酚类天然化合物,不仅有较强的心血管保护作用,还具有抗炎、抗氧化、抗菌、抗肿瘤、抗衰老和抗神经退行性疾病等重要的药理作用[18-21]。研究表明,白藜芦醇可以舒张血管、降低血压[22-23]。然而,白藜芦醇对CsA引起的高血压作用及其机制尚不清楚。本研究通过离体动脉培养模型和CsA诱导大鼠高血压模型,探究白藜芦醇对大鼠血压的影响及其相关机制,为CsA引起的高血压的预防和治疗提供新的思路与依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(200±20)g,6~8周龄,由西安交通大学实验动物中心提供,实验动物生产(使用)许可证号SCXK(陕)2020-001。动物饲养于陕西中医药大学中药药理实验室,室温(23±2)℃,光照周期为12 h,饲养期间动物自由进食饮水。动物实验经陕西中医药大学伦理委员会批准(批准号SUCMDL20201119001)。
1.2 药品与试剂
CsA(批号S17068)、白藜芦醇(批号S30630,质量分数为98%)购自上海源叶生物科技有限公司;5-HT(批号Slcf8396)、乙酰胆碱(acetyl choline,ACh,批号BCBX5660)、细胞外调节蛋白激酶1/2(extracellular regulated protein kinase 1/2,ERK1/2)特异性抑制剂U0126(批号19826)、Triton X-100(批号T8787)购自美国Sigma公司;5HT1B受体抗体(批号AB13896)、沉默信息调节因子1(sirtuin 1,SIRT1)抗体(批号AB12193)购自英国Abcam公司;ERK1/2(批号4695S)、磷酸化ERK1/2(phosphorylated ERK1/2,p-ERK1/2)抗体(批号4370S)购自美国CST公司;β-actin抗体(批号66009-1-Ig)购自武汉博士德生物工程有限公司;HRP标记的山羊抗兔二抗(批号A0280)购自上海碧云天生物技术有限公司;青霉素/链霉素溶液(批号J190033)购自美国HyClone公司。
1.3 仪器
CODA动物无创血压测量系统(美国Kent公司);DMT 630M型离体微血管张力测定系统(丹麦DMT公司);CO2培养箱(美国Thermo Fisher Scientific公司);肌张力描记记录系统(澳大利亚ADI公司);电泳仪、转膜仪、凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 肠系膜动脉血管离体培养
SD大鼠断颈处死,无菌条件下迅速分离出大鼠肠系膜,浸泡于经滤过除菌并预冷的Na+-PSS缓冲液(119 mmol/L NaCl、15 mmol/L NaHCO3、4.6 mmol/L KCl、1.2 mmol/L MgCl2、1.2 mmol/L NaH2PO4、1.5 mmol/L CaCl2和5.5 mmol/L葡萄糖)中,于体视显微镜下分离出肠系膜动脉,0.1% Triton X-100血管内灌注10 s,去除血管内皮,肠系膜动脉剪成2 mm的动脉环,放入24孔培养板内进行培养,每孔加入1 mL不含血清的DMEM高糖培养基,在培养基中加入CsA(1×10−6、1×10−5mol/L)或二甲基亚砜(dimethyl sulfoxide,DMSO)或U0126(1×10−6mol/L)或白藜芦醇(1×10−5、1×10−4mol/L)。培养板置于37 ℃、5% CO2的培养箱内,培养24 h。
2.2 离体培养的肠系膜血管收缩功能检测
将5 mL Na+-PSS加入恒温离体浴槽内,并将含95% O2和5% CO2的混合气体不断通入浴槽内,将分离的动脉环穿入2根20 μm的金属丝,其中一根金属丝与可调节预张力的张力微调装置相连,另一根连接张力换能器。固定好的动脉环平衡40 min后,每15分钟施加0.5 mN的预张力,直至2 mN,加入60 mmol/L K+-PSS缓冲液(119 mmol/L KCl、15 mmol/L NaHCO3、4.6 mmol/L KCl、1.2 mmol/L MgCl2、1.2 mmol/L NaH2PO4、1.5 mmol/L CaCl2和5.5 mmol/L葡萄糖)检验动脉环收缩活性,若动脉环在2次K+-PSS缓冲液中的收缩幅度均大于5 mN并且2次收缩差异低于10%时,该动脉环用于后续实验,使用ACh检测动脉环内皮是否完全去除。将5-HT受体特异性激动剂5-HT按浓度累加法的方式,由低至高浓度(1×10−8~1×10−4mmol/L)依次加入DMT浴槽中来观察大鼠血管收缩功能[24]。
2.3 动物分组、给药和造模
24只SD大鼠随机分为对照组、模型组和白藜芦醇低、高剂量(75、150 mg/kg)组,每组6只。除对照组sc大豆油外,其余各组sc CsA(25 mg/kg);各给药组再ig相应药物,对照组ig等体积0.5%羧甲基纤维素钠[9,25],1次/d,连续21 d。
2.4 大鼠无创血压测量
每周采用CODA无创血压仪测量系统记录大鼠清醒状态下尾动脉的收缩和舒张压,每个时间点重复测量15~30次,取其平均值。
2.5 大鼠肠系膜血管收缩功能检测
给药21 d后,大鼠处死,迅速取出肠系膜动脉,浸入预冷的Na+-PSS缓冲液中,于显微镜下快速剥离肠系膜动脉周围黏附组织,将分离的肠系膜动脉剪切成长约2 mm的动脉环,使用离体肌张力记录系统检测动脉张力的变化。
2.6 Western blotting检测5HT1B受体、ERK1/2、p-ERK1/2和SIRT1蛋白表达
取大鼠肠系膜动脉,加入RIPA裂解液提取总蛋白,采用BCA法检测样品蛋白含量,制备的蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于含5%脱脂牛奶的TBST中室温封闭2 h,分别加入相应一抗,4 ℃孵育过夜;加入二抗,室温孵育1 h,洗膜后用ECL发光试剂显影,检测目标条带的灰度值,分析相关蛋白表达。
2.7 统计学处理
3 结果
3.1 CsA对5-HT受体介导的收缩反应的影响
为了研究不同浓度的CsA对5-HT收缩的影响,将CsA(1×10−6、1×10−5mol/L)[26]分别与离体动脉血管共培养24 h,梯度累加法加入5-HT,获得累积浓度-反应曲线见图1,不同浓度的CsA均显著增强肠系膜动脉收缩功能,收缩量效曲线明显左移。与DMSO组相比,1×10−5mol/L CsA可以明显增强5-HT的收缩作用,Emax明显升高(<0.05、0.01)。

与DMSO组比较:*P<0.05 **P<0.01
3.2 U0126对5-HT受体介导的收缩反应的影响
为了考察ERK1/2通路是否参与了CsA诱导的肠系膜动脉收缩增强,在培养时加入特异性ERK1/2信号通路抑制剂U0126(1×10−6mol/L)与CsA共培养24 h[24],结果如图2-A所示,与CsA组相比,U0126可以显著抑制5-HT诱导的收缩反应(<0.05、0.01);Western blotting结果(图2-B)显示,与DMSO组比较,CsA组p-ERK1/2/ERK1/2蛋白表达水平显著升高(<0.01);与CsA组比较,U0126显著抑制p-ERK1/2/ERK1/2蛋白表达(<0.01)。表明ERK1/2-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路可能参与了CsA引起的血管收缩。

与DMSO组比较:*P<0.05 **P<0.01;与CsA组比较:#P<0.05 ##P<0.01
3.3 白藜芦醇对5-HT受体介导的收缩反应的影响
为了研究白藜芦醇对CsA诱导的血管平滑肌收缩功能的影响,将白藜芦醇(1×10−5、1×10−4mol/L)与CsA共培养24 h。如图3-A所示,与CsA相比,白藜芦醇显著抑制5-HT诱导的收缩反应(<0.01);Western blotting结果(图3-B)显示,CsA显著降低SIRT1蛋白表达水平(<0.05),而白藜芦醇(1×10−4mol/L)可以显著上调SIRT1蛋白表达水平(<0.05)。提示白藜芦醇可能通过激活SIRT1通路抑制CsA诱导的收缩。
3.4 白藜芦醇对CsA诱导大鼠血压的影响
为了研究白藜芦醇对CsA诱导的高血压大鼠收缩压和舒张压的影响,在给药前和给药期间平均每周测血压1次。如图4所示,给药前(第0周)各组大鼠收缩压和舒张压均无显著性差异;给药1周后,给予CsA后大鼠收缩压和舒张血压均升高,与对照组相比,第3周模型组收缩压和舒张压均有显著性差异(<0.01);与模型组相比,第3周白藜芦醇高剂量组大鼠收缩压与舒张压均显著降低(<0.05、0.01)。

与DMSO组比较:*P<0.05 **P<0.01;与CsA组比较:#P<0.05 ##P<0.01

与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同 1 mm Hg=133 Pa
3.5 白藜芦醇对5-HT介导的收缩反应和5-HT1B受体蛋白表达的影响
如图5-A和表1所示,与对照组比较,模型组5-HT介导的大鼠肠系膜动脉收缩反应明显增强(<0.01),Emax显著升高(<0.01);与模型组比较,白藜芦醇高剂量组显著抑制血管收缩反应量效曲线(<0.01),Emax显著降低(<0.01),表明白藜芦醇可以抑制CsA引起的血管收缩。Western blotting结果(图5-B)表明,与对照组比较,模型组5-HT1B受体蛋白表达水平明显升高(<0.01);与模型组比较,白藜芦醇高剂量组5-HT1B受体蛋白表达水平显著降低(<0.05)。
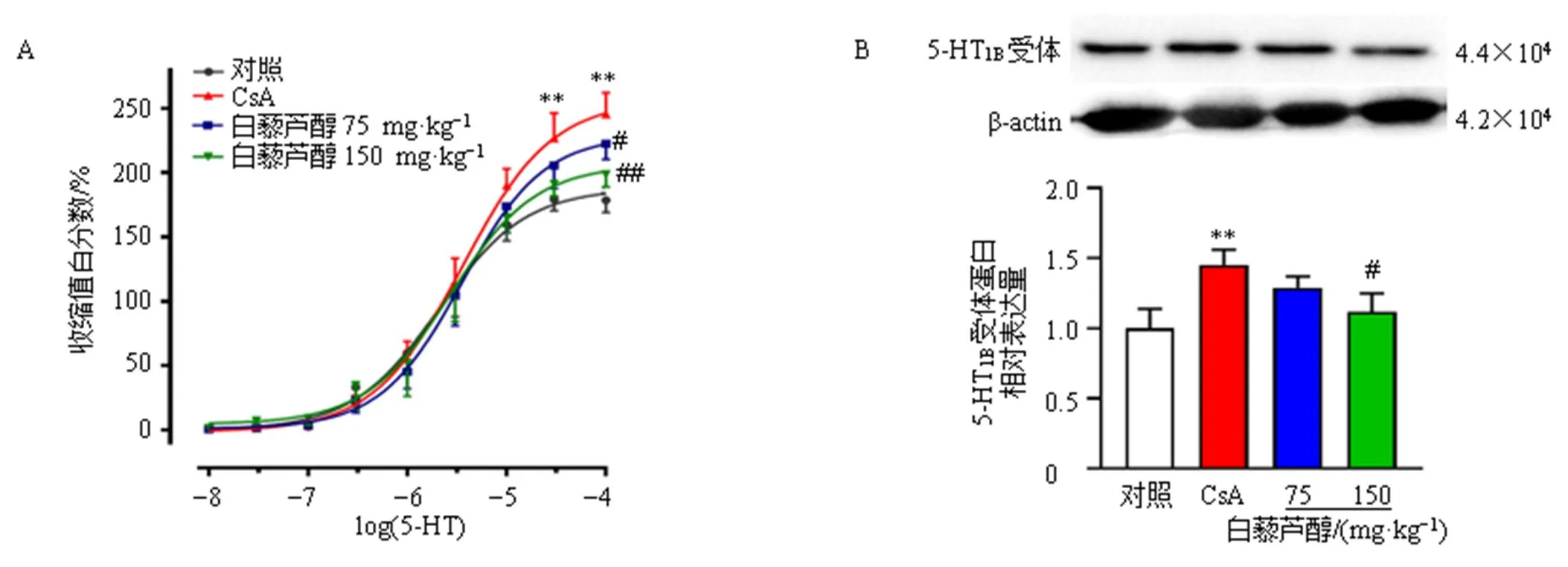
图5 白藜芦醇对5-HT介导的血管收缩反应(A)和5-HT1B受体蛋白表达 (B)的影响(n = 6)
表1 白藜芦醇对5-HT诱导动脉环收缩的Emax和pEC50的影响(, n = 6)
Table 1 Effect of resveratrol on Emax and pEC50 of 5-HT-induced arterial ring contraction (, n = 6)
组别剂量/(mg·kg−1)Emax/%pEC50 对照—187.90±11.065.680±0.098 模型—256.30±16.85**5.440±0.098* 白藜芦醇75228.80±16.12#5.450±0.100 150206.20±17.29##5.570±0.130#
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group
3.6 白藜芦醇对大鼠肠系膜动脉SIRT1、p-ERK1/2和ERK1/2蛋白表达的影响
为了研究SIRT1和ERK1/2通路是否参与了白藜芦醇降低大鼠肠系膜动脉高反应性的过程,检测了SIRT1和p-ERK1/2蛋白表达,如图6所示,与对照组比较,模型组SIRT1蛋白表达水平显著降低(<0.01),p-ERK1/2/ERK1/2蛋白表达水平显著升高(<0.01);与模型组比较,白藜芦醇高剂量组SIRT1蛋白表达水平显著升高(<0.01),白藜芦醇低、高剂量组p-ERK1/2/ERK1/2蛋白表达水平均显著降低(<0.05、0.01),表明SIRT1和ERK1/2- MAPK信号通路可能参与了白藜芦醇抑制CsA上调5-HT1B受体引起的血管收缩。
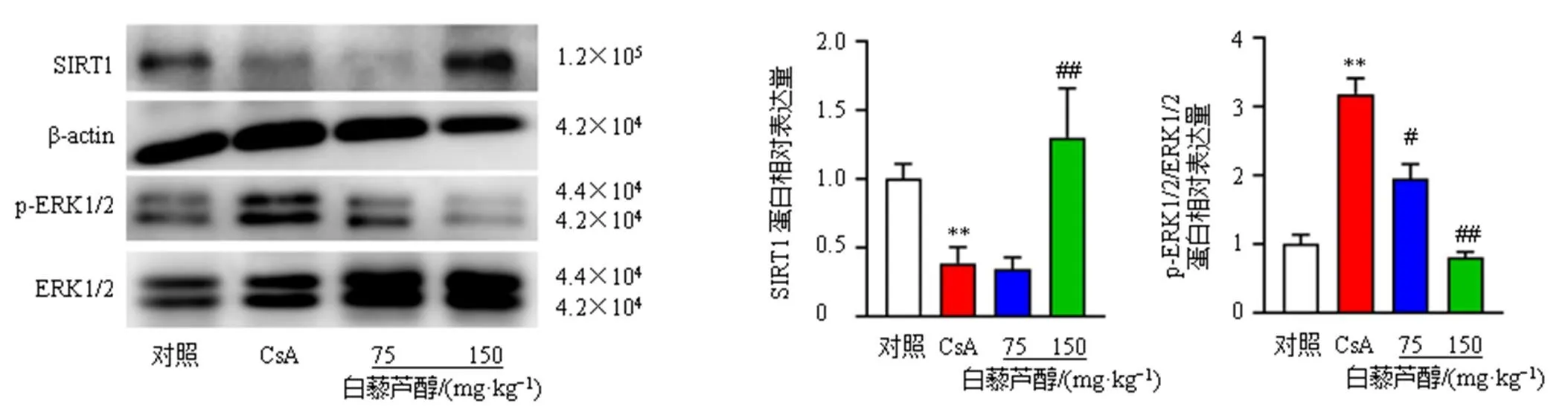
图6 白藜芦醇对大鼠肠系膜动脉SIRT1、p-ERK1/2和ERK1/2蛋白表达的影响(n = 6)
4 讨论
高血压是CsA临床使用中最常见的不良反应,高血压会促使左心室肥大、动脉粥样硬化、心力衰竭,高血压也通常会导致移植器官存活率大幅度下降,甚至可能导致死亡[27-28],因此,需要积极地干预CsA引起的高血压。白藜芦醇是一种多酚类化合物和植物抗毒素,作为SIRT1的激动剂,具有较好的抗氧化、抗炎、抗血小板聚集、调节脂质代谢、舒张血管、防止心肌纤维化和心室肥厚及电生理效应等作用,从而发挥对心血管系统的保护作用[18]。白藜芦醇对自发性高血压、血管紧张素II引起的高血压模型、肾性高血压模型和同型半胱氨酸引起的高血压等许多动物模型均具有降压作用[29-31]。然而,白藜芦醇对CsA引起高血压的影响未见报道。本研究通过离体血管培养技术考察了白藜芦醇对CsA诱导的血管收缩功能的影响,并通过CsA诱导大鼠高血压模型考察了白藜芦醇对大鼠血压的影响,从大鼠肠系膜动脉平滑肌收缩功能和蛋白表达阐述了白藜芦醇降低CsA引起高血压的作用机制。研究结果表明,CsA可显著升高大鼠血压,增强肠系膜动脉平滑肌的5-HT受体介导的收缩反应,该现象可能与CsA上调5-HT受体相关。白藜芦醇可以降低CsA诱导的高血压,并且抑制CsA引起的血管高反应性和减少5-HT1B蛋白的表达,白藜芦醇可能通过激活SIRT1、抑制ERK1/2通路减弱血管收缩作用从而降压。
高血压病理状况下血管平滑肌收缩性受体明显上调,使血管对激动剂产生高反应性;下调血管平滑肌收缩性受体能够降低血管的高反应性,从而降低血压[32-33]。研究发现,5-HT诱导的急性血管收缩主要由5-HT1B受体介导,而长期暴露于5-HT可通过激活5-HT1B受体引起肺动脉高压,自发性高血压大鼠动脉平滑肌细胞上的5-HT受体表达增强[34-35]。在血管收缩功能研究中,白藜芦醇可以显著降低5-HT诱导的大鼠肠系膜动脉收缩,Western blotting结果显示白藜芦醇显著下调大鼠肠系膜动脉5-HT1B受体的表达,提示白藜芦醇通过下调血管平滑肌上的5-HT受体表达,降低血管高反应性,从而降低血压。
MAPK信号通路能够调控细胞内多种生物信号转导。ERK1/2信号通路将信息从细胞表面传递到细胞内,再转导到细胞核,激活转录因子,介导生物学效应[36-37]。研究表明,吸烟与低密度脂蛋白等危险因子损伤动脉平滑肌,激活ERK1/2信号转导通路介导的转录和翻译机制,合成新的5-HT受体,使动脉血管平滑肌5-HT受体表达上调,导致动脉血管敏感性增强,呈高反应性[38-39]。U0126是ERK1/2通路特异性抑制剂,阻断丝裂原活化的细胞外信号调节激酶1/2(mitogen-activated extracellular signal-regulated kinase 1/2,MEK1/2)激活,抑制下游ERK1/2激酶激活。CsA增强血管收缩的作用及上调5-HT受体的表达可以被ERK1/2通路抑制剂U0126抑制,表明CsA上调5-HT受体的作用可能与ERK1/2信号通路有关。激活SIRT1可以降低血压,研究表明SIRT1的激活可以保护血管,降低血管的收缩作用,从而降低血压[40]。SIRT1激活剂白藜芦醇能够通过SIRT1介导的信号转导途径改善高血压。本研究结果表明,CsA抑制SIRT1表达,激活ERK1/2信号通路,而白藜芦醇可以激活SIRT1,抑制ERK1/2通路而降低血管高反应性。
综上所述,本研究发现白藜芦醇能够激活SIRT1,抑制ERK1/2信号通路,下调5-HT受体的表达,改善肠系膜动脉高反应性,降低CsA引起的高血压。
利益冲突 所有作者均声明不存在利益冲突
[1] Molnar A O, Fergusson D, Tsampalieros A K,.Generic immunosuppression in solid organ transplantation: Systematic review and meta-analysis [J]., 2015, 350: h3163.
[2] Ruggenenti P, Cravedi P, Gotti E,.Mycophenolate mofetil versus azathioprine in kidney transplant recipients on steroid-free, low-dose cyclosporine immunosuppression (ATHENA): A pragmatic randomized trial [J]., 2021, 18(6): e1003668.
[3] Mousavi-Hasanzadeh M, Bagheri B, Mehrabi S,.Sirolimus versus cyclosporine for the treatment of pediatric chronic immune thrombocytopenia: A randomized blinded trial [J]., 2020, 88: 106895.
[4] Mittal N, Loughran Jr T, Rivers A.T-cell large granular lymphocytic leukemia successfully treated with oral cyclosporine in a child: Case report and review of literature [J]., 2020, 67(12): e28487.
[5] Fervenza F C, Appel G B, Barbour S J,.Rituximab or cyclosporine in the treatment of membranous nephropathy [J]., 2019, 381(1): 36-46.
[6] Kvien T K, Zeidler H K, Hannonen P,.Long term efficacy and safety of cyclosporin versus parenteral gold in early rheumatoid arthritis: A three year study of radiographic progression, renal function, and arterial hypertension [J]., 2002, 61(6): 511-516.
[7] MacDonald A S.Impact of immunosuppressive therapy on hypertension [J]., 2000, 70(11 Suppl): SS70-SS76.
[8] Taler S J, Textor S C, Canzanello V J,.Cyclosporin-induced hypertension: Incidence, pathogenesis and management [J]., 1999, 20(5): 437-449.
[9] Wang Q S, Liang C, Jiang S,.NaHS or lovastatin attenuates cyclosporine A-induced hypertension in rats by inhibiting epithelial sodium channels [J]., 2021, 12: 665111.
[10] Mangray M, Vella J P.Hypertension after kidney transplant [J]., 2011, 57(2): 331-341.
[11] Rasmussen M N P, Hornbak M, Larsen S S,.Permanent distal occlusion of middle cerebral artery in rat causes local increased ETB, 5-HT₁Band AT₁ receptor-mediated contractility downstream of occlusion [J]., 2013, 50(5): 396-409.
[12] Ansar S, Eftekhari S, Waldsee R,.MAPK signaling pathway regulates cerebrovascular receptor expression in human cerebral arteries [J]., 2013, 14: 12.
[13] Wang H, Gao X Y, Rao F,.Mechanism of contractile dysfunction induced by serotonin in coronary artery in spontaneously hypertensive rats [J]., 2020, 393(11): 2165-2176.
[14] Alhawassi T M, Krass I, Pont L G.Antihypertensive-related adverse drug reactions among older hospitalized adults [J]., 2018, 40(2): 428-435.
[15] Rende P, Paletta L, Gallelli G,.Retrospective evaluation of adverse drug reactions induced by antihypertensive treatment [J]., 2013, 4(Suppl 1): S47-S50.
[16] Xie M T, Tao W L, Wu F J,.Anti-hypertensive and cardioprotective activities of traditional Chinese medicine-derived polysaccharides: A review [J]., 2021, 185: 917-934.
[17] Zhang S, Bai X, Chen Z L,.Qiju Dihuang Decoction for hypertension: A systematic review and meta-analysis [J]., 2020, 2020: 9403092.
[18] Gal R, Deres L, Toth K,.The effect of resveratrol on the cardiovascular system from molecular mechanisms to clinical results [J]., 2021, 22(18): 10152.
[19] Parsamanesh N, Asghari A, Sardari S,.Resveratrol and endothelial function: A literature review [J]., 2021, 170: 105725.
[20] Su C F, Jiang L, Zhang X W,.Resveratrol in rodent models of Parkinson’s disease: A systematic review of experimental studies [J]., 2021, 12: 644219.
[21] 王丽娟, 史惠蓉.白藜芦醇通过调控SIRT1抑制卵巢癌细胞生长及Wnt信号通路的研究[J].中草药, 2019, 50(3): 675-680.
[22] Bomfim G H S, Musial D C, Méndez-López I,.Chronic resveratrol consumption prevents hypertension development altering electrophysiological currents and Ca2+signaling in chromaffin cells from SHR rats [J]., 2020, 76: 109811.
[23] Prysyazhna O, Wolhuter K, Switzer C,.Blood pressure-lowering by the antioxidant resveratrol is counterintuitively mediated by oxidation of cGMP-dependent protein kinase [J]., 2019, 140(2): 126-137.
[24] Zheng J P, Cheng Z A, Jiang J Y,.Cyclosporin A upregulates ETB receptor in vascular smooth muscle via activation of mitogen-activating protein kinases and NF-κB pathways [J]., 2015, 235(1): 1-7.
[25] Chen Y L, Liu H H, Zhang H M,.The sirt1/NF-κB signaling pathway is involved in regulation of endothelin type B receptors mediated by homocysteine in vascular smooth muscle cells [J]., 2016, 84: 1979-1985.
[26] Zheng J P, Zhang X M, Wang H,.Vasomotor dysfunction in the mesenteric artery after organ culture with cyclosporin A [J]., 2013, 113(6): 370-376.
[27] Nishiyama A, Kobori H, Fukui T,.Role of angiotensin II and reactive oxygen species in cyclosporine A-dependent hypertension [J]., 2003, 42(4): 754-760.
[28] Maeda H, Sakamoto K, Kashiwabara H,.Effect of hypertension, hyperlipidemia and cyclosporine A therapy on long-term renal allograft survival [J]., 1996, 28(3): 1633-1634.
[29] Chen H E, Lin Y J, Lin I C,.Resveratrol prevents combined prenatal NG-nitro--arginine-methyl ester (-NAME) treatment plus postnatal high-fat diet induced programmed hypertension in adult rat offspring: Interplay between nutrient-sensing signals, oxidative stress and gut microbiota [J]., 2019, 70: 28-37.
[30] Javkhedkar A A, Quiroz Y, Rodriguez-Iturbe B,.Resveratrol restored Nrf2 function, reduced renal inflammation, and mitigated hypertension in spontaneously hypertensive rats [J]., 2015, 308(10): R840-R846.
[31] Cao X, Luo T, Luo X,.Resveratrol prevents AngII-induced hypertension via AMPK activation and RhoA/ ROCK suppression in mice [J]., 2014, 37(9): 803-810.
[32] Touyz R M, Alves-Lopes R, Rios F J,.Vascular smooth muscle contraction in hypertension [J]., 2018, 114(4): 529-539.
[33] Brinks H L, Eckhart A D.Regulation of GPCR signaling in hypertension [J]., 2010, 1802(12): 1268-1275.
[34] Watanabe S, Matsumoto T, Ando M,.Multiple activation mechanisms of serotonin-mediated contraction in the carotid arteries obtained from spontaneously hypertensive rats [J]., 2016, 468(7): 1271-1282.
[35] Sun T, Wang J, Huang L H,.Antihypertensive effect of formononetin through regulating the expressions of eNOS, 5-HT2A/1Breceptors and α1-adrenoceptors in spontaneously rat arteries [J]., 2013, 699(1/2/3): 241-249.
[36] Zhang Y P, Edvinsson L, Xu C B.Up-regulation of endothelin receptors induced by cigarette smoke: Involvement of MAPK in vascular and airway hyper-reactivity [J]., 2010, 10: 2157-2166.
[37] Xu C B, Sun Y, Edvinsson L.Cardiovascular risk factors regulate the expression of vascular endothelin receptors [J]., 2010, 127(2): 148-155.
[38] Cao L, Zhang Y P, Cao Y X,.Secondhand smoke exposure causes bronchial hyperreactivity via transcriptionally upregulated endothelin and 5-hydroxytryptamine 2A receptors [J]., 2012, 7(8): e44170.
[39] Tang H X, Lin J, Xu C B,.Minimally modified low-density lipoprotein upregulates mouse mesenteric arterial 5-HT1Breceptorvia activation of the JAK2/STAT3 pathway [J]., 2022, 139: 104260.
[40] Zhou L, Zhang S, Bolor-Erdene E,.NAMPT/SIRT1 attenuate Ang II-induced vascular remodeling and vulnerability to hypertension by inhibiting the ROS/ MAPK pathway [J].2020, 2020: 1974265.
Effect and mechanism of resveratrol on cyclosporin A-induced hypertension based on SIRT1-ERK1/2 pathway
WANG Chuan1, 2, WANG Yu-ying1, WANG Ting1, SHI Yong-heng1, 2, LIU Ji-ping1, 2, WANG Bin1, 2, WEI Hao1, 2, LIU Hang3
1.College of Pharmacy, Shaanxi University of Chinese Medicine, Xianyang 712046, China 2.Key Laboratory of Pharmacodynamics and Material Basis of Chinese Medicine, Shaanxi Administration of Traditional Chinese Medicine, Xianyang 712046, China 3.Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
To study the effect and mechanism of resveratrol on cyclosporine A (CsA) induced hypertension.organ culture and myograph were used to study CsA induced vasoconstrictions mediated by 5-hydroxytryptamine (5-HT) receptor.Rats were sc CsA to induce blood pressure increased, and resveratrol was given for intervention to study the effect of resveratrol on blood pressure; Microvascular tonometry was used to observe the changes in dose-response curve of arterial contraction caused by 5-HT; Western blotting was used to detect 5-HT1Breceptor, sirtuin 1 (SIRT1) and extracellular regulated kinase 1/2 (ERK1/2) protein expressions.The results of isolated blood vessel culture showed that resveratrol inhibited CsA-induced contraction by activating SIRT1-ERK1/2 pathway.Animal experiments showed that resveratrol could significantly reduce the increase in blood pressure caused by CsA (< 0.05, 0.01); Inhibited the contractile response caused by 5-HT (< 0.05, 0.01); Decreased the expressions of 5-HT1Breceptor and p-ERK1/2 protein (< 0.05, 0.01), and increased the protein expression of SIRT1 (< 0.01).Resveratrol can inhibit CsA-induced hypertension by down-regulating 5-HT receptor through SIRT1-ERK1/2 signaling pathway.
resveratrol; hypertension; cyclosporin A; 5-hydroxytryptamine; sirtuin1
R285.5
A
0253 - 2670(2022)09 - 2723 - 08
10.7501/j.issn.0253-2670.2022.09.015
2022-01-18
国家自然科学基金资助项目(81800401);陕西省科技厅一般项目——社会发展领域(2022SF-207,2022SF-435);大学生创新创业训练计划项目(S202010716021,S202010716024);陕西中医药大学学科创新团队(2019-YL13)
王 川(1987—),男,副教授,博士研究生,主要从事心血管疾病的发病及防治研究。E-mail: wangchuan@sntcm.edu.cn
通信作者:刘 航(1983—),男,主管中药师,主要从事中药制剂工艺研究。E-mail: 497240346@qq.com
[责任编辑 李亚楠]
