干式半连续厌氧消化处理厨余垃圾的中试研究
2022-05-05黄伟钊
黄伟钊
(厦门欣源环保服务有限公司,福建 厦门 361000)
1 引言
应对与日俱增的厨余垃圾,我国已发展出多条厨余垃圾处理路线,其中厌氧消化被认为是将易腐垃圾转化为可再生能源的环保技术之一,促进了经济循环[1]。据调查,我国厨余垃圾含固率约25%[2-3],在工程上干式厌氧消化技术是处理厨余垃圾的首选,因为干式厌氧可以承载更高的进料有机负荷和更大的日进料量并能选择更小的消化罐体积[4-5]。
干式厌氧系统是一个复杂的微生物反应过程,其运行稳定性取决于多种因素[6],重要因素有原料类型、总固含量(TS)、有机负荷(OLR)、水力停留时间(HRT)、工艺温度、pH、消化罐配置等。我国已有不少学者专家对干式厌氧发酵系统的相关问题开展了研究,许国栋等[7]通过干式厌氧中试反应器研究猪粪、秸秆和污泥的协同厌氧发酵,发现最佳OLR 为4.8 kg/(m³·d),有机物降解率为40%~50%。杨林海[8]采用降流式反应器对厨余垃圾厌氧发酵情况进行研究,进罐底物的产气量超过100 m³/t,pH、挥发性脂肪酸(VFA)分别稳定在7.7 和5 800 mg/L。王艳明[9]在厨余垃圾干式厌氧工程项目上对比不同接种启动方案,发现大量高浓度的接种底物有利于缩短发酵罐调试周期。但是目前较少采用推流式厌氧发酵罐探究不同OLR对进料厨余垃圾厌氧处理系统的影响。在连续式有机垃圾干法厌氧处理中,OLR 表征了单位时间内进料至消化罐可降解有机质的质量,高OLR 意味着消化罐可以处理更多的有机垃圾,带来更高的效益,但同时也会造成系统中VFA 的积累,增加厌氧系统酸化失稳的风险[10]。显然OLR 是连续式厌氧消化罐处理厨余垃圾的关键参数,故需要对其进行调整以优化消化罐的运行效率,在保证高处理量的同时降低工艺的不稳定风险。
在厌氧发酵的中试或工厂化运行过程中,经常用挥发性有机酸(FOS,以乙酸计,mg/L)与总无机碳(TAC,以CaCO3计,mg/L)的比率指标来反映厌氧消化系统运行过程的稳定性[11-12]。该指标在一些协同厌氧的沼气工厂中,用来为厌氧消化罐的进料调控提供参考,通常来说在该值<0.3时表明厌氧系统可增加进料负荷;处于0.3~0.5 时表明厌氧系统的进料负荷较为合适;>0.5 则表明进料负荷较高,需要减少甚至停止进料[13]。但针对实际运行的厌氧系统,由于接种物、进罐物料、运行工艺的不同,该值所提供的参考意见应依照实际运行情况而进行调整。
本研究采用干式半连续式厌氧发酵,从中试试验角度探究不同OLR 下厨余垃圾厌氧消化过程中系统特征指标的变化规律、厌氧系统酸化失稳的主要原因,以及OLR 与沼气产率、甲烷产率、pH、FOS/TAC 和VFA 之间的关系,以期为干式厌氧工艺处理厨余垃圾的工程项目提供运行参考。
2 材料与方法
2.1 接种物及发酵底物
试验所用接种物采用厦门市厨余垃圾处理厂干式厌氧消化罐发酵残余物经过固液分离后的液相部分,即沼液。沼液在投入试验罐之前,先经过沉淀预处理,以除去沼液中的细碎玻璃、沙砾、贝壳等惰性杂质。
试验过程中每日进料的发酵底物为经过预处理的当日进厂的厨余垃圾,该原料来自厦门市厨余垃圾处理厂。预处理工序为:经过分类收集得到的原生厨余垃圾首先经设备粗分选,剔除垃圾中塑料袋、海蛎壳、玻璃、椰子壳等杂质,筛分获得粒径≤55 mm 的物料,再通过人工细分选,进一步剔除垃圾中的细碎玻璃、塑料等杂质,最后机械粉碎及筛分得到最终物料(粒径≤10 mm)。
试验接种物及发酵底物的基本性质见表1。

表1 接种物与发酵底物基本参数Table 1 Basic parameters of inoculum and fermentation substrate
2.2 试验发酵装置及试验方法
2.2.1 试验发酵装置
试验采用单轴卧式干式厌氧消化反应系统进行研究,见图1。厌氧消化反应系统主要由发酵罐、搅拌驱动系统、恒温水箱、膜式气体流量计、甲烷测定仪及电控柜等组成。其中发酵罐罐体长径比为4.70∶1.00,总容积120 L(有效容积102 L)罐体为卧式设计。侧壁分为3 层,内层为反应发酵罐罐壁,中层密布恒温水流管道,外层为保温层;发酵罐的搅拌轴横穿罐体两侧封盖,轴上共布置25 根桨叶,相邻桨叶夹角为60°,可通过电控柜调节搅拌转速;恒温水箱具有加热水、制冷水及控制水循环的作用;膜式流量计测量产生沼气的体积;甲烷测定仪测定沼气中的甲烷含量;电控柜为各个部件提供电源等。

图1 单轴卧式干式厌氧消化反应系统Figure 1 Uniaxial horizontal dry anaerobic digestion reaction system
2.2.2 试验方法
干式厌氧系统可依照温度分为中温及高温工艺,中温工艺的运行温度范围为35~40 ℃[14],在中温工艺中发酵底物的产气性能随温度升高而提高[15],并且接种物来源于在40 ℃条件下稳定运行的厌氧消化罐,故本试验过程控制发酵温度为40 ℃。搅拌转速设定为0.3 r/min,尽量减少对罐内物料的扰动。为避免因试验过程可能产生的泡沫引起罐内发酵污泥鼓胀进而损坏发酵反应器的风险[16],试验过程的物料容积控制在约85 L。每天等量分5 次将经过预处理的厨余垃圾物料向消化罐进料,并且在每日第1 次进料前从出料口排出适量消化污泥,维持罐体物料容积稳定,由此以半连续发酵方式开展试验。
接种期向厌氧消化罐加入60 L 接种物及20 L水,设定与接种物来源相同的工艺温度开始进行培养,用以消耗接种物中残留的可生物降解有机质[17],期间不进料厨余垃圾。接种期共耗时9 d,该期结束后开始向消化罐进料厨余垃圾。试验过程共分4 个阶段,对应编号为T1、T2、T3 及T4,各阶段的划分说明、进料有机负荷、HRT 及运行时长见表2。T1 为低负荷提升期,该时期OLR 按照5 d 为一阶段增加;T2 为中负荷提升期,OLR按照10 d 为一阶段增加;T3 为高负荷运行期,运行OLR(以VS 计)为7.1、8.0、8.8 g/(L·d)时,对应的HRT 分别为28.3、25.0、23.0 d,为保证提升负荷后厌氧系统有足够的缓冲时间,T3 每阶段有机负荷均至少连续运行2 个HRT 或运行至厌氧系统酸化崩溃;T4 为酸化失稳期,该阶段厌氧消化罐已酸化失稳,停止向消化罐进料。

表2 试验各阶段的划分说明、进料有机负荷及运行时间Table 2 Partition description,OLR and operation time of each stage of the test
2.3 测定指标及分析测定方法
试验过程每间隔4 d 测定发酵底物及出罐消化污泥的TS 及VS 含量。为保证每阶段OLR 至少有3 组消化污泥的pH、FOS/TAC 数据,上述指标连续或间隔1 d 进行测定。消化污泥的VFA 每间隔4 d 测定1 次。发酵产沼气量、甲烷含量在每日固定时间读取1 次。
测定出罐消化污泥的不同指标时,样品的前处理方式也各不相同。pH、TS 及VS 取适量消化污泥直接测定,pH 用雷磁pHS-3C 型pH 计进行测定;TS 用烘箱105 ℃烘干至恒质量后,用差重法测定;VS 以600 ℃灼烧烘干物料2 h 至恒质量后,用差重法测定。消化污泥经0.5 mm 孔径滤网过滤后的滤液依照Nordmann 法采用哈希TIM840机型自动电位滴定仪测定FOS/TAC[13]。另外,首先将粗过滤后的消化污泥样品进行适当稀释,取4.0 g 稀释样品加入0.4 mL 2.5 mol/L 的硫酸在12 000 r/min 下离心10 min 后进行过滤,滤液经微孔滤膜(0.45 μm)后采用气相色谱法(天美GC 7900,FFAP 毛细管柱,50 m×0.25 mm×0.5 mm)测定VFA 浓度。沼气产量采用膜式流量计测定;沼气中的甲烷含量采用沼气分析仪(Geotech BIOGAS 5000)测定。
VS 降 解 率(VS Reduction,VSR) 由 下 式[18]计算:

式中:VSI为第T天发酵底物厨余垃圾的VS测定数值,%;VSO为厌氧消化第T天消化污泥的VS 测定数值,%。
数据及图表采用Microsoft Excel 2016 分析制作。
3 结果与讨论
3.1 产气及VS 降解情况
厌氧消化罐在经历接种期后开始进料厨余垃圾,进入T1 期。如图2~图4 所示,在T1 期厌氧消化罐的产气量及甲烷产量在进料后呈现快速上升的趋势,容积产气率从1.14 L/(L·d)升至最高3.56 L/(L·d),容积产甲烷率从0.69 L/(L·d)升至最高2.16 L/(L·d),甲烷浓度持续稳定于约60.1%,证明了接种物中的厌氧微生物活性良好,迅速适应了发酵底物并开始降解产气。在T2 期消化罐的容积产气率及容积产甲烷率随着OLR 的梯度上升仍逐步升高,分别升至最高4.74、2.84 L/(L·d)。VS 产气率在T1 及T2 期均保持相对稳定,均值(以VS 计)分别约为697.9、710.5 mL/g,表明消化罐在这两个时期有良好的产气稳定性。T3期为高负荷运行期,在OLR(以VS 计)提高至7.1 g/(L·d)(HRT 为28.3 d)及8.0 g/(L·d)(HRT为25.0 d)时,消化罐的沼气产量仍具有上升趋势,在OLR(以VS 计)为8.0 g/(L·d)时厌氧消化罐容积产气率能稳定至(5.5±0.3)L/(L·d),VS产气率为(671.7±22.3)mL/g,甲烷含量为60.1%±0.6%。当OLR (以VS 计) 提高至8.8 g/(L·d)(HRT 为23.0 d),运行至该阶段第5 天时消化罐的容积产气率及容积产甲烷率均出现明显下降,运行至该阶段第13 天时分别降至2.72、1.21 L/(L·d),分别仅为该阶段第4 天时的30.4%、18.1%,沼气中的甲烷浓度仅44.4%。VS 产气率(以VS计)在该有机负荷阶段也呈明显下降趋势,从652.5 mL/g 降至316.2 mL/g。在T4 期停止向消化罐进料厨余垃圾后沼气产量仍进一步降低,容积产气率及容积产甲烷率分别降至0.30、0.11 L/(L·d),甲烷含量为38.6%,极低的甲烷产率说明消化罐的厌氧系统已基本崩溃。

图2 不同OLR 消化罐的沼气产量、甲烷产量的变化情况Figure 2 The changes of methane and biogas production in different OLR digesters
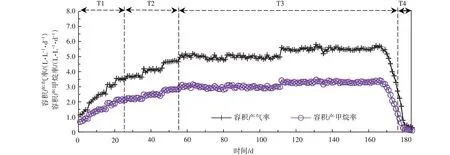
图3 不同OLR 消化罐的容积产气率、容积产甲烷率的变化情况Figure 3 The changes of volumetric gas yield rate and volumetric methane yield rate in different OLR digesters

图4 不同OLR 消化罐的VS 产气率、VS 产甲烷率及VSR的变化情况Figure 4 The changes of VS gas yield rate,VS methane yield rate and VSR in different OLR digesters
在运行过程中,VSR指将有机物转化为沼气的效率[19],通过对该指标的评估可以了解发酵底物在消化罐中的降解产气性能。图4 可看出不同时期VSR变化情况。在T1 及T2 期OLR 逐步升高过程中VSR数值波动较小,分别稳定在69.8% 及67.8%。进入T3 期,OLR (以VS 计) 为7.1 g/(L·d)及8.0 g/(L·d)时,VSR分别下降至66.0%及64.1%,消化罐仍能将发酵底物中大部分的可降解有机质转化成沼气。OLR(以VS 计)提升至8.8 g/(L·d)时VSR进一步下降,平均45.5%,最低值为38.3%,说明发酵底物中的可降解有机质已无法被有效地降解产气。VSR在厌氧系统稳定过程中保持在64%~70%,而湿式厌氧的VSR一般可达到75%以上[20]。导致干式厌氧降解率偏低的原因可能有原料未制浆处理,固体颗粒粒径较大,以及高含固率厌氧过程易富集VFA 及氨氮,进而产生抑制效应等因素[21]。
3.2 pH 及FOS/TAC
消化罐pH 及FOS/TAC 在不同OLR 的变化情况见图5。在T1 及T2 期,厌氧消化罐处于低、中有机负荷的提升阶段,负荷的提升过程未对系统的pH 及FOS/TAC 带来明显的负面影响,T1 期pH 及FOS/TAC 的均值分别为7.96 及0.316,T2期均值分别为7.97 及0.353。在进入高负荷T3 期后,pH 及FOS/TAC 趋势出现变化,尤其是FOS/TAC 有明显上升趋势。OLR(以VS 计)为7.1 g/(L·d)时FOS/TAC 均值上升至0.508,OLR(以VS 计)进入8.0 g/(L·d)运行阶段FOS/TAC 均值更进一步上升,在该负荷运行中段升至0.700以上,该期运行后段经过系统的自身调节停止持续上升,恢复稳定在0.709 左右。OLR(以VS计)提升至8.8 g/(L·d)时,开始观察到系统失稳的趋势,pH 逐步下降,FOS/TAC 陡然上升,运行至该阶段第13 天时pH 已降至7.19,FOS/TAC升高至1.637,随即停止向消化罐进料。在T4 期pH 及FOS/TAC 继续恶化,pH 持续下降至最低6.23,FOS/TAC 升高至最高3.076,厌氧系统已酸化失稳。

图5 不同OLR 消化罐pH 及FOS/TAC 的变化情况Figure 5 The changes of pH and FOS/TAC in different OLR digesters
从T3 后期及T4 期的试验情况来看,产酸菌对酸碱度的适应能力要强于产甲烷菌,pH 下降造成产甲烷菌活性降低,而非产甲烷菌所受影响较小,产甲烷菌来不及代谢系统内酸化产物,引起FOS/TAC 的进一步升高及pH 的进一步降低,继续降低的pH 进一步抑制产甲烷菌,厌氧系统进入恶行循环。
结合图2~图5 可看出,FOS/TAC 相较pH、产气率及产甲烷率能更早地反映出系统稳定性的变化,在T2 期FOS/TAC 随着负荷升高而略微上升,进入T3 高负荷运行期后FOS/TAC 明显上升,并且在OLR(以VS 计)增至8.8 g/(L·d)时出现明显恶化倾向,以日均0.05 的幅度快速上升,出现系统失稳的示警。
3.3 VFA
VFA 是可降解有机质在厌氧消化过程生成甲烷的中间产物,其累积易对厌氧系统产生显著影响[22]。不同OLR 阶段对VFA 浓度的影响见图6。由图6 可看出厌氧系统VFA 的产生量随着OLR 的增加而逐渐增加。OLR(以VS 计)从2.4 g/(L·d)升高至8.0 g/(L·d),VFA 从6 444 mg/L 增加至(13 641±1 391)mg/L;乙酸和丙酸占比较高,分别为56.7%~72.2%(平均65.43%±6.75%)和16.4%~29.0%(平均23.88%±5.15%);乙酸与丙酸之比保持在1.97 以上。在T3 前两个负荷阶段可明显观察到VFA 的积累,但结合前述该阶段的产沼、pH 及FOS/TAC 情况可判断厌氧系统仍持续保持稳健的运行状态。当OLR(以VS 计)升至8.8 g/(L·d)时,在运行至该期第13 天时VFA 快速积累至24 675 mg/L,乙酸与丙酸之比降至1.60,乙酸和丙酸占比降至75.2%,明显出现短链脂肪酸的积累问题。在T4期第8 天发酵试验终止时测定的VFA 升高至34 767 mg/L,乙酸和丙酸占比降至74.3%。据研究,厌氧系统存在适量的丙酸将有助于产甲烷菌的生长和甲烷发酵,但当丙酸或VFA 出现积累时将使厌氧系统中产甲烷菌生物量降低,进一步导致甲烷产量的下降[23]。这与试验结果一致,OLR(以VS 计)提高至8.8 g/(L·d)时,丙酸的积累抑制厌氧发酵微生物的活性,使VFA 积累速度加快,进一步抑制厌氧发酵过程。

图6 不同OLR 阶段VFA 的变化情况Figure 6 VFA changes at different OLR stages
4 结论
1)在OLR(以VS 计) 增加至8.0 g/(L·d)时,对应HRT 为25.0 d,在连续运行的两个完整HRT 期间,厌氧消化罐容积产气率、甲烷含量、pH、FOS/TAC 及VFA 均表现稳定。将OLR(以VS计)继续提高至8.8 g/(L·d)后,厌氧系统出现酸化。
2) 当厌氧消化罐发生酸化时,pH 下降,FOS/TAC 及VFA 上升,在停止进料后罐内残留可降解有机质仍然能继续被降解产酸,pH 进一步下降,FOS/TAC 及VFA 继续升高,加剧厌氧系统酸化程度,形成恶性循环。
3) 在高OLR 运行期,FOS/TAC 对OLR 的增加更为敏感,当FOS/TAC 以日均0.05 的幅度快速上升时可能就预示着厌氧系统酸化失稳情况的发生。
