铁死亡对肌肉损伤后再生能力的影响
2022-05-05杜玉婷
杜玉婷,张 婧,黄 莺,张 晶
上海交通大学基础医学院病理生理学系,细胞分化与凋亡教育部重点实验室,上海 200025
骨骼肌是人体第二大可塑性组织,仅次于神经组织[1],对呼吸、代谢、运动、体温保持等基本生命活动具有重要的调控作用。运动、疾病、创伤等会导致骨骼肌不同程度的损伤[2]。骨骼肌再生是骨骼肌对损伤或肌病做出反应并进行修复的生理过程[3]。肌肉急性损伤诱导骨骼肌再生的模型应用广泛、功能强大,其病理生理过程涉及多种细胞的协同作用,受到复杂、精细的调控,以保证再生过程的有序进行[4]。心脏毒素(cardiotoxin,CTX)可通过肌肉注射导致肌肉损伤,常被用于肌肉损伤模型的构建[5]。CTX 注射后的第3日中性粒细胞开始积聚,而巨噬细胞在3 d后开始积聚[6]。
骨骼肌在损伤后具有显著的再生能力,肌肉再生是一个高度协调的过程。研究表明,肌肉修复通常从肌纤维变性开始,形态学上类似于坏死。在病理情况下,过度的坏死性凋亡(necroptosis),由于其促炎反应,通常会给机体带来危害。最近,有研究[7]表明坏死性凋亡能够通过促进固生蛋白(tenascin-c,TNC)的释放进而促进肌肉再生。然而到目前为止,肌纤维其他的坏死方式对肌肉损伤修复的影响并不清楚。
铁死亡(ferroptosis)是近年来报道的一种新型的细胞死亡方式[8],其具体机制是由于铁过载而导致脂质过氧化(lipid peroxidation)从而引起细胞死亡[9]。铁死亡诱导剂可以诱导细胞脂质过氧化或死亡,其中,酰基辅酶A 合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)在游离脂肪酸结合到磷脂过程中发挥关键作用[10-11]。研究[12-14]表明,铁死亡与多种细胞过程有关,如铁稳态、氧化还原稳态和脂质代谢;另一方面,谷胱甘肽过氧化物酶(glutathione peroxidase 4,GPX4)是哺乳动物细胞中一种专门消除脂质活性氧(reactive oxygen species,ROS)的酶,可防止铁死亡的发生。作为小分子的ferrostatin-1 (Fer-1) 具有中和脂质ROS 的能力,去铁胺(deferoxamine,DFO)具有螯合铁离子的能力,因此它们被认为是铁死亡的有效抑制剂[8,12]。从Fer-1衍生的新型抑制剂UAMC-3203具有更好的溶解性,抑制铁死亡的能力与DFO 比较表现出更强的效果,在小鼠体内显示对多种器官的损伤具有良好的保护作用[15]。在过去的几年中,越来越多的证据[12,16-17]表明,铁死亡与多种病理学改变有关,如组织缺血再灌注损伤、神经退行性变、脑卒中和癌症。因此,了解铁死亡是否与其他形式的细胞死亡一样,参与其他生理和病理过程是很重要的。
1 材料与方法
1.1 实验动物
8 周龄SPF 级的C57BL/6J 雄性小鼠60 只(灵畅生物提供),体质量20~25 g。实验小鼠饲养于上海交通大学医学院动物科学部,12 h明暗交替,动物房温度18~26 ℃,相对湿度40%~60%。动物使用许可证号SYXK (沪) 2018-0002,生产许可证号SCXK(沪)2018-0007。实验符合上海交通大学医学院动物实验伦理标准。
1.2 主要试剂与仪器
TRⅠzol(Thermo Fisher,美国),反转录试剂盒(诺唯赞,中国),Genious 2×SYBR Green Fast实时荧光定量PCR(quantitative real-time PCR,qPCR)Mix(ABclonal,中国武汉),DFO(Sigma,美国),CTX(Merck,美国),UAMC-3203(Selleck,美国),生理盐水(Servicebio,中国武汉),异氟烷(瑞沃德生命科技有限公司),脱脂牛奶(雅酶生物医药,中国上海),ACSL4 抗体(Santa Cruz,美国),血红素加氧 酶 1 (heme oxygenase-1, HMOX-1) 抗 体(Proteintech,美国),成肌分化抗原(myogenic differentiation antigen,MYOD) 抗体(ABclonal),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 抗体(Proteintech, 美国),鼠荧光二抗(1∶15 000,LⅠ-COR),兔荧光二抗(1∶20 000,LⅠ-COR),cocktail(APE×BⅠO),二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(Thermo Fisher,美国)。
组织研磨仪(上海净信),研磨珠(Servicebio,中国武汉),脱水机(Diapath,Donatello),包埋机(武汉俊杰电子有限公司,JB-P5),病理切片机(上海莱卡仪器有限公司,RM2016),冷冻台(武汉俊杰电子有限公司,JB-L5),组织切片机(浙江金华科迪仪器设备有限公司),染色机(Diapath),烤箱(天津市莱博瑞仪器设备有限公司),载玻片(Servicebio),正置光学显微镜(日本尼康),1 mL注射器(康德莱),倒置显微成像系统(Olympus)。
1.3 研究方法
1.3.1 肌肉损伤再生模型构建 CTX 诱导的急性肌肉损伤模型能够维持基底膜和微血管的基本结构,有充足的血液供应,通常用于研究肌肉损伤再生。将CTX 溶于生理盐水配置成浓度为10 μmol/L 的母液。取15 只C57BL/6J 小鼠,刮去腿毛。使用麻醉机用异氟烷对小鼠进行麻醉,分别在胫骨前肌(tibialis anterior,TA)上、中、下选取3 个点注射CTX,每个点注射30 μL。CTX 注射后,分别在第0、3、7 日取5 只小鼠的TA 组织,3 个时间点分别代表肌肉损伤、再生和修复的不同阶段。本研究通过检测这3 个关键节点的肌肉组织形态学变化及相关分子通路,探究再生过程中生理病理机制。
1.3.2 分组及预处理 将45只8周龄的C57BL/6J雄性小鼠随机分为生理盐水组、铁离子螯合剂DFO组、铁死亡抑制剂UAMC-3203 组,每组15 只。生理盐水组和DFO组连续7 d分别腹腔注射生理盐水和DFO,注射剂量为100 mg/kg。UAMC-3203组在注射CTX前1 d腹腔注射,剂量为10 mg/kg。
1.3.3 小鼠TA 肌肉取样及病理学观察 分别在注射CTX后第0、3、7日取样。取TA组织放入4%多聚甲醛(paraformaldehyde,PFA)固定液中固定,再将组织块包埋于石蜡后做苏木精-伊红染色(hematoxylin and eosin staining,H-E染色),在显微镜下观察拍片。
1.3.4 RNA 抽提、反转录及qPCR 肌肉组织用TRⅠzol 进行裂解,实验前尽量确保样品处于无RNA酶污染的环境,定量后去除基因组DNA 后反转录成cDNA 用于后续qPCR。 采用Genious 2×SYBER Green Fast qPCR Mix荧光定量试剂盒,设计特异荧光定量引物(primer bank),引物由苏州金唯智生物科技有限公司合成,引物序列见表1。每个待测样品设置3个复孔,内参使用小鼠Gapdh。

表1 qPCR引物序列(5′→3′)Tab 1 Primer sequences for qPCR(5′→3′)
1.3.5 蛋白质印迹法 根据TA 组织质量加入RⅠPA裂解液裂解,同时加入蛋白酶抑制剂cocktail。预冷组织研磨仪至4 ℃后向样品中加入研磨珠对组织进行研磨,频率为70 Hz,30 s/次,共3 次。12 000×g离心取上清液,BCA 蛋白定量后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE),用5%的脱脂牛奶封闭0.5 h 后用HMOX-1 抗体(1∶3 000),ACSL4 抗体(1∶300),MYOD 抗体(1∶2 000),GAPDH 抗体(1∶8 000),4 ℃过夜孵育。回收一抗后洗膜孵育二抗,室温1 h,洗膜显影。
1.3.6 肌肉组织RNA 测序 分别从生理盐水组和UAMC-3203组随机选取3只小鼠的TA组织进行RNA测序(RNA sequencing,RNA-Seq),测序实验由诺禾公司完成。对cDNA 进行文库的构建和质检后使用Qubit2.0 Fluorometer 进行初步定量,符合预期后上机测序。
1.4 统计学方法及差异表达分析
1.4.1 统计学方法 采用Microsoft Excel 和Graphpad Prism 8 进行数据处理和统计学分析。2 组比较采用Student'st检验。P<0.05 表示差异具有统计学意义。
1.4.2 差异表达分析 使用DESeq 2 软件(1.16.1)分别对第0 日及第3 日生理盐水组和UAMC-3203 组进行差异表达分析(每个组2 个生物学重复)。DESeq 2 提供了统计程序,用于使用基于负二项式分布的模型来确定数字基因表达数据中的差异表达。使用Benjamini 和Hochberg 的方法来调整所得P值以控制错误发现率。通过DESeq 2 发现调整的P<0.05 的基因被分配为差异表达基因(对于没有生物学重复的采用edgeR)。在进行差异基因表达分析之前,对于每个测序文库,通过一个比例归一化因子使用edgeR 程序包调整读取计数。2 个条件的差异表达分析使用edgeR 软件包(3.18.1)进行。使用Benjamini 和Hochberg 的方法调整P值。校正后的P值以及|log2foldchange|作为显著差异表达的阈值。
1.4.3 差异基因富集分析 通过clusterProfiler(3.4.4)软件实现差异表达基因的基因本体数据库(Gene Ontology,GO)富集分析,其中修正了基因长度偏差。考虑具有小于0.05 的校正P值的GO term通过差异表达基因富集。京都基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)是一个数据库资源,用于从分子水平的信息,特别是基因组测序产生的大规模分子数据集和其他高通量数据库中了解生物系统的高级功能和效用,如细胞、生物体和生态系统等。我们使用clusterProfiler(3.4.4)软件分析KEGG 通路中差异表达基因的富集统计。
2 结果
2.1 CTX注射后肌肉损伤再生相关指标的检测
TA 组织注射CTX 后,为了验证CTX 注射诱导的肌肉损伤模型是否构建成功,本研究通过对肌肉组织进行H-E 染色来观察肌肉损伤再生情况。H-E 染色如图1A 所示:CTX 注射后第3 日损伤较为严重,出现单核细胞的浸润,中性粒细胞的大量积聚;第7 日肌肉组织形态基本恢复。为检测此过程是否有肌肉再生,本研究分别检测肌肉再生关键基因Myod、肌细胞生成素(myogenin,Myog)和Tnc。Myod表达于肌肉细胞及其前体细胞中,促进成肌细胞向肌肉细胞分化[18]。Myog基因是生肌调节因子Myod家族中的一员,该基因在肌肉的生长发育、肌肉萎缩以及肌肉再生中具有重要作用[19]。Tnc能促进成肌细胞的增殖[20],这个过程由损伤肌肉组织中坏死性凋亡来调控[7]。如图1B所示,肌肉再生相关标志基因RNA水平的表达在第3 日明显升高(均P<0.05)。同时,我们也从蛋白水平检测MYOD的表达,发现同样在第3日升高(图1C),此趋势与RNA 结果一致,说明肌肉损伤再生模型构建成功。

图1 CTX注射诱导肌肉组织损伤后再生Fig 1 Muscle injury and regeneration induced by CTX
2.2 CTX注射后铁死亡相关指标的检测
在15 只C57BL/6J 小鼠的TA 注射CTX 后,分别于第0、3、7 日取TA 组织,从RNA 和蛋白水平检测铁死亡相关指标。由图2 可知,注射CTX 后第3 日铁死亡相关指标Acsl4、Hmox-1在RNA 和蛋白水平上有明显升高趋势,第7 日有所恢复(均P<0.05)。结果表明,CTX 引起的肌肉损伤过程中有铁死亡的发生。
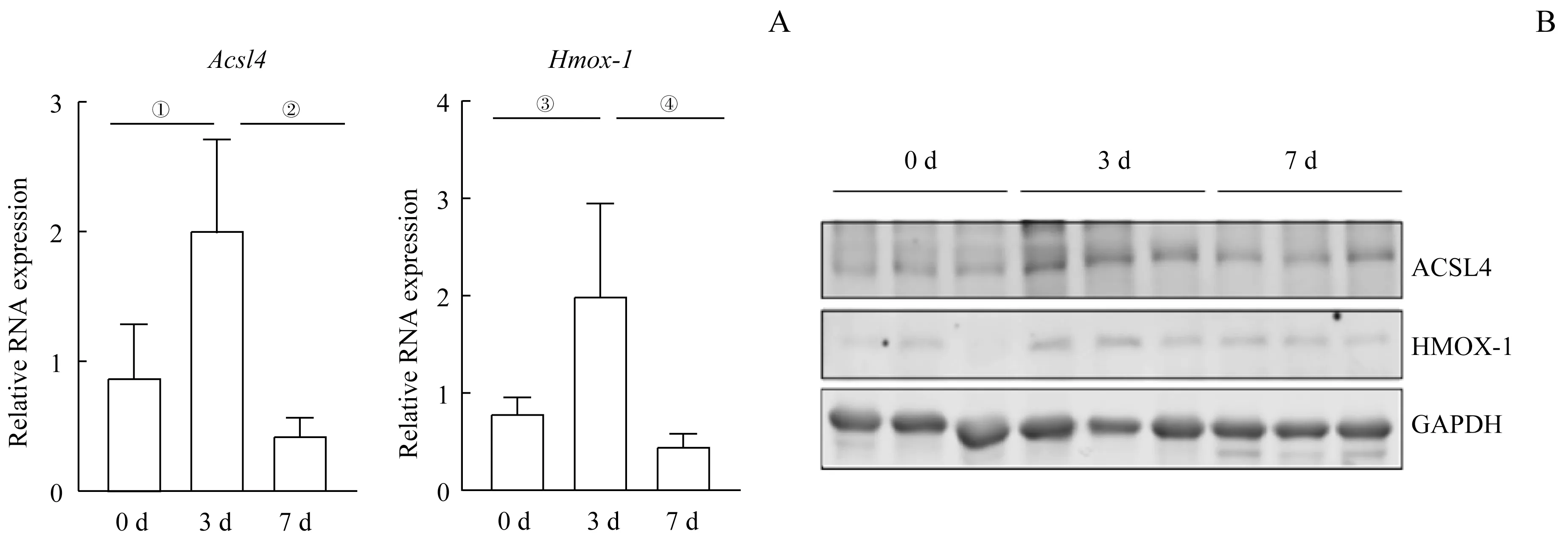
图2 CTX注射后铁死亡相关指标RNA和蛋白的表达Fig 2 RNA and protein expression of ferroptosis-related indicators after CTX injection
2.3 铁死亡抑制剂对肌肉损伤再生的转录组调控
为了探究铁死亡对小鼠肌肉损伤再生过程中转录组表达水平的影响,我们随机从生理盐水组和UAMC-3203 组中选取3 只小鼠的TA 组织进行RNAseq。 以log2(CTX+ 生理盐水)/(CTX+UAMC-3203)或者log2(CTX+UAMC-3203)/(CTX+生理盐水)≥1.5,以及t检验P<0.05 为条件,共筛选出显著差异表达基因531 个,其中UAMC-3203 组显著升高的基因有489 个(图3A 的红色部分),显著降低的基因42 个(图3A 的绿色部分)。通过对RNA-seq 差异基因的GO 分子功能通路分析发现,UAMC-3203组中性粒细胞的脱颗粒化,ROS 的生成,以及吞噬作用中的磷脂等信号通路发生了明显的改变(图3B)。在RNA-seq 显著变化的基因中,我们注意到组织蛋白酶S(cathepsin S,Ctss)基因表达的显著升高。如图3C 所示,CTX 注射后第3 日,与生理盐水组比较,UAMC-3203 组和DFO 组Ctss基因的表达都显著增强(均P<0.05)。
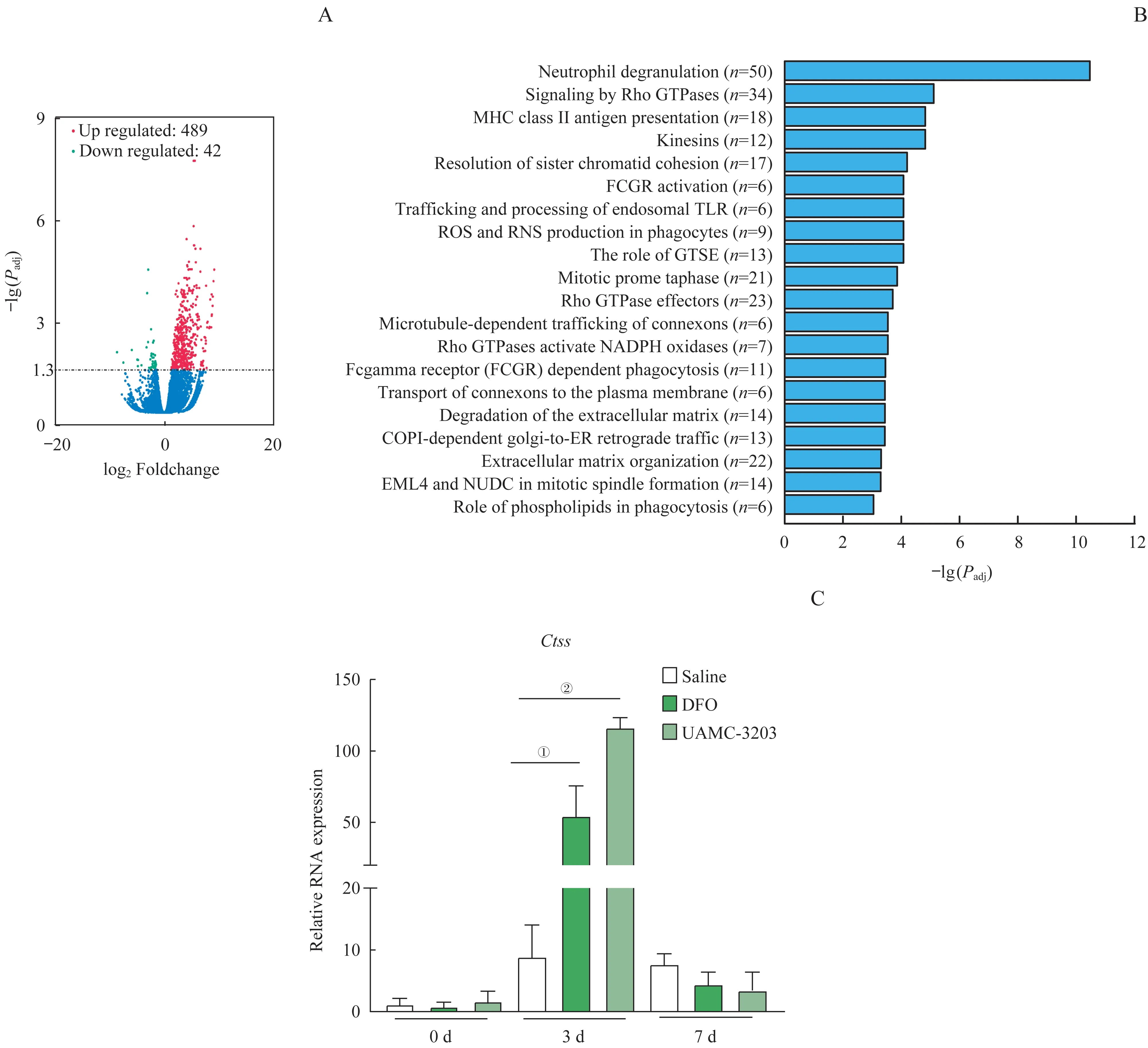
图3 铁死亡抑制剂UAMC-3203预处理之后的转录组分析Fig 3 Effect of ferroptosis inhibitors UAMC-3203 on CTX-induced skeletal muscle regeneration at transcriptome level
2.4 铁死亡抑制剂预处理后对肌肉再生的影响
H-E 染色由图4A 所示,注射CTX 后第3 日肌肉损伤较为严重,出现单核细胞的浸润,第7 日肌肉组织形态基本恢复。DFO 组和UAMC-3203 组损伤程度较生理盐水组更为严重。我们检测了CTX 注射后不同组别MYOD 的表达水平,结果如图4B 所示,CTX 注射3 d 后,MYOD 蛋白的表达显著升高,而DFO 组和UAMC-3203 组中MYOD 蛋白的升高被明显抑制。同时,如图4C 所示,CTX 注射后第3 日,肌肉再生标志基因Myod、Tnc和Myog的RNA 表达在生理盐水组也显著升高,而铁死亡抑制剂组肌肉再生相关基因的表达明显低于生理盐水组(均P<0.05)。第7 日肌肉再生标志基因Myod、Tnc和Myog的RNA 表达水平均较第3 日呈现下降趋势(均P<0.05)。这些结果提示铁死亡至少部分参与了肌肉再生。

图4 铁死亡抑制剂预处理后对肌肉再生能力的抑制作用Fig 4 Ⅰnhibitory effect of ferroptosis inhibitor on the regeneration ability of skeletal muscle
3 讨论
骨骼肌的生长和再生依赖于从中胚层发育而来的成人干细胞亚型,即卫星细胞(satellite cells)。卫星细胞可以在外部刺激和肌肉损伤的情况下重新进入细胞周期,在MYOD 和MYOG 等因子的调节下产生成肌细胞,参与肌纤维的重建或修复。肌肉损伤再生模型常用于分析肌肉再生过程中相关分子所起的作用。铁死亡作为一种新型的细胞死亡方式,是否影响肌肉损伤后再生仍是未知。作为一种病理性的细胞死亡,铁死亡已被证实与多种组织损伤和疾病相关,包括缺血再灌注损伤和神经退行性疾病等。本研究旨在探究铁死亡对肌肉再生的影响。我们首先构建了CTX 肌肉损伤再生模型,通过H-E染色发现有炎症细胞的浸润,并在RNA 及蛋白水平上发现Myod等指标在第3日水平升高,验证了肌肉损伤再生模型构建成功。接下来,我们检测在肌肉损伤修复过程中是否有铁死亡的发生,发现在CTX 注射后第3 日铁死亡相关指标Acsl4和Hmox-1在RNA 和蛋白水平上有明显上升趋势,提示在CTX 诱导的肌肉损伤模型中有铁死亡的发生。
接下来我们通过RNA-seq实验探究铁死亡在损伤过程中发挥怎样的作用。实验结果显示中性粒细胞的脱颗粒化,以及吞噬作用中的磷脂等信号通路发生了明显的改变。有意思的是,我们发现在显著变化的基因中Ctss的表达有明显升高趋势。CTSS 属于溶酶体半胱氨酸蛋白酶家族,在巨噬细胞和树突状细胞中被鉴定为一种主要的内蛋白酶;在小鼠中,Ctss基因的缺失并不影响其生存能力。在组织损伤和炎症中分泌的CTSS,参与细胞外基质(extracellular matrix,ECM)的重塑和组织愈合[21]。除了在抗原加工中的作用,CTSS还参与组织重构过程中ECM 的构建。之前已有文献[22]报道急性肌肉损伤及mdx 小鼠[进行性假肥大性肌营养不良(Duchenne's muscular dystrophy,DMD)模型]的肌肉中,CTSS 蛋白表达水平和蛋白水解活性显著提高。Ctss基因的缺失会增加肌纤维肌膜的稳定性、 提高整合素和β-dystroglycan 的表达以及膜定位的准确性,从而维持骨骼肌结构的稳定性[21,23]。我们推测,抑制铁死亡后Ctss基因的表达升高导致肌纤维坏死增加,从而表现出肌肉组织病理学功能缺陷,以及肌肉损伤后再生过程的延缓。但CTSS 具体参与铁死亡哪一条通路仍是未知,还需进一步探究。
接下来我们想知道铁死亡在肌肉再生的过程中是否起主要作用,于是通过用铁死亡抑制剂DFO 和UAMC-3203腹腔注射预处理后建立肌肉损伤模型,从RNA和蛋白水平检测肌肉再生相关标志物的表达。结果显示注射铁死亡抑制剂组相较于生理盐水组肌肉生长因子的表达水平明显下降。到第7 日无论是生理盐水组还是铁死亡抑制剂组肌肉坏死水平都有所恢复,但铁死亡抑制剂组较生理盐水组相比恢复得较慢,仍能看到部分损伤。本研究取样截止时间点选在第7日,肌肉损伤后再生完全恢复时间还有待于进一步探究和摸索。最近,有学者[7]证明,细胞坏死性凋亡能通过促进TNC的释放促进肌肉再生,其意义在于探究细胞坏死在生理过程中发挥积极的作用。另一方面,在慢性肌肉疾病(如DMD)中,肌纤维是否发生坏死仍有争议[22-23]。此外,有研究[23]观察到CTX急性损伤再生模型中,野生型小鼠的肌肉干细胞并未发生坏死,而在mdx小鼠中有一群非竞争的肌肉干细胞有坏死的症状。这些结果表明,铁死亡可能参与急性和慢性肌肉再生,但扮演着不同的角色。
综上所述,本研究显示了经DFO 和UAMC-3203处理后肌肉再生能力有所下降,提示铁死亡的发生可能帮助了肌肉的再生,这将为我们拓展对铁死亡的病理功能的认识提供新思路。
