铁改性生物炭对水稻土中砷/铁还原的影响
2022-05-05何璇钱子妍吴川崔梦倩薛生国
何璇,钱子妍,吴川,崔梦倩,薛生国
(中南大学冶金与环境学院,长沙 410083)
砷(As)是自然界中广泛存在的有毒类金属元素,对动植物的生长、代谢和发育具有强烈的危害作用。国际癌症组织将As 定义为一组已知的人类致癌物,全球有数百万人遭受慢性As中毒的威胁。水稻作为人类最主要的粮食作物,由于其通常种植在淹水条件的土壤中,同其他粮食作物相比,它对As的吸收转运与累积能力更强。然而,由于使用受As污染的地下水进行灌溉或在水稻种植区周围开展采矿活动,世界各地水稻土As 污染环境问题日趋严重。水稻土中的As 包括无机As 和有机As,无机As的毒性和生物有效性均高于有机As。
厌氧条件下,环境中的As、Fe 具有高度的相关性。Fe(Ⅱ)/Fe(Ⅲ)是土壤中活跃的电子供体/受体,其生物氧化还原反应很大程度上与As 的迁移转化相关联。环境中存在大量的Fe 循环微生物,异化Fe还原菌在还原溶解Fe(Ⅲ)矿物的同时会促进吸附于矿物表面的As 的释放,而Fe 氧化菌介导的二次矿化过程又能通过再吸附或共沉淀的方式固定As。不同微生物介导的As、Fe 转化机制不尽相同,故而环境中微生物群落多样性通常是影响As、Fe的迁移转化的重要因素。土壤中含有大量溶解性有机质(DOM),溶解性有机碳(DOC)是DOM 的重要组成部分。DOC 中存在的大量氨基酸小分子物质,不仅可以作为直接碳源参与微生物介导的氧化还原过程,还能与金属氧化物发生络合作用。因此,DOC 在As、Fe迁移转化过程中可能扮演着关键角色。腐殖质中存在着大量醌类基团使其具有高度活跃的电化学特性,能够作为电子穿梭体耦联微生物的胞外电子传递,积极地参与金属的氧化还原过程。含醌/半醌基团结构物质具有介导重金属还原的作用,如蒽醌-2,6-二磺酸盐(AQDS),是公认的氧化还原活性单位,常被选为模式醌类电子中介体来介导微生物的电子穿梭过程。WU 等在生物炭作为电子穿梭体对水铁矿还原及As 转化的影响研究中,选用AQDS 作为对照处理。安文慧等在生物炭对含As(Ⅲ)水铁矿还原过程中As形态及矿物转化的影响研究中,同样探索了AQDS对含As(Ⅲ)水铁矿化学还原和异化还原的影响。研究报道,AQDS 能够显著增强微生物、矿物及吸附固定于矿物表面的As、Cr等重金属间的电子传递作用,促进重金属的还原释放。
生物炭是一种具有高比表面积和丰富官能团的多孔介质,在保持土壤肥力、固碳、去除金属污染物等方面发挥着重要作用。除了溶解态的含醌/半醌基团结构物质AQDS 之外,生物炭作为具有醌类基团的固态电子中介体也能积极参与环境中许多生物和非生物过程的氧化还原反应,提高厌氧环境中微生物还原 Fe 氧化物的能力。Fe 氧化物在土壤胶体中占有重要比重,因其具有较大比表面积和较多活性吸附位点,可以与重金属离子发生吸附-共沉淀过程,其反应机制为Fe 氧化物表面的特定官能团与重金属离子发生络合作用,从而形成络合物并逐渐沉淀。先前的研究表明,通过结合含Fe物质优良的固As 性能与生物炭的高比表面积与电子传递的特点,制备成铁改性生物炭,能够有效降低土壤中As的生物有效性,从而减少As 在水稻中的富集。然而,铁改性生物炭调控土壤As、Fe形态转化的机制尚不明确。因此,本研究选取生物炭、铁改性生物炭和AQDS 3种外源材料,从DOC、微生物群落结构角度出发,研究其对水稻土中As、Fe 形态转化过程的影响,拟为土壤As污染问题提供一定的理论支撑。
1 材料与方法
1.1 供试土壤
供试土壤采自湖南某矿区周边As 污染水稻土,取样深度约为0~20 cm,土壤样品置于自然条件下风干,研磨后过10 目筛备用。再取部分土壤过100 目筛,土壤基本理化性质根据《土壤农业化学分析方法》测得:pH 为7.20,有机质、有效钾、有效氮含量分别为3.30、47.13、0.75 g·kg,土壤中Fe、Al、Mn、As 含量依次为41.84、64.32、2.10、140.9 mg·kg,其中土壤As 含量超过《土壤环境质量农用地土壤污染风险管控标准》(GB 15618—2018)中的风险筛选值(30.0 mg·kg)。
1.2 生物炭与铁改性生物炭的制备
1.2.1 生物炭的制备
制备生物炭的水稻秸秆选自长沙望城区的水稻种植区。使用去离子水多次清洗以去除水稻秸秆表面残留物,自然条件下风干,研磨后过100 目筛,置于300 ℃的马弗炉(SX2-5-12,长沙远东热电有限公司,中国)中炭化1 h(以17 ℃·min升温)。蒸馏水洗至中性,70~80 ℃烘干,贮存备用。
1.2.2 铁改性生物炭的制备
取10 g 上述制备的生物炭放入100 mL 浓度为0.750 mol·L的 FeSO·7HO(20.85 g)溶液中,将30%HO(3.860 mL)以0.40 mL·min的滴加速度缓慢加入,以保持(FeSO·7HO)∶(HO)=1∶0.5,最后,将混合溶液置于磁力搅拌器,30 ℃条件下搅拌24 h,过滤、烘干备用。
1.3 实验设计
土壤样品的批次实验在真空厌氧箱中进行,称取4.0 g 土壤样品置于血清瓶中,加入不同材料,充氮气5 min,排除瓶中氧气以营造厌氧环境,加橡胶塞并用铝盖密封,置于30 ℃恒温培养箱中。基于前人研究生物炭、铁改性生物炭和AQDS 对As 形态转化的影响结果,试验处理如下:对照(CK),4.0 g 土壤;生物炭(CS),0.120 g 生物炭和4.0 g 土壤;铁改性生物炭(CFS),0.120 g 铁改性生物炭和 4.0 g 土壤;AQDS(AS),12 mL AQDS(将 AQDS 溶于 NaAc 溶液中,最终浓度为 0.050 mmol·L)和 4.0 g 土壤。上述样品均包括12.0 mL 乙酸钠(NaAc)。每组处理中不同样品设置3个平行样。采集1、7、11、20、27、35、42、49 d 的样品,测定总铁Fe(T)和二价铁Fe(Ⅱ)浓度、总砷As(T)和三价砷As(Ⅲ)浓度及DOC 含量变化,选取培养49 d后的样品,借助荧光分光光度计观察液相层中DOC 变化,分析体系中生物炭、铁改性生物炭和AQDS 对As、Fe 形态转化以及水稻土中微生物群落结构的影响。
1.4 测定方法
1.4.1 As、Fe浓度的测定
用针式注射器抽取血清瓶内一定体积的上清液,过0.450 µm 滤膜后备用。Fe(T)和Fe(Ⅱ)浓度采用邻菲罗啉分光光度计比色法测定。As(T)和As(Ⅲ)浓度分别采用氢化物-原子荧光仪(HG-AFS,AFS-8230,北京吉天仪器有限公司,中国)和高效液相色谱-原子荧光光谱联用光谱仪(HLCP-HG-AFS,Shimadzu LC-15C,苏州仪器有限公司,中国;HGAFS,AFS-8230,北京吉天仪器有限公司,中国)进行测定,每组重复3次。
1.4.2 DOC含量的测定
采用0.45 µm 滤膜过滤待测液,滴加少量硝酸,采用总有机碳仪(TOC-5000A,Shimadzu,日本)测定溶液中DOC 含量。采用荧光分光光度计(F-4600,Hitachi,日本)测定三维荧光光谱,对样品溶液的DOC进行表征,扫描的波长范围为Ex:200~400 nm,Em:250~550 nm,PMT 电压为 400 V,扫描速度为 12 000 nm·min。
1.4.3 微生物群落结构的测定
采用16s rRNA 基因测序对实验中4 组样品进行分析。样品中微生物群落DNA 采用土壤快速DNA Spin 试剂盒(MP Biochemical,美国)进行提取,使用Nano Drop 2000 测定 DNA 浓度和纯度。采用通用引物515F(5'-GTGCCAGCMGCCGCGG-3')和806R(5'-GGACTACVSGGGTATCTAAT-3')对16S rRNA的V4区进行扩增,扩增条件为:95 ℃预变性3 min,27个循环(95 ℃,变性30 s;55 ℃,退火30 s;72 ℃,延伸45 s),最后 72 ℃稳定延伸10 min。将同一样本的PCR 产物混合后使用2%琼脂糖凝胶回收PCR 产物,利用 AxyPrep DNA Gel Extraction Kit(Axygen Biosci⁃ences,Union City,CA,美国)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer(Pro⁃mega,美国)对回收产物进行检测定量。纯化合格后应用Illumina HiSeq系统,在上海美吉生物医药科技有限公司基因组平台上进行高通量测序。
1.4.4 数据处理
使用Excel 2010和SPSS 13.0进行数据分析,借助MEV 分析微生物群落结构聚类,采用Origin 9.0 绘制图表。
2 结果与讨论
2.1 铁改性生物炭对水稻土中As还原的影响
As(T)和 As(Ⅲ)的浓度变化曲线如图 1 所示。随着培养时间的增加,CK、CS、CFS 和 AS 处理组上清液中As(T)基本呈逐渐增加趋势,其中生物炭处理中土壤溶液As(T)浓度最高,其次是AQDS、对照土壤,最低的是铁改性生物炭处理。培养至49 d时,各处理As(T)浓度由高到低依次为409.8、383.5、318.4 µg·L和139.6 µg·L。这说明外源材料的添加对 As 释放的影响在整个过程中占据主导地位。铁改性生物炭处理中As(T)浓度明显低于其他处理,表明铁改性生物炭会对As 产生钝化作用,降低As 的活性,减少体系中As 的还原释放。前期研究表明,生物炭和铁改性生物炭的比表面积分别为4.490、4.440 m·g,铁改性生物炭表面较生物炭相比更为粗糙,且出现了黄钾铁矾[KFe(SO)(OH)]的矿物峰。本研究中生物炭和铁改性生物炭处理组中As(T)浓度呈现先升高再降低的趋势,原因可能是随着培养时间的延长,铁改性生物炭中存在的黄钾铁矾逐渐通过吸附作用降低As的浓度,对As产生钝化效果。
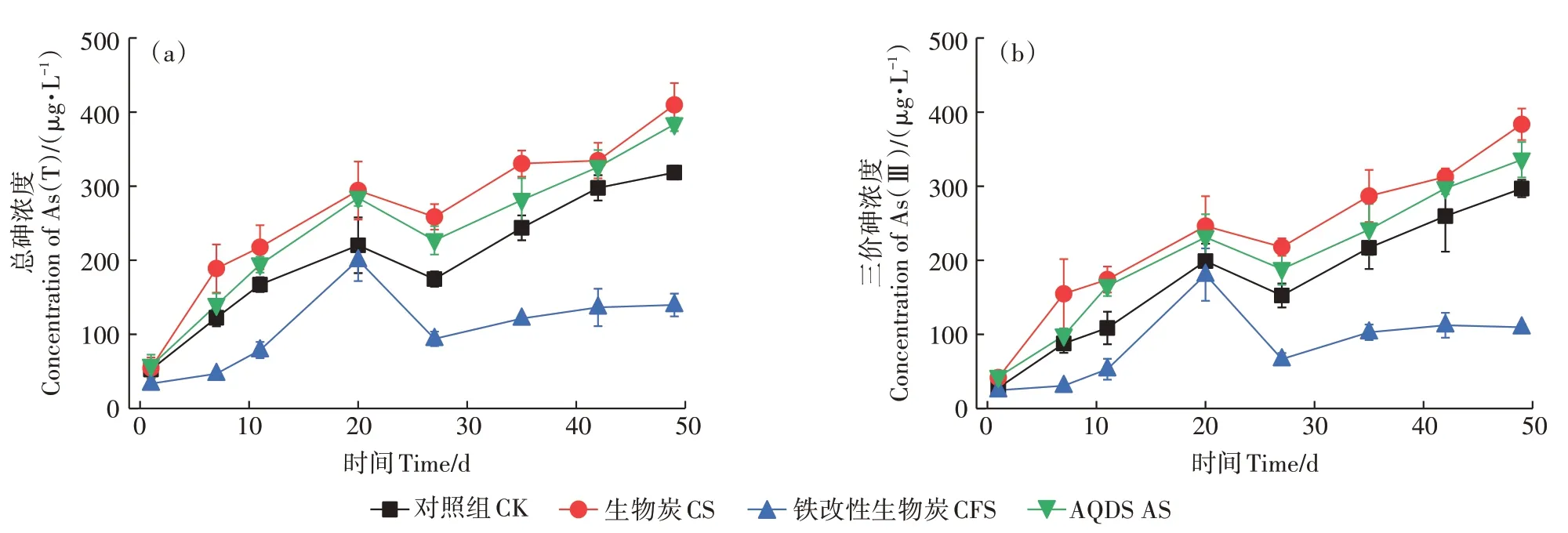
图1 不同处理土壤释放的As(T)和As(Ⅲ)浓度Figure 1 The soluble As(T)and As(Ⅲ)contents released from the soil
As(Ⅲ)浓度与As(T)的变化趋势一致,随着培养时间的延长,As(Ⅲ)浓度逐渐增加,培养至49 d 时,CS、AS、CK、CFS 处理组中As(Ⅲ)浓度分别为383.6、335.7、296.9 µg·L和109.7 µg·L。这说明生物炭和AQDS 均能促进As(Ⅲ)的还原释放,且生物炭促进As(Ⅲ)释放的能力优于AQDS。在本实验中,AQDS表现出较强的电子介导作用,能促进As 的还原,与CHEN 等的研究结果一致,即低浓度(0.050 mmol·L)的AQDS 作为电子穿梭体可以介导As(Ⅴ)还原。生物炭、AQDS 的电子穿梭功能促进了电子在细菌与As、Fe 之间的转移,对As 的还原起到促进作用,这与之前的许多研究一致。由于铁改性生物炭具有高比表面积、电子传递作用和优良固As 性能,能很好吸附被还原释放出的As(Ⅲ),故CFS 处理组中As(Ⅲ)浓度低于其他处理组。体系中As 的价态以As(Ⅲ)为主,一方面可能是As/Fe 还原微生物在其中起到重要作用,添加的外源物质NaAc 既可以为微生物提供生长所需的营养物质,保证微生物的活性,又能为As(Ⅴ)的还原提供电子供体,从而影响As 的还原。另一方面还原态As 的出现是因为生物炭、AQDS 和铁改性生物炭结构本身具有大量醌类基团,也会对 As产生一定的还原作用。
2.2 铁改性生物炭对水稻土中Fe还原的影响
图2 反映的是Fe(T)和Fe(Ⅱ)浓度的变化趋势,Fe(T)和Fe(Ⅱ)浓度均随培养时间的增加而增加,与As(T)和As(Ⅲ)浓度变化趋势一致。土壤溶液中的As主要以As(Ⅴ)的形式与Fe(氢)氧化物发生吸附和共沉淀作用,在生物/非生物的还原作用下,Fe矿物发生还原溶解,使得原本固定在矿物表面的As(Ⅴ)也随之还原,并释放出As(Ⅲ),因而,As、Fe浓度变化呈现高度的一致性。众多学者研究表明异化Fe 还原过程会耦合As 的还原释放,这与本研究结果一致。前期研究结果表明,铁改性生物炭中O/C 和(O+N)/C 的比值均高于生物炭。因此,在本研究中,生物炭和铁改性生物炭对As、Fe 还原的影响存在一定差异,原因可能是铁改性生物炭与生物炭相比,其表面极性官能团更多,更具有亲水性。培养至49 d时,不同处理组Fe(T)和Fe(Ⅱ)浓度依次为CFS>AS>CS>CK,Fe(T)浓度依次为 206.0、190.8、150.6、91.71 mg·L,Fe(Ⅱ)浓度依次为166.3、155.1、123.8、72.43 mg·L。生物炭、铁改性生物炭和AQDS 对 Fe 具有不同的还原效果,这主要是由材料本身的比表面积及电子传递性能方面存在的差异引起的,这些外源材料可能在异化Fe 还原过程中充当电子中介体的角色,并影响底物DOC 组成,从而进一步影响Fe 还原过程。

图2 不同处理土壤释放的Fe(T)和Fe(Ⅱ)浓度Figure 2 The soluble Fe(T)and Fe(Ⅱ)contents released from the soil
由于AQDS 中存在大量醌类结构,能够充当一种纯电子穿梭体来介导Fe的还原,而生物炭作为带有醌类基团的固态电子中介体,利用自身的多孔性及高比表面积吸附环境中的金属,故生物炭处理组中Fe(T)和Fe(Ⅱ)浓度均低于AQDS 处理组,安文慧等的实验结果也验证了此观点。铁改性生物炭处理的土壤溶液中的Fe(T)和Fe(Ⅱ)浓度最高,一方面是材料本身存在的Fe 会逐渐释放到体系中,导致体系中的Fe浓度增加;另一方面,铁改性生物炭同时具备含Fe 物质和生物炭的优良特性,表面存在大量醌类和吩嗪类基团,具有较强的氧化还原能力,不仅可以作为电子供体和电子受体,还能充当电子穿梭体,促进微生物-腐殖质-土壤之间的电子传递。体系中的Fe 主要以Fe(Ⅱ)形态存在,其原因是生物炭、铁改性生物炭和AQDS 能促进更多的电子被电子受体Fe(Ⅲ)接受,从而发生还原反应,并生成Fe(Ⅱ)。此外,各处理添加的NaAc 不仅为Fe 的非生物还原提供电子供体,也能促进土壤微生物的代谢活性并改变微生物群落结构,从而可能促进Fe 的生物还原。有研究报道,向铀元素污染的地下水中注入1~3 mmol·LNaAc 有利于sp 等铁还原微生物的富集,这也证实本研究中NaAc的作用。
2.3 铁改性生物炭介导下DOC对水稻土中As/Fe还原的影响
生物炭、铁改性生物炭和AQDS促进土壤中As(Ⅴ)/Fe(Ⅲ)的还原,这一过程主要是在生物炭、铁改性生物炭和AQDS 的作用下,更多的电子被电子受体As(Ⅴ)/Fe(Ⅲ)接受,从而发生还原反应生成As(Ⅲ)/Fe(Ⅱ)。氧化反应与还原反应必然同时进行,因此非常有必要探讨电子供体失去电子,发生氧化反应的过程。电子供体失电子的过程更多来源于大分子的DOC 被氧化分解成小分子化合物,此外,铁改性生物炭的介导作用很大程度上是在有微生物的作用下完成的,所以铁改性生物炭对微生物群落结构的改变也是影响土壤中As(Ⅴ)/Fe(Ⅲ)还原的重要因素之一。在整个培养周期内,体系中DOC 呈现稳定的下降趋势(图3)。对照组、生物炭、铁改性生物炭、AQDS 处理中的DOC 含量的变化范围为384.3~806.8、344.7~800.8、350.0~782.8、433.8~933.3 mg·L,分别下降了52.37%、56.96%、55.29%和53.52%,各处理间存在显著差异(<0.05)。由此可见,生物炭、铁改性生物炭、AQDS 等外源材料的添加,在一定程度上能降低体系中的DOC 含量。值得注意的是,在添加生物炭和铁改性生物炭的培养体系中,剩余的DOC 反而更低,说明生物炭和铁改性生物炭处理后会有更多的DOC 会以电子供体的形式被氧化分解。生物炭和铁改性生物炭可以充当微生物和不溶性电子受体之间的电子穿梭体,增加As/Fe 还原菌的丰度,从而促进DOC的分解利用。
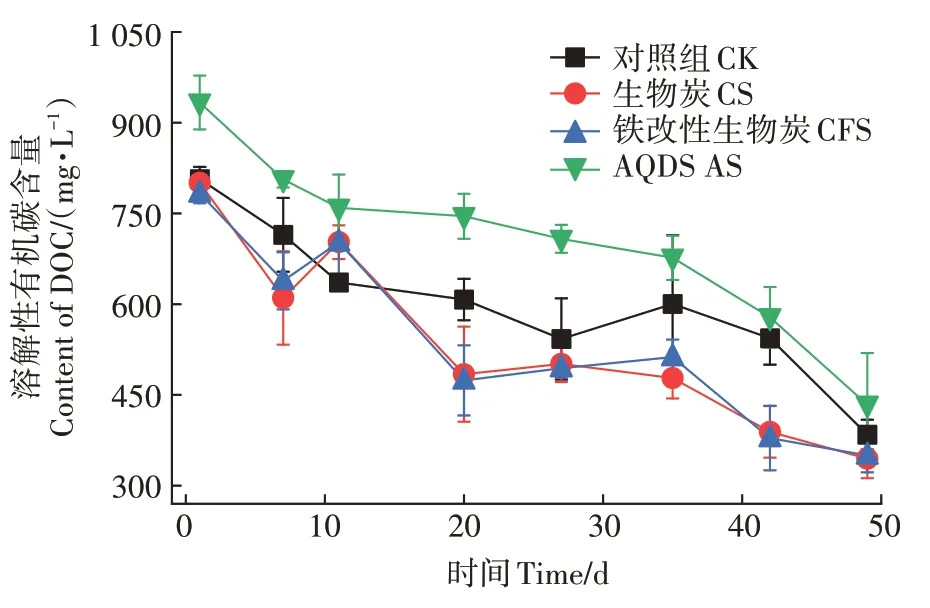
图3 不同处理上清液中DOC浓度Figure 3 The DOC contents of liquid layer among different treatments
选取经过49 d培养后的样品,用三维荧光光谱仪观察液相层中DOC 的变化,进一步分析DOC 的化学特性。如图4所示,A 区代表有机质的类蛋白,B 区代表富里酸,C区代表可溶性微生物代谢产物,D区代表腐植酸,通过其荧光图谱信号峰强度来判断几种特征化合物在 DOC 中的丰度。CS、CFS、AS 处理组的 B 和D 区域荧光峰强度显著高于对照土壤。这是由于外源材料的添加促进了固相层中微生物的生长代谢,促使其中的陆源性及外源性有机质分解并进入液相层中。其中,生物炭和铁改性生物炭两个处理效果明显优于AQDS处理,荧光峰更明显,原因是AQDS会对荧光产生一定淬灭现象。CHEN 等的研究表明,乙酸钠和外源电子穿梭体物质的添加能够显著增加固相介质中三维荧光光谱的A、C区的荧光信号,标志着微生物代谢活性的增强。而在本研究中,液相层中A 和C 区域的荧光信号变化并不明显,推测可能是因为微生物主要附着在溶液中的固相介质上,其代谢副产物较少释放到液相层中。

图4 第49 d样品液相层中DOC的三维荧光光谱图Figure 4 The EEM fluorescence spectra of DOC in the liquid layer in 49th day treatments
生物炭、铁改性生物炭和AQDS 等外源物质作为电子穿梭体能促进微生物与DOC 间的电子传递,促进液相层中有机质的腐殖化,从而导致腐植酸和富里酸的增多。生物炭和铁改性生物炭处理中腐植酸和富里酸的荧光峰更明显,因而,在微生物作用下,这两个处理的土壤中会有更多的有机质转化为腐殖质。研究表明,腐殖质具有重要的电子中介体官能团——醌基及半醌基团,在接近中性的环境中,能充当电子穿梭体促进金属元素的还原过程。这一定程度上也说明生物炭和铁改性生物炭的介导作用可能还存在另一种影响机制,即通过强化腐殖化程度并利用腐殖质作为电子中介体来调控As(Ⅴ)/Fe(Ⅲ)的还原。
2.4 铁改性生物炭对水稻土中微生物群落结构的影响
从微生物群落结构的Venn 图(图5)中可以看出,CK、CS、CFS 和 AS 处理的 OTU 数目分别为 868、1 105、1 155 和 1 066。CS、CFS、AS 处理组的 OTU 数目均显著高于CK 组,分别增加了237、287、198,说明添加外源物质的3 个体系中的微生物较土壤相对丰富,其中铁改性生物炭处理效果最好。4 组处理间共有OTU 数目为508,代表体系中共有的微生物,而独有的OTU 数目分别为86、136、137、195,可以看出外源物质的添加在不同程度上促进微生物数量的增长,使微生物群落结构呈现一定差异。
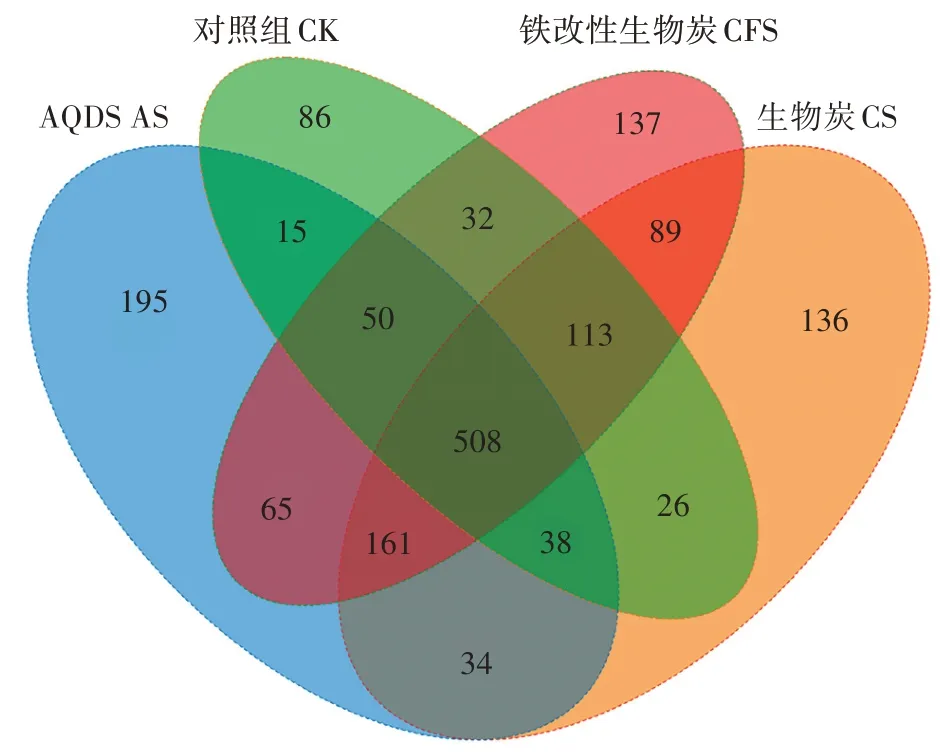
图5 微生物群落OTU水平的Venn图Figure 5 The Venn diagram of bacterial 16S rRNA gene at OTU level
在门水平上检测细菌16S rRNA 基因的相对丰度,以确定微生物群落的组成。如图6 所示,在对照组中,变形菌门(Proteobacteria)、厚壁菌门(Fir⁃micutes)、放线菌门(Actinobacteria)和绿弯菌门(Chlo⁃roflexi)是优势菌群,相对丰度依次为32.19%、16.92%、12.97%和12.61%。在生物炭处理中,优势菌群为变形菌门、绿弯菌门、厚壁菌门和放线菌门,相对丰度分别为23.64%、17.62%、16.32%和12.09%。铁改性生物炭处理中,优势菌群为绿弯菌门、变形菌门、厚壁菌门和放线菌门,相对丰度分别为30.70%、24.61%、17.89%和9.11%。AQDS 处理中,变形菌门、绿弯菌门,厚壁菌门和放线菌门相对丰度较高,分别为32.19%、15.85%、15.47%和14.59%。

图6 微生物群落门结构的分布水平Figure 6 Relative abundance of bacterial 16S rRNA gene at phylum level
由相对丰度数据可以看出,4 组处理之间的优势种群有所差异,但均含有变形菌门、厚壁菌门、放线菌门和绿弯菌门等相对丰度较高的优势物种,约占细菌总量的70.0%。外源材料的添加在提高一部分微生物相对丰度的同时,也会对剩余微生物产生一定抑制作用。生物炭和铁改性生物炭处理中的变形菌门相对丰度有所下降,原因是变形菌门中存在一些铁氧化菌,而铁氧化菌在一定程度上会抑制As/Fe 的还原过程,这也与2.2 中的Fe 还原数据一致,这两组处理能显著促进Fe 的还原过程。厚壁菌门在不同处理间变化较小,说明其生长环境较适宜,具有一定的稳定性。铁改性生物炭处理中的放线菌门丰度低于其他处理,原因是放线菌门更趋向于酸性环境中生长,而铁改性生物炭的加入在一定程度上会增加土壤pH值,从而降低放线菌门丰度。铁改性生物炭处理组中,绿弯菌门相对丰度显著增加,原因在于其中含有和等铁还原菌,能够促进 As/Fe 的还原。QIAO 等的研究表明,这些微生物对重金属污染土壤中As、Fe 的还原具有一定促进作用。
根据4 组处理的物种信息绘制成热点聚类图(图7),主要包含物种及处理两个方面。选取物种丰度排名前35 的属进行聚类整合。图示上方聚类树是处理聚类树,左侧是物种聚类树。可以将其分为两组,第一组为CK 与AS 处理组,第二组为CS 与CFS 处理组,两组内的优势种群亲缘关系的分支较为接近,而组间差异性较大,说明优势物种在不同处理之间有所不同。是CK 与AS 处理组中丰度最高的属,而在CS 与CFS 处理组中丰度较低,CS 处理组中丰度最高,CFS 中丰度最高。虽然4 组处理中均存在一些相同的属,但它们的丰度有所差别。CK 中、、为优势种群。AQDS 中、、较为丰富。CS 中、较为丰富。CFS 中、为优势种群。其他种群之间差异较小,说明微生物群落在一定程度上处于相对稳定的状态。

图7 微生物群落属结构的聚类热图Figure 7 The heat map of bacterial 16S rRNA gene at genus level
是一种具有As/Fe 还原功能的微生物,该菌的功能基因具有As 呼吸还原的功能,功能基因则在解毒机制过程中发挥作用,参与As 的生物地球化学过程,也在Fe 的还原过程中通 过 Fe 螯合物传递电子完成 Fe 的还原过程。DAI 等的研究表明,在江汉平原地区水稻土中,在Fe 的还原与As 的释放过程中扮演重要作用。QIAO 等的研究表明,生物炭的加入会增加、、等 As/Fe还原菌的丰度。CHEN 等的研究发现,、、和受 生 物 炭影响显著,广泛分布于许多金属还原环境。本研究中铁改性生物炭处理组与其他处理相比,As/Fe 还原菌(如、和)的相对丰度显著增加,说明铁改性生物炭通过影响As(Ⅴ)/Fe(Ⅲ)还原菌相对丰度,进而调控As(Ⅴ)/Fe(Ⅲ)还原。
3 结论
(1)铁改性生物炭对水稻土中的As 具有钝化作用,能减缓体系中As(Ⅲ)的还原释放,促进Fe(Ⅱ)的还原释放。
(2)施加铁改性生物炭会改变DOC 的生物利用性和微生物群落结构,降低DOC 含量,显著增加As/Fe 还原菌(、和)的相对丰度,调控As(Ⅴ)/Fe(Ⅲ)的还原。
(3)铁改性生物炭调控As(Ⅴ)/Fe(Ⅲ)还原的机制是:一方面通过促进DOC 氧化分解并使其失去电子,电子受体As(Ⅴ)/Fe(Ⅲ)得到电子后完成还原过程;另一方面促进液相层中DOC 的腐殖化过程,在微生物作用下会有更多的有机质转化为腐殖质,腐殖质又可以作为电子中介体来调控As(Ⅴ)/Fe(Ⅲ)的还原。
