QTc、Tp-Tec 间期联合血清CTRP9 水平对急性心肌梗死后室性心律失常发生的预测价值
2022-05-04朱明辉杨磊殷珺妹张磊刘迎午
朱明辉,杨磊,殷珺妹,张磊,刘迎午
1 天津市第三中心医院心脏内科,天津300170;2 天津市第三中心医院心功能室;3 天津市第三中心医院医学统计室;4 天津市第三中心医院检验科
急性心肌梗死(AMI)是冠心病的严重类型,具有起病急、进展快、并发症多、病死率高等特点。AMI 发生后心肌细胞延迟后除极、电解质紊乱以及局部儿茶酚胺浓度升高等易引起室性心律失常(VA),而VA 是导致AMI 患者猝死的主要原因[1-2]。有研究报道,AMI 后VA 患者QT、Tp-Te 间期较健康人群明显延长[3]。QT、Tp-Te 间期延长提示VA 的发生风险增加。随着心电图诊断技术不断发展,近年来以按心率校正的QT(QTc)、按心率校正的Tp-Te(Tp-Tec)间期为代表的心电图指标被广泛用于心律失常的诊断。心室重构是心律失常发生的病理基础[4]。补体1q/肿瘤坏死因子相关蛋白9(CTRP9)是一种新发现的脂肪细胞因子。研究证实,CTRP9 具有显著的抗心室重构作用,抑制CTRP9 可引起心室重构[5]。但目前血清CTRP9 水平与AMI 后VA 发生的关系尚不明确。本研究探讨了QTc、Tp-Tec 间期联合血清CTRP9 水平对AMI 后VA 发生的预测价值。现报告如下。
1 资料与方法
1.1 临床资料 选择2019 年1 月—2021 年6 月天津市第三中心医院收治的AMI 患者156 例。AMI 诊断符合《急性冠脉综合征急诊快速诊疗指南》[6]。纳入标准:①符合AMI 诊断标准;②年龄≥18 岁;③临床病历资料完整。排除标准:①既往有VA 史者;②近期使用抗心律失常药物者;③存在严重电解质紊乱或肝肾功能不全者;④合并恶性肿瘤或急慢性感染者。根据《室性心律失常中国专家共识》[7],156例AMI患者住院期间发生VA 61例(VA 组)、未发生VA 95例(non-VA组)。本研究经天津市第三中心医院医学伦理委员会批准(审批编号:2018-030-02),患者或其家属知情同意并签署书面知情同意书。
1.2 心电图检查 所有研究对象入院时先行常规心电图检查(走纸速度25 mm/s、标准电压10 mm/mV),然后接受24 h 动态心电图监测,记录QT、Tp-Te 间期,根据Bazetts 公式计算QTc、Tp-Tec间期。QTc 间期=QT 间期/RR0.5,Tp-Tec 间期=Tp-Te间期/RR0.5,RR为标准化的心率值。
1.3 血清CTRP9 检测 所有研究对象入院次日采集清晨空腹肘静脉血3 mL,置于真空采血管中,待血液自然凝固后,3 000 r/min离心20 min、离心半径10 cm,留取上层血清,-80 ℃冰箱保存。采用ELISA法检测血清CTRP9,试剂盒购自上海梵态生物科技有限公司。所有操作严格按试剂盒说明进行。
1.4 资料收集分析 收集所有研究对象一般临床资料、疾病相关资料、实验室检查资料、心电图检查资料。其中,一般临床资料包括性别、年龄、BMI、吸烟史、基础疾病(高血压、糖尿病、高脂血症),疾病相关资料包括入院时Killip 分级、入院后6 h 内左室射血分数(LVEF),实验室检查资料包括入院次日血脂(TC、TG、HDL-C、LDL-C)、血肌酐(Scr)、血尿酸(UA)、空腹血糖(FPG)以及血清CTRP9 水平,心电图检查资料包括QTc、Tp-Tec 间期。比较两组一般临床资料、疾病相关资料、实验室检查资料、心电图检查资料,将有统计学差异的指标纳入多因素Logistic 回归模型,分析AMI 后VA 发生的影响因素。
1.5 统计学方法 采用SPSS26.0 统计软件。服从正态分布的计量资料以±s表示,结果比较采用独立样本t检验;不服从正态分布的计量资料以M(P25,P75)表示,结果比较采用U检验。计数资料比较采用χ2检验。影响因素分析采用多因素Logistic 回归模型。预测效能分析采用受试者工作特征(ROC)曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组QTc、Tp-Tec 间期和血清CTRP9 水平比较 见表1。
表1 两组QTc、Tp-Tec间期及血清CTRP9水平比较(±s)
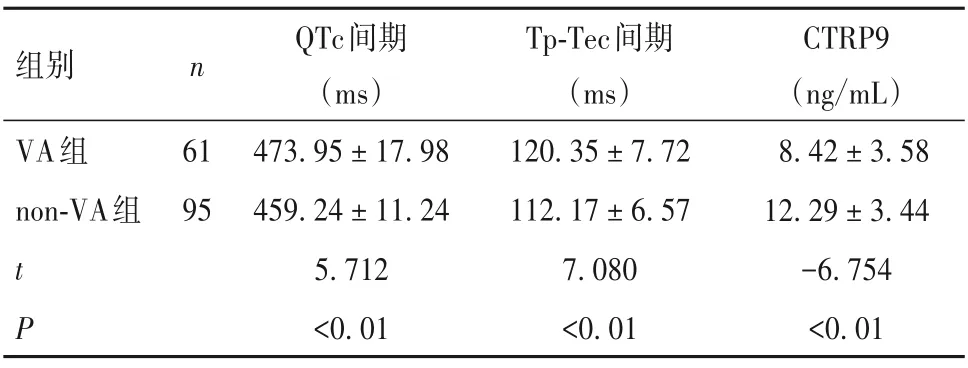
表1 两组QTc、Tp-Tec间期及血清CTRP9水平比较(±s)
?组别VA组non-VA组t P n 61 95 QTc间期(ms)473.95±17.98 459.24±11.24 5.712<0.01 Tp-Tec间期(ms)120.35±7.72 112.17±6.57 7.080<0.01 CTRP9(ng/mL)8.42±3.58 12.29±3.44-6.754<0.01
2.2 AMI后VA发生的影响因素分析 两组一般临床资料比较见表2。VA 组与non-VA 组Killip 分级>Ⅱ级分别有22(36.07%)、18 例(18.95%),LVEF 分别为(47.16 ± 11.56)%、(51.48 ± 11.22)%,VA 组Killip 分级>Ⅱ级比例高于non-VA 组(χ2=5.709,P<0.05),而LVEF 低 于non-VA 组(t=-2.315,P<0.05)。两组实验室检查资料比较见表3。

表2 两组一般临床资料比较
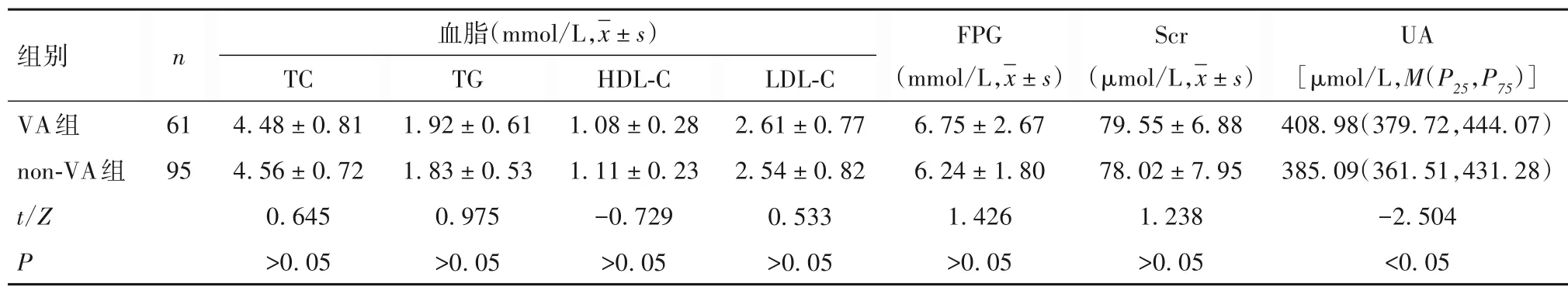
表3 两组血脂、FPG、Scr、UA水平比较
以AMI后是否发生VA(是=1,否=0)为因变量,以Killip分级(Killip分级>Ⅱ级=1,Killip分级≤Ⅱ级=0)、UA、LVEF、QTc间期、Tp-Tec间期、CTRP9为自变量,纳入多因素Logistic回归模型。结果发现,UA、QTc间期、Tp-Tec间期是AMI后VA发生的独立危险因素,而CTRP9则为其独立保护因素(P均<0.05)。见表4。
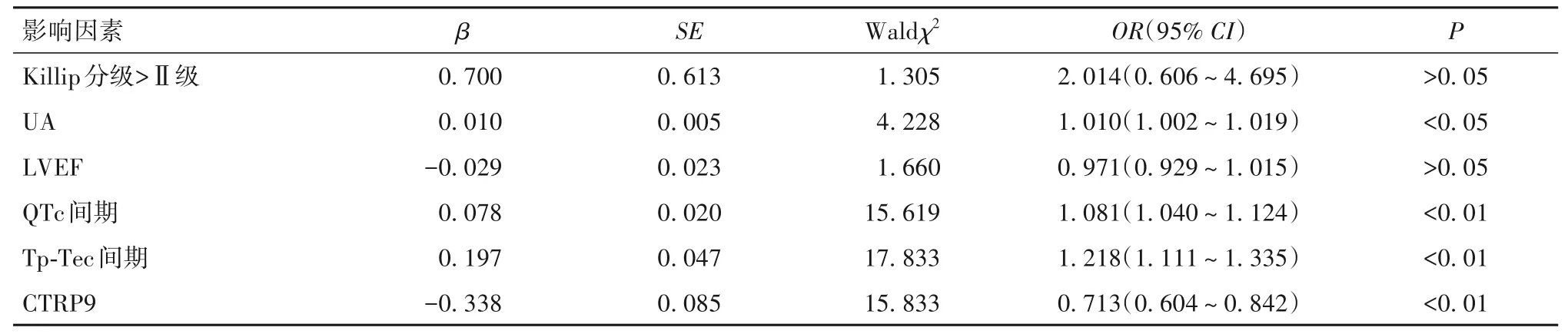
表4 AMI后VA发生的多因素Logistic回归分析结果
2.3 QTc、Tp-Tec 间期和血清CTRP9 水平对AMI后VA 发生的预测效能分析 ROC 曲线分析显示,QTc、Tp-Tec 间 期 联 合 血 清CTRP9 水 平 预 测AMI 后VA 发生的曲线下面积(AUC)明显高于QTc 间 期、Tp-Tec 间 期、QTc 间 期+ Tp-Tec 间 期、血清CTRP9 水平预测AMI 后VA 发生的AUC(Z分别 为3.860、4.370、2.384、3.979,P均<0.01)。见表5。

表5 心电图检查、血清CTRP9水平单独或联合对AMI后VA发生的预测效能
3 讨论
心律失常是指心脏活动的起源和(或)传导障碍导致心脏搏动的频率和(或)节律异常。VA 在临床上较为常见,包括室性早搏、室性心动过速、心室扑动、心室颤动等,其临床表现多样,主要取决于VA的类型和病情程度。VA 发生的病理因素包括电解质紊乱、交感兴奋性增强、室壁张力异常、心室肌肥厚、局部纤维化等[8]。AMI 发生后心肌细胞延迟后除极、电解质紊乱以及局部儿茶酚胺浓度升高等易引起VA。有研究报道,50%以上院外心脏骤停幸存者存在明显的冠状动脉病变,5%~10%AMI患者在入院前就存在心室颤动或室性心动过速,5%AMI患者在入院后出现心室颤动或室性心动过速,尽管血运重建和他汀类药物能够显著降低猝死风险,但VA仍然是AMI患者猝死的主要原因[9]。
AMI 患者心肌缺血、缺氧可导致心肌细胞形态和结构变化,心肌细胞电生理随之出现适应性变化,心肌兴奋性传导和复极顺序发生改变,局部动作电位时程延长,跨壁复极离散度增加,从而诱发VA 和心源性猝死[10]。心电图是诊断心律失常的重要手段。QT 间期是指心电图上QRS 波起点至T 波终点的时间间期,能够反映心室除极和复极激动时间,是观察心肌细胞复极化的重要指标[11]。有研究指出,仅关注QT 间期变化无法准确反映跨室壁复极离散程度,需进一步关注T波变化[12]。Tp-Te间期是指心电图上T 波顶点至T 波终点的时间间期,能够反映跨室壁复极离散程度[11]。因QT、Tp-Te 间期与心率呈反比关系,故临床上通常将QT、Tp-Te间期转换为非心率依赖的校正值。本研究结果显示,VA 组QTc、Tp-Tec 间期明显延长,与林茹秀等[3]研究结果一致。目前,已有多项研究报道QTc、Tp-Tec 间期与AMI 后VA 发生密切相关,但二者对AMI 后VA 发生的预测效能却鲜有报道。本研究结果发现,QTc、Tp-Tec 间期是AMI 后VA 发生的独立危险因素,提示QTc、Tp-Tec间期可作为AMI后VA 发生的预测指标。进一步通过ROC 曲线分析发现,QTc、Tp-Tec间期单独预测AMI 后VA 发生的AUC均不足0.80,预测效能并不出众,而QTc 间期+ Tp-Tec 间期预测AMI 后VA 发生的AUC达到0.878,较二者单独时预测效能明显升高。这可能与QTc间期+Tp-Tec间期能够同时反映心肌细胞复极化和跨室壁复极离散程度有关。
心室重构是指各种损伤使心脏原来存在的物质和心脏的形态学发生变化,是病变修复和心室整体代偿及继发的病理生理反应过程,也是心律失常发生的病理基础[13]。AMI 发生后因心肌梗死、炎症反应以及利钠肽系统、交感神经系统、肾素-血管紧张素-醛固酮系统等神经内分泌系统激活,从而引起心室重构[14]。CTRP9 为CTRPs 家族成员,是一种新发现的脂肪细胞因子,其结构特征与脂联素高度相似。研究证实,CTRP9 对心血管系统具有显著保护作用。如CTRP9 能够抑制动脉粥样硬化斑块中炎症因子表达,增强斑块稳定性,减少斑块脱落导致的脑卒中、AMI甚至猝死;CTRP9还能抑制心肌细胞凋亡、氧化应激、间质纤维化,延缓缺血后心脏病理性重构,从而保护心脏功能[15]。有研究报道,CTRP9能够通过多种途径抑制心肌缺血后心室重构,如抑制G 蛋白偶联受体激酶、激活蛋白激酶A 等[5,16]。由此推测,CTRP9 可能与VA 发生有一定关系。本研究结果显示,VA 组血清CTRP9 水平明显降低;进一步研究发现,CTRP9 是AMI 后VA 发生的独立保护因素。提示血清CTRP9 水平升高能够抑制AMI 后VA的发生。心力衰竭发生和加剧过程中,伴随心脏受到损害的解剖形态学改变,心脏电功能亦发生损害。电重构是心脏电功能损害的早期适应性改变,复极化异常是电重构的一个重要特征,而复极化的电异质性是导致VA 发生的重要原因[17]。内向整流钾通道2.1(Kir2.1)属于内向整流钾通道家族,具备内向整流作用。Kir2.1的主要功能是维持细胞的静息和动作电位,阻止平台期钾离子外流,进而减慢或减弱复极,是静息和动作电位后期复极化的决定因素。有研究报道,Kir2.1 下调能够引起致命性心律失常[18-19]。魏言昭等[20]经颈静脉注射CTRP9 后发现,CTRP9 能够增加AMI 大鼠梗死边缘心肌Kir2.1表达,改善AMI 后心室电生理性质,从而发挥抗VA的作用。本研究ROC 曲线分析显示,血清CTRP9水平预测AMI 后VA 发生的AUC为0.780,提示血清CTRP9 可作为AMI 后VA 发生的预测指标;而QTc、Tp-Tec 间期联合血清CTRP9 水平预测AMI 后VA 发生的AUC达到0.920,提示QTc、Tp-Tec 间期联合血清CTRP9水平对AMI后VA发生的预测价值更高。综上所述,AMI 后VA 患者QTc、Tp-Tec 间期明显延长,血清CTRP9 水平明显降低;QTc、Tp-Tec 间期是AMI 后VA 发生的独立危险因素,而CTRP9 则为其独立保护因素;QTc、Tp-Tec 间期和血清CTRP9水平对AMI 后VA 发生均具有一定预测价值,但QTc、Tp-Tec 间期联合血清CTRP9 水平对AMI 后VA发生的预测价值更高。
