前列腺癌组织前列腺特异性抗原、雄激素受体、嗜铬粒蛋白A表达与Gleason分级的相关性
2022-05-03冯小兰黄喜健
冯小兰,黄喜健
[1.广西壮族自治区民族医院(广西医科大学附属民族医院)病理科;2.广西壮族自治区民族医院(广西医科大学附属民族医院)泌尿外科,广西 南宁 530001]
前列腺癌是老年男性最常见的肿瘤疾病之一,其早期可以根治,但早期却不易发现,转移率较高,多数患者发现时已发展为中晚期,采用内分泌治疗、化疗、放疗等均达不到完全治愈的效果,严重威胁男性的健康和生命,因此对前列腺癌患者提供有效的预后评估指标是目前研究的热点之一。目前前列腺癌病理评分采用的是Gleason评分系统,其从组织学角度评估患者的预后,主要根据肿瘤的生长形态和肿瘤在间质的浸润状况作为分级依据,已成为制定前列腺癌治疗方案和预后评估的重要参考指标之一[1]。前列腺特异性抗原(PSA)筛查在全世界广泛应用,也是临床医师筛查前列腺癌患者的重要参考指标,其高水平表达提示存在前列腺癌的可能;雄激素受体(AR)为雄激素依赖性转录因子,可介导依赖雄激素的细胞功能,是促进前列腺癌发生、发展的关键因素[2];嗜铬粒蛋白A(CgA)是神经内分泌细胞最特异性的标志物,在雄激素缺乏的环境诱导下,前列腺癌细胞可以转化为具有神经内分泌细胞样功能的肿瘤细胞[3]。但目前关于PSA、AR、CgA在前列腺癌发生、发展、浸润、转移中作用的报道有限。基于此,本研究旨在探讨前列腺癌Gleason评分与前列腺癌病理组织PSA、AR、CgA表达的关系,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2016年6月至2021年6月广西壮族自治区民族医院(广西医科大学附属民族医院)收治的65例行经尿道前列腺增生电切术且经术后病理证实为前列腺腺癌患者的临床资料。患者年龄53~88岁,平均(73.62±6.32)岁。诊断标准:符合《诊断病理学(第3版)》[4]中的相关诊断标准,根据腺体上皮细胞出现核间变(核增大、核浆比例增大、核不规则,出现明显大核仁)、腺体结构异常(腺体大小及轮廓不规则)、浸润性生长及免疫组化抑癌基因P63、高分子细胞角蛋白(HCK)基底细胞染色缺失综合判断。纳入标准:符合上述诊断标准者;病理诊断为前列腺腺泡性腺癌患者;有逐渐加重的排尿困难、尿频、尿急等尿路梗阻症状或无痛性肉眼血尿或前列腺增大症状者等。排除标准:合并其他原发性恶性肿瘤者;其他类型前列腺癌或转移癌者;术前经过相应治疗者等。本研究经院内医学伦理委员会审核并批准。
1.2 研究方法
1.2.1 免疫组化染色方法 患者前列腺癌组织经常规苏木精‐伊红染色及免疫组化染色。所有标本经10%中性福尔马林固定,取材、脱水、包埋、连续4 μm厚切片4张,1张行苏木精 - 伊红染色,另3张分别行PSA、AR、CgA免疫组化染色。所有抗体均购自福州迈新公司,采用链霉菌抗生素蛋白 - 过阳化酶(SP)法进行免疫组化检测,以已知阳性前列腺癌组织切片为阳性对照,磷酸盐缓冲液(PBS)代一抗为阴性对照,按说明书进行免疫组化染色步骤操作。
1.2.2 免疫组化结果判定 AR阳性着色定位于细胞核,PSA、CgA阳性着色定位于细胞质,且阳性表达均为棕黄色颗粒。在400倍光学显微镜下,每张切片随机观察10个视野,按阳性细胞所占视野总细胞数量的百分比进行分级:阳性细胞数 < 1%为阴性(-);阳性细胞数1%~10%为弱阳性(+);阳性细胞11%~50%为中度阳性(++);阳性细胞≥ 51% 为强阳性(+++)[5‐6]。
1.2.3 病理Gleason评分 根据2014年国际泌尿病理协会(ISUP)共识会议前列腺癌分级分组标准[7]进行病理分级,该分级系统将前列腺癌组织分为主要和次要分化程度,分化程度(生长方式)从高分化(1级)到低分化(5级)共分为5级,分别为1~5分,Gleason总分=主要结构类型(级别)+次要结构类型(级别),总分2~10分。1级组Gleason评分≤ 6分,形态特点仅由单个分离的、形成良好的腺体组成;2级组Gleason评分3+4=7分,形态特点以形成良好的腺体为主,伴少量形成不良/融合/筛状腺体;3级组Gleason评分4+3=7分,形态特点以形成不良/融合/筛状腺体为主,伴少量形成良好的腺体;4级组Gleason评分4+4=8分,3+5=8分,5+3=8分,形态特点仅有形成不良/融合/筛状腺体或以形成良好的腺体为主,伴少量缺乏腺样分化的成分,或以缺乏腺样分化的成分为主伴少量形成良好的腺体;5级组Gleason评分4+5=9分,5+4=9分,5+5=10分,形态特点缺乏腺体形成(或伴坏死),伴/不伴形成不良/融合/筛状腺体,其中Gleason评分2~4分相当于WHOⅠ级(高分化、低级别癌),Gleason评分5~7分相当于WHOⅡ级(中分化癌),Gleason评分8~10分相当于WHOⅢ级(低分化、高级别癌),但从治疗和预后的角度,Gleason评分可划分为4组:2~4分,5~6分,7分,8~10分。
1.3 观察指标 ①前列腺癌Gleason评分结果。②分析前列腺癌Gleason评分与PSA阳性表达结果。③分析前列腺癌Gleason评分与AR阳性表达结果。④前列腺癌Gleason评分与CgA阳性表达结果。⑤免疫组化染色观察典型病例前列腺癌组织PSA、AR、CgA阳性表达。
1.4 统计学方法 采用SPSS 20.0统计软件分析数据,双向有序等级资料以(例)表示,采用χ2检验;相关性分析采用Spearman一致性检验。以P<0.05为差异有统计意义。
2 结果
2.1 前列腺癌Gleason评分 65例前列腺癌患者按照Gleason评分标准分别分为5~6分(1级组)10例,7分(2、3级组)30例,8~10分(4、5级组)25例。
2.2 前列腺癌Gleason评分与PSA阳性表达的相关性65例前列腺癌患者病理组织标本经免疫组化染色显示,PSA阳性表达率为84.62%(55/65),表达强度以+~++为主,与Gleason评分呈负相关性(r= -0.627),差异有统计学意义(P<0.05),见表1。
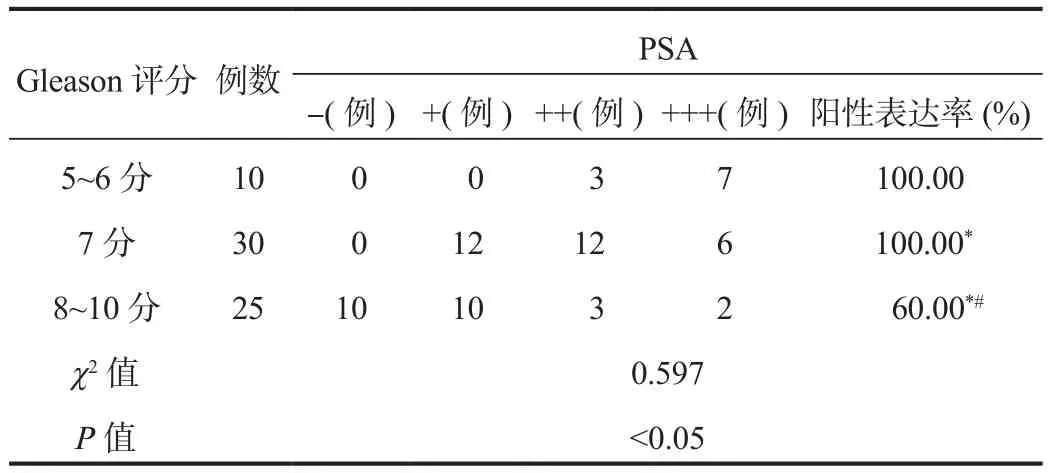
表1 前列腺癌Gleason分级与免疫组化PSA的表达结果
2.3 前列腺癌Gleason评分与AR阳性表达的相关性65例前列腺癌患者病理组织标本经免疫组化染色显示,AR阳性表达率为83.08%(54/65),表达强度以+~++为主,与Gleason评分呈负相关性(r= -0.602),差异有统计学意义(P<0.05),见表2。
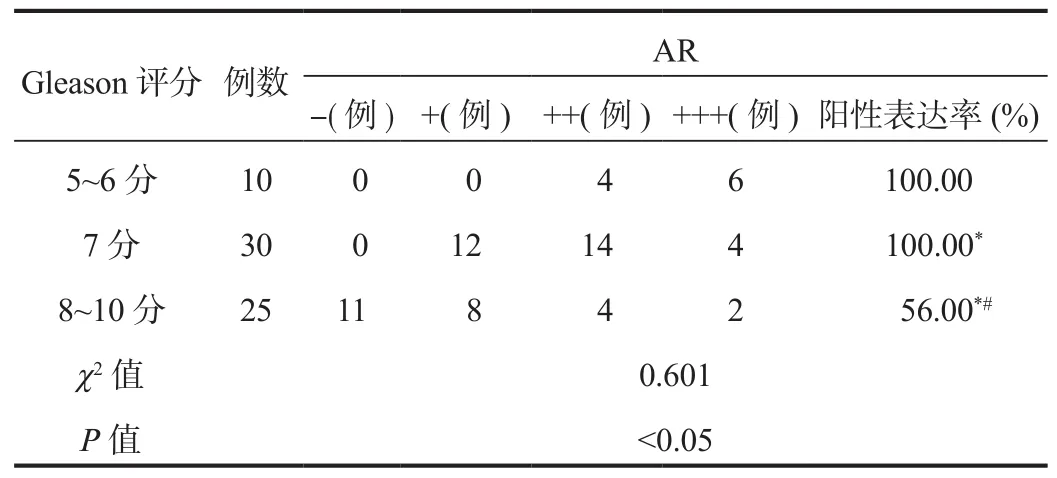
表2 前列腺癌Gleason分级与免疫组化AR的表达结果
2.4 前列腺癌Gleason评分与CgA阳性表达的相关性65例前列腺癌患者病理组织标本经免疫组化染色显示,CgA阳性表达率为26.15%(17/65),表达强度以-~+为主,与Gleason评分呈正相关性(r= 0.382),差异有统计学意义(P<0.05),见表 3。
2.5 PSA、AR、CgA蛋白在前列腺癌组织中的阳性表达情况 Gleason评分为8分的患者PSA(+++)标本中可见PSA阳性信号呈棕黄色,定位于腺体上皮细胞胞质,阳性细胞≥ 51%,见图1‐A。Gleason评分为8分的患者AR(+++)标本中可见AR阳性信号呈棕黄色,定位于腺体上皮细胞胞核,阳性细胞≥ 51%,见图1‐B。Gleason评分为10分的患者CgA(++)阳性信号呈棕黄色,定位于腺体上皮细胞胞质,阳性细胞11% ~ 50%,见图1‐C。
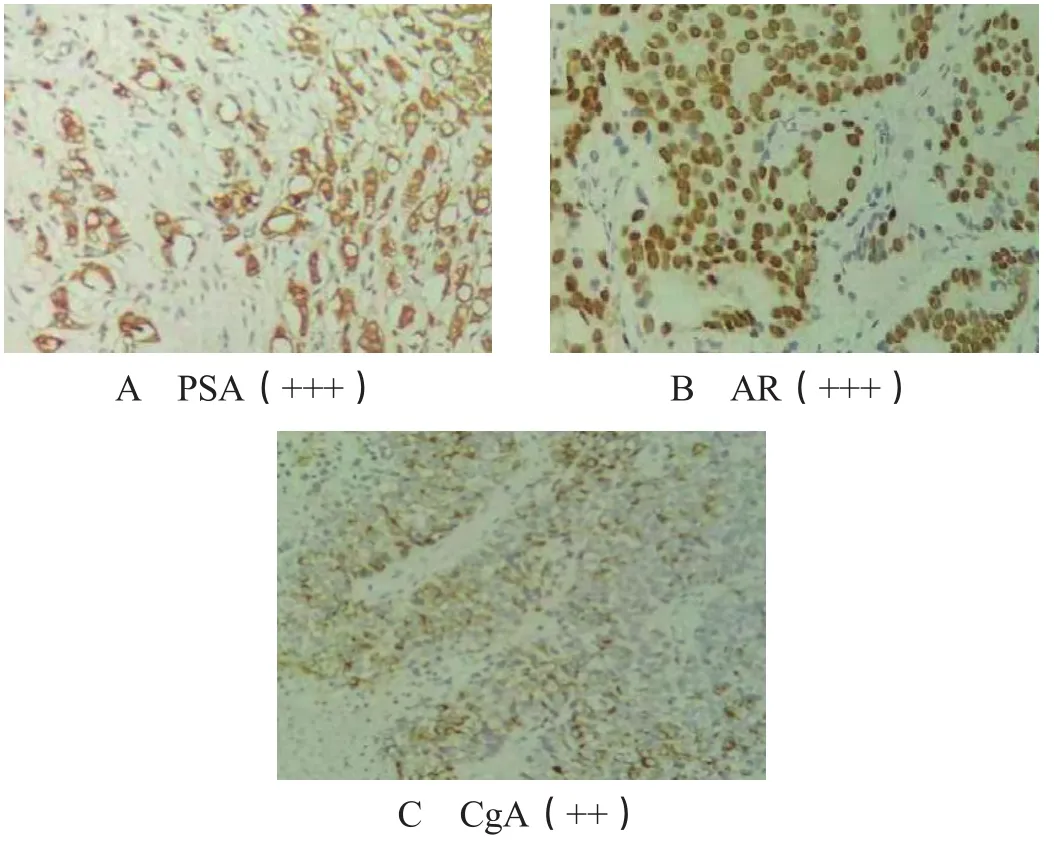
图1 Gleason评分为8~10分的前列腺癌患者病理组织PSA、AR、CgA免疫组化染色(×200)
3 讨论
前列腺癌是发生于前列腺上皮的恶性肿瘤,好发于前列腺外周带,其病灶侵袭性有较大的差异,中高危险性前列腺癌侵袭性较大,病情可在短期内迅速进展,需及时进行内分泌或手术等有效治疗措施;而低危前列腺癌侵袭性相对较小,对于高龄或生命时间较短的患者而言,可能只需进行常规随访、检测即可[8]。前列腺癌的Gleason评分是目前前列腺癌最有效的预后评估标准,对于未接受放化疗、前列腺根治术或其他物理、新辅助治疗的患者而言,其可以预测手术后局部复发以及淋巴结远处转移的发生率[9]。
前列腺组织的腺体上皮由分泌细胞、基底细胞、少量的神经内分泌细胞及干细胞等组成。PSA由成熟的前列腺腺上皮中已分化的上皮细胞产生,是前列腺分泌细胞在雄性激素刺激下分泌的一种酶,通常定位于前列腺腺泡和导管,具有组织特异性。正常生理情况下,富含PSA的前列腺腺泡内容物与淋巴系统之间存在由内皮层、基底细胞层和基底膜构成的屏障相隔,但当患前列腺癌时,肿瘤细胞异常增殖,使得屏障受到破坏,PSA渗透到血液中,引起血液中PSA升高,而组织中原位PSA含量降低,因而高水平血清PSA往往提示前列腺癌,且Gleason评分越高,危险度越大[10]。本研究结果显示,在Gleason评分为5~6分时,PSA阳性表达率为100.00%,均为(++) ~ (+++)表达;Gleason评分为7分时,PSA阳性表达率为100.00%,其中18 例(++) ~ (+++)表达;Gleason 评分为 8~10 分时,PSA阳性表达率60.00%,其中5例表达(++)~(+++),提示PSA阳性表达率及阳性表达强度随着Gleason评分的升高而减弱,两者呈负相关。杨明涛等[11]研究PSA在前列腺癌组织不同分级和分期的表达中发现,PSA表达与前列腺癌的病理分级有一定相关性,低分化组的表达比高分化组和中分化组均低;但也有研究认为,PSA表达与Gleason评分无明显相关性[12]。本研究认为,在Gleason评分5~6、7分时,分化良好的腺体增多,癌细胞分泌PSA能力强,随着前列腺癌病理分级的升高,肿瘤组织结构中分化良好腺体减少,则癌细胞分泌PSA的能力下降,PSA表达阳性率及强度与Gleason评分呈负相关。
前列腺腺癌来源于泌尿生殖道上皮,属于雄激素依赖性疾病,雄激素生物学活性是由细胞内受体(核受体)介导的,无论睾酮还是双氧睾酮均以AR为有效配基而发挥作用,AR在前列腺上皮细胞及间质细胞中均有表达[13]。AR属于甾体激素核受体,是一种雄激素依赖性转录因子,可调节基因使细胞增殖和分化,其在前列腺癌的发生、发展中起重要作用,是雄激素代谢和发挥作用过程的中心环节之一[14]。本研究结果显示,在Gleason评分为5~6分时,AR阳性表达率为100.00%,均为(++) ~ (+++)表达;Gleason评分7分时,AR阳性表达率为100.00%,其中18例强阳性表达(++) ~ (+++);Gleason 评分 8~10 分时,AR阳性表达率56.00%,其中6例表达(++) ~ (+++),表明AR阳性表达率及阳性表达强度随着Gleason评分升高而减弱,两者呈负相关。分析其原因为,在早期阶段,几乎所有的前列腺腺癌上皮细胞都存在AR表达,而当发展到晚期时,前列腺癌细胞自身可合成AR激动剂或雄激素来进一步促进肿瘤生长,从而失去了对AR的表达,因此,随着Gleason评分增高分化程度降低,AR阳性率下降,这可能与功能性的雄激素受体丢失有关[15]。国内有学者研究AR在前列腺癌不同分级分组组织中的表达发现,AR在高分化前列腺癌中高表达[16],与本研究结果类似。
CgA是正常神经内分泌细胞和肿瘤细胞分泌的一种酸性糖蛋白颗粒,正常前列腺组中神经内分泌细胞较少,但在雄激素缺乏的环境诱导下可促进癌细胞转化为具有神经分泌功能样功能的癌细胞。近年来,前列腺癌的神经内分泌转化机制受到关注,前列腺癌的神经内分泌转化可表现为未治疗的原发现象或治疗后的去势抵抗性前列腺癌[17]。本研究结果显示,在Gleason评分5~6分时,CgA无阳性表达;Gleason评分7分时,CgA阳性表达率16.70%;Gleason评分8~10分时,CgA阳性表达率为48.00%,表明CgA阳性表达率及阳性表达强度随着Gleason评分升高而增强,两者呈正相关。有学者在前列腺癌穿刺标本及术后随访病例中发现,CgA表达水平随着Gleason评分及临床分期升高而逐渐升高[18]。因此CgA可应用于前列腺癌的诊断,可作为前列腺癌治疗预后的判断指标,随着前列腺临床分级和分期增高,CgA阳性表达率明显提高,前列腺癌的分化程度越低越易出现神经内分泌分化。未来随着人们对神经内分泌分化机制和起源的深入研究,明确可以预防或逆转神经内分泌分化的信号通路,将为提高前列腺癌患者的生存率和生活质量提供广泛的前景。
综上,PSA、AR表达阳性率及强度随着Gleason评分的升高而减弱,呈负相关,而CgA表达阳性率及强度随着Gleason评分升高而增强,呈正相关,PSA、AR、CgA可用于前列腺癌的诊断和预后预测,值得临床进一步研究。
