肝动脉化疗栓塞术联合FOLFOX方案持续动脉灌注化疗在肝细胞癌患者中的应用效果
2022-05-03柯映平叶绍光
柯映平,叶绍光
(潮州市中心医院普外科,广东 潮州 521011)
肝细胞癌是肝癌的主要组织学亚型,其发病原因主要与遗传、表观遗传改变及乙型肝炎、丙型肝炎病毒感染等有关,常见的临床症状表现为肝区疼痛、肝大、黄疸等,严重者可出现恶病质状态。目前,肝动脉化疗栓塞术(TACE)是原发性肝癌的常用治疗方法,其可使肿瘤病灶化疗药物浓度增加,且携带化疗药物的碘油可持续杀灭瘤体细胞,但采用该方法治疗仍不可避免地导致患者肝损伤[1]。因此,如何在保护肝组织的前提下实现对病灶的栓塞,从而将创伤降至最低并最大程度保护肝脏功能已成为临床研究重点。奥沙利铂+亚叶酸钙+5‐氟尿嘧啶化疗(FOLFOX)方案中,5‐氟尿嘧啶是该化疗方案的主要药物,其可有效抑制胸腺嘧啶核苷酸合成酶,从而抑制肿瘤DNA的合成;奥沙利铂进入机体后,会促进烷化结合物生成,对肿瘤细胞DNA复制有显著的抑制效果[2]。基于此,本研究旨在探讨TACE联合FOLFOX方案持续动脉灌注化疗对肝细胞癌患者肝功能、血常规及肿瘤标志物水平的影响,现将研究作如下报道。
1 资料与方法
1.1 一般资料 按随机数字表法将潮州市中心医院2018年4月至2021年4月收治的肝细胞癌患者分为对照组(35例,采用TACE治疗)和观察组(35例,采用TACE联合FOLFOX方案持续动脉灌注化疗)。对照组中男、女患者分别为21、14例;年龄20~76岁,平均(51.34±5.67)岁;肿瘤直径:<5 cm 8例,5~10 cm 16例,>10 cm 11例;肿瘤分期[3]:Ⅰ期5例,Ⅱ期8例,Ⅲ期12例,Ⅳ期10例。观察组中男、女患者分别为20、15例;年龄21~75岁,平均(51.47±5.83)岁;肿瘤直径:<5 cm 9例,5~10 cm 14例,>10 cm 12例;肿瘤分期:Ⅰ期6例,Ⅱ期7例,Ⅲ期13例,Ⅳ期9例。对比两组患者一般资料,差异无统计学意义(P>0.05),可实施组间对比。纳入标准:符合《原发性肝癌诊疗规范(2017年版)》[4]中的相关诊断标准者;入组前半年内未行外科相关治疗者;无化疗禁忌证者等。排除标准:患有自身血液系统或免疫系统疾病者;合并其他恶性肿瘤者;肺、肾等重要脏器功能不全者;患严重心脑血管疾病者等。本研究经潮州市中心医院医学伦理委员会审核批准,患者及家属均签署知情同意书。
1.2 治疗方法 对照组患者行TACE治疗:局麻下股动脉穿刺,置入导管行肝动脉造影,明确肿瘤部位、大小、数目及血供情况,经导管注入碘化油注射液(上海旭东海普药业有限公司,国药准字H31021603,规格:10 mL/支)(依肿瘤大小选择剂量) + 注射用奥沙利铂(连云港杰瑞药业有限公司,国药准字H20103049,规格:50 mg/支)50 mg + 注射用盐酸表柔比星[辉瑞制药(无锡)有限公司,国药准字H20000496,规格:10 mg/支]30 mg配置成的液体缓慢注入靶血管。当出现血管内注入药物流速缓慢,或肿瘤周围正常肝组织存在弥散药物时需暂停灌注,依术中所见情况决定是否使用栓塞微球。后穿刺点加压包扎、右下肢制动。予以观察组患者TACE联合FOLFOX持续动脉灌注化疗,TACE操作同对照组,术中不进行化疗药物的灌注,保留动脉导管在靶动脉内,之后行FOLFOX方案持续动脉灌注化疗,第1天:给予注射用奥沙利铂(连云港杰瑞药业有限公司,国药准字H20103049,规格:50 mg/支)100 mg /m2,时间2 h,亚叶酸钙氯化钠注射液(青海夏都医药有限公司,国药准字H20041411,规格:100 mL∶亚叶酸钙0.2 g与氯化钠0.9 g)200 mg/m2,时间2 h,氟尿嘧啶氯化钠注射液(西安海欣制药有限公司,国药准字H20031272,规格:100 mL∶氟尿嘧啶0.25 g与氯化钠0.9 g)400 mg/m2,时间15 min;第2天:给予亚叶酸钙200 mg/m2,时间2 h,氟尿嘧啶200 mg/m2,时间15 min,氟尿嘧啶600 mg/m2,时间22 h。两组患者均每4周重复1次,连续治疗4次。
1.3 观察指标 ①分别于治疗前、治疗4次后采集两组患者空腹静脉血3 mL,进行离心操作(3 500 r/min,10 min),取血清,采用全自动生化分析仪检测两组患者血清肝功能指标,包括丙氨酸氨基转移酶(ALT)、总胆红素(TBiL)、白蛋白(ALB)水平。②采集两组患者静脉血3 mL,采血方法同①,采用全自动血液分析仪对两组患者治疗前、治疗4次后血常规指标水平进行检测,包括白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)。③采集两组患者静脉血3 mL,采血与血清分离方法同①,采用酶联免疫吸附实验法检测血清甲胎蛋白(AFP)水平,酶速率法检测α‐L‐岩藻糖苷酶(AFU)水平,采用免疫放射法检测血清糖类抗原19‐9(CA19‐9)水平。④对两组患者包括恶心、呕吐、疼痛、发热等情况进行对比。
1.4 统计学方法 应用SPSS 21.0统计软件处理数据,肝功能、血常规指标及肿瘤标志物水平为计量资料,以(±s)表示,采用t检验;并发症发生情况为计数资料,以[例(%)]表示,采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 肝功能指标 治疗4次后两组患者血清ALT、TBiL水平高于治疗前,但观察组低于对照组,差异均有统计学意义(均P<0.05),两组内、组间血清ALB水平比较,差异均无统计学意义(均P>0.05),见表1。
表1 两组患者肝功能指标比较(±s)
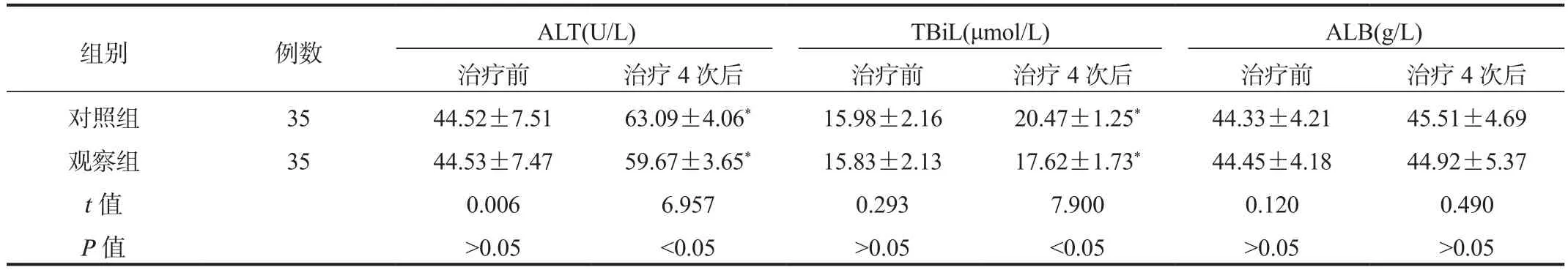
表1 两组患者肝功能指标比较(±s)
注:与治疗前比,*P<0.05。ALT:丙氨酸氨基转移酶;TBiL:总胆红素;ALB:白蛋白。
组别 例数 ALT(U/L) TBiL(μmol/L) ALB(g/L)治疗前 治疗4次后 治疗前 治疗4次后 治疗前 治疗4次后对照组 35 44.52±7.51 63.09±4.06* 15.98±2.16 20.47±1.25* 44.33±4.21 45.51±4.69观察组 35 44.53±7.47 59.67±3.65* 15.83±2.13 17.62±1.73* 44.45±4.18 44.92±5.37 t值 0.006 6.957 0.293 7.900 0.120 0.490 P值 >0.05 <0.05 >0.05 <0.05 >0.05 >0.05
2.2 血常规指标 治疗4次后两组患者WBC、RBC、PLT水平低于治疗前,但观察组高于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者血常规指标比较(±s)

表2 两组患者血常规指标比较(±s)
注:与治疗前比,*P<0.05。WBC:白细胞计数;RBC:红细胞计数;PLT:血小板计数。
组别 例数 WBC(×109/L) RBC(×1012/L) PLT(×109/L)治疗前 治疗4次后 治疗前 治疗4次后 治疗前 治疗4次后对照组 35 5.70±1.65 3.45±1.03* 4.20±0.60 3.54±0.48* 227.62±20.07 189.65±18.95*观察组 35 5.68±1.67 4.87±1.32* 4.15±0.62 3.89±0.39* 223.96±18.21 214.36±17.61*t值 0.050 5.018 0.343 3.348 0.799 5.651 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 肿瘤标志物水平 治疗4次后两组患者血清AFP、AFU、CA19‐9水平低于治疗前,且观察组低于对照组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者肿瘤标志物水平比较(±s)

表3 两组患者肿瘤标志物水平比较(±s)
注:与治疗前比,*P<0.05。AFP:甲胎蛋白;AFU:α‐L‐岩藻糖苷酶;CA19‐9:糖类抗原 19‐9。
组别 例数 AFP(μg/L) AFU(U/L) CA19‐9(U/mL)治疗前 治疗4周后 治疗前 治疗4周后 治疗前 治疗4周后对照组 35 430.26±100.13 319.68±30.58* 433.65±15.74 265.42±13.34* 83.77±12.40 52.85±11.09*观察组 35 430.31±100.02 221.85±21.59* 433.72±15.69 152.27±11.96* 83.82±12.36 29.63±9.84*t值 0.002 15.461 0.019 37.363 0.017 9.265 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 不良反应 治疗期间,对照组患者出现恶心2例、呕吐1例、疼痛2例、发热3例;观察组患者出现恶心1例、呕吐1例、疼痛1例、发热2例。观察组患者不良反应总发生率14.29%(5/35)低于对照组的22.86%(8/35),但经比较,差异无统计学意义(χ2= 0.850,P>0.05)。
3 讨论
肝细胞癌属于原发性肝癌中的一种,其发病机制可能与肝硬化、酒精性肝病等有关,具有发病率、致死率高等特点。传统TACE在治疗肝细胞癌时多采用阿霉素、铂类化疗药物,其可有效阻断或减少肿瘤供血,但肝癌对这类化疗药物的敏感性不高,临床疗效并不理想[5]。
FOLFOX方案主要包含氟尿嘧啶、奥沙利铂、亚叶酸钙3种药物,其中5‐氟尿嘧啶属于抗代谢药物,进入细胞内可转化为氟尿嘧啶脱氧核苷酸,从而使脱氧核糖尿苷酸受细胞内胸苷酸合成转化为胸苷酸被阻断,进而使DNA及核糖核酸(RNA)的合成被干扰;奥沙利铂为第三代铂类抗癌药物,以DNA为靶作用部位,铂原子与DNA形成交叉联结,拮抗其复制和转录,与5‐氟尿嘧啶联合应用具有协同作用,且与顺铂之间无交叉耐药性;亚叶酸钙可使氟尿嘧啶脱氧核苷酸与胸苷酸合成酶共价形成三元复合物,使 5‐氟尿嘧啶的抗癌作用增强[6‐7]。TACE 联合 FOLFOX方案持续动脉灌注化疗可有效抑制和杀伤微小子灶、隐匿病灶及栓塞不彻底的较大病灶,且使经动脉灌注化疗药物的作用时间延长,还可减少药物浓度过高而引起肝、肾等功能的损伤[8]。本研究结果显示,治疗4次后,两组患者ALT、TBiL水平均显著升高,而观察组患者ALT、TBiL水平均显著低于对照组,提示肝动脉栓塞联合FOLFOX方案持续动脉灌注化疗对肝细胞癌患者的肝功能影响相对较小。
由于化疗药物具有细胞毒性,主要通过血液循环吸收,之后经肝脏代谢、活化、灭活以及排泄,但是其可影响DNA的合成与修复,因此同时对骨髓造血细胞、胃肠道黏膜上皮细胞等有着较强的杀伤作用[9]。本研究中,治疗4次后两组患者WBC、RBC、PLT水平均显著下降,而观察组患者上述指标水平均显著高于对照组,表明TACE联合FOLFOX方案持续动脉灌注化疗应用于肝细胞患者中,可减少对患者血常规指标的影响。邓兰等[10]研究显示,FOLFOX方案持续动脉灌注化疗可使肝细胞癌患者因化疗引发的WBC降低情况得以缓解,减轻化疗对造血功能产生的抑制状况,使造血功能恢复,患者对该方案耐受性较好,与本研究结果基本相符。
AFP、AFU是肝癌特异性肿瘤标志物,可作为检测原发性肝癌的灵敏性指标;CA19‐9属于机体内的一类糖蛋白,其水平升高可引起肝细胞的坏死,持续发展可进展为肝癌[11]。采用FOLFOX方案持续动脉灌注化疗能使体内肿瘤缺血性坏死,使肝癌细胞的生成被抑制,从而减轻肝细胞受损程度,促进血清AFP、AFU、CA19‐9水平的下降[12]。本研究中,治疗4次后,观察组患者血清AFP、AFU、CA19‐9水平与对照组比均显著下降;观察组患者不良反应总发生率与对照组比下降,但组间比较,差异无统计学意义,提示肝动脉栓塞联合FOLFOX方案持续动脉灌注化疗可有效杀灭肝细胞癌患者体内的癌细胞,且不增加不良反应的发生,安全性良好。
综上,TACE联合FOLFOX方案持续动脉灌注化疗对肝细胞癌患者的肝功能指标与血常规指标的影响较小,还可有效杀灭肝细胞癌患者体内的癌细胞,且安全性良好,具有较高的临床应用价值。
