基于转录组测序分析澳洲坚果脂肪酸的合成
2022-05-02刘紫艳牛迎凤毛常丽
刘紫艳,郑 诚,牛迎凤,毛常丽,柳 觐
(云南省热带作物科学研究所,云南景洪 666100)
澳洲坚果(Macadamia ternifoliaF.Muell)源自澳大利亚,因其商业化栽培始于美国夏威夷,故又称夏威夷果。澳洲坚果果仁香酥、滑嫩、可口,吃上去有一股独特的奶油香味,因此备受消费者青睐。而且,澳洲坚果营养丰富,富含脂肪酸,多种微量元素、维生素[1]及矿物质(锰、铁、镁)等,与杏仁等其他可使用坚果相比,澳洲坚果含有大量的脂肪酸(约75%),尤其是不饱和脂肪酸占其总脂肪酸含量的59%,长期食用对降低心脑血管疾病的发病率有显著作用[2]。目前澳洲坚果在云南省的种植面积超过26万hm2,占全国种植面积的90%以上,已成为云南重要的经济林[3]。
澳洲坚果果仁中含15种脂肪酸成分,如豆蔻酸、棕榈酸、棕榈油酸、亚麻酸、亚油酸等,这些脂肪酸中含量较大的有油酸、亚油酸、棕榈油酸等,都是不饱和脂肪酸[4],这些脂肪酸在澳洲坚果果仁中通过脂肪酸生物合成途径合成并积累。澳洲坚果是云南重要的经济作物,过去的研究主要集中在栽培和育种,与澳洲坚果果仁油脂合成相关的分子机制研究较少。因此,对参与澳洲坚果脂肪酸生物合成途径的基因调控机制研究有助于更好地阐述澳洲坚果果仁中油脂合成的分子机制,从而为通过分子育种定向选择富含优质油脂的澳洲坚果以更适应澳洲坚果的市场需求奠定理论基础。
在研究中发现,尽管国外已经有澳洲坚果基因组数据发表,但是并未将数据完全释放,为此,本研究采用RNA-seq这一可以进行无参分析的方法对不同发育时期澳洲坚果果仁进行比较研究,用以揭示澳洲坚果果仁的脂肪酸合成途径及其基因的表达变化规律,以期为植物油脂合成机制研究的揭示提供理论参考,并能进一步为澳洲坚果遗传育种提供改良的方向。
1 材料和方法
1.1 材料
实验材料HAES246、HAES294、HAES816来自云南省热带作物科学研究所澳洲坚果种质圃。2020年5—9月,选择花期一致的花序挂牌,于授粉后第62 d开始采样,间隔15 d。每个种质5棵树,每次每棵树随机采2个挂牌的果做混样,贮存于-80℃备用。
将采摘的7个发育阶段的澳洲坚果果仁分别进行标记:授粉后第62 d标记为Ⅰ期,授粉后第94 d标记为Ⅱ期,授粉后第109 d标记为Ⅲ期,授粉后第124 d标记为Ⅳ期,授粉后第139 d标记为Ⅴ期,授粉后第154 d标记为Ⅵ期,授粉后第172 d标记为Ⅶ期。
1.2 方法
1.2.1 总RNA提取与测序文库建立
提取7个不同发育阶段的澳洲坚果果仁的总RNA,用Aglient2100生物分析仪进行检测,以保证RNA质量。进行文库构建,随后用AMPure XP beads纯化双链cDNA。纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择,最后进行PCR富集得到最终的cDNA文库。对文库进行质检,检测结果达到要求后,用Illumina HiSeq平台进行测序。
1.2.2 数据分析
原始测序数据经过滤、测序错误率检查、GC含量分布检查,获得后续分析使用的clean reads。采用Trinity对cleanreads进行拼接,经过Trinity拼接得到的转录本序列作为后续分析的参考序列。以Corset层次聚类后得到最长Cluster序列作为Unigene进行后续的分析。使用BLAST软件将Unigene序列与KEGG(Kyoto Encyclopedia of Genes and Genomes)、NR(NCBI non-redundant)、Swiss-Prot(Swiss-Protein)、GO(Gene Ontology)、KOG(euKaryotic Orthologous Groups)、Trembl数据库比对,预测完Unigene的氨基酸序列之后使用HMMER软件与Pfam(Protein family)数据库比对,获得Unigene的注释信息。利用DESeq2进行差异表达基因的分析,差异基因的筛选条件为∏log2Fold Change∏>=1,且FDR<0.05。进一步对差异表达基因的通路进行注释分析,为进一步解读基因的功能打下基础。
2 实验结果
2.1 测序数据统计
Ⅰ~Ⅶ期的澳洲坚果果仁的RNA在RNA-seq中共拼接得到289 889条转录本,通过组装得到218 976条Unigene序列,两者长度主要分布在200~3 000 nt,大于2 000 nt的转录本有29 237条,Unigene序列有2 936条,占总序列的10.09%。随着序列长度增加,Unigene的数量呈现逐级递减的趋势,没有明显间断,说明RNA-Seq的质量很好(图1)。Unigene序列通过GO富集之后,分为三大类,即分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process),其中催化活动(catalytic activity)、运输活动(transporter activity)都表现出很高的富集,这说明澳洲坚果果仁在发育过程中有多种酶参与活动,且发生多个跨膜运动(图2),推测是果仁中的油脂合成过程是在多个不同的细胞器中进行并发生转运而导致的。本研究中的富集性分析将86 587条Unigene归于406个代谢途径(pathway),约占总Unigene的43.86%,而我们重点关注的脂肪酸的生物合成(fatty acid biosynthesis)途径共富集到437条Unigene,另外两条脂肪酸的延长(fatty acid elongation)途径和脂肪酸的降解(fatty acid degradation)途径分别富集到125条Unigene和501条Unigene。
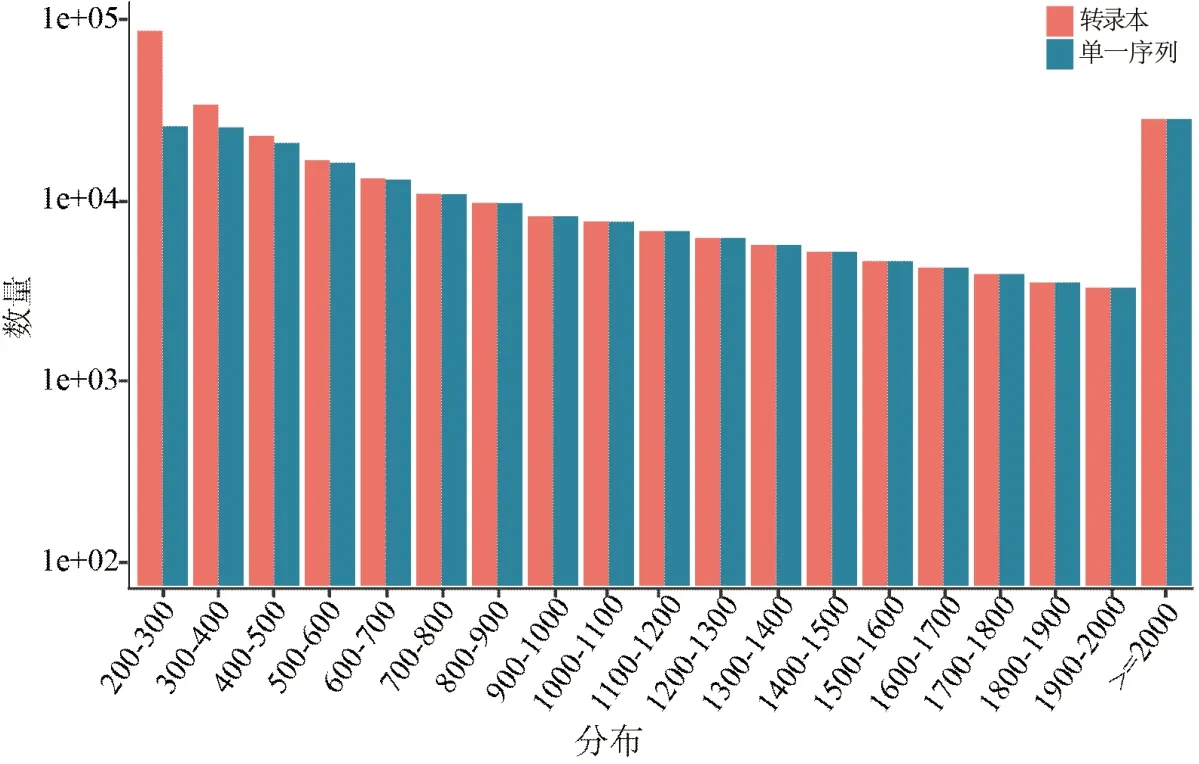
图1 Unigene序列的程度分布
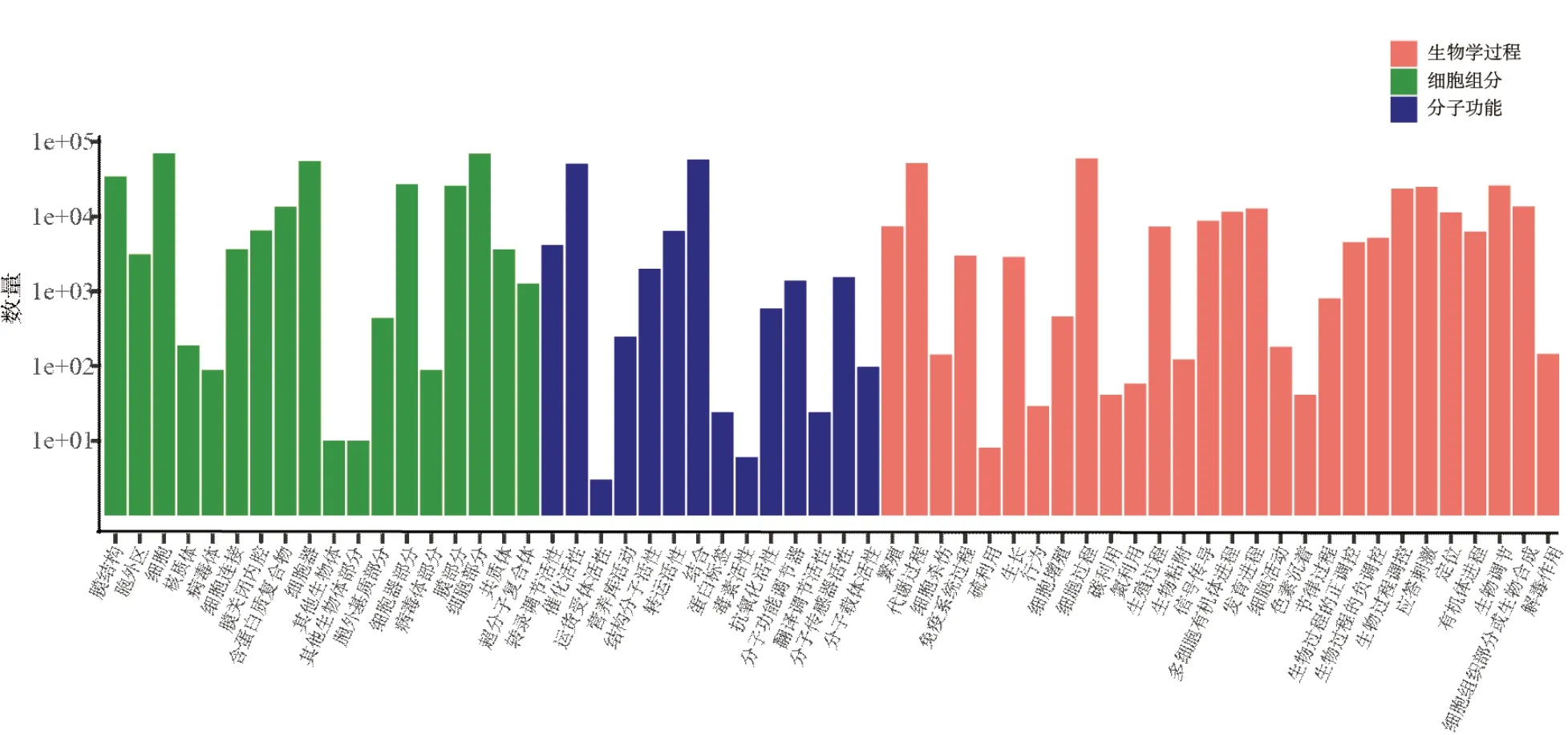
图2 Unigene的GO分类
此外,将Unigene序列通过与NR、Swissport、Trembl、KOG和Pfam数据库进行比对,分别注释到119 737、81 176、119 448、71 423、84 683条序列,分别约占总Unigene的60.65%、41.12%、60.51%、36.18%、42.9%。在注释过程中,经过NR数据库比对,可以发现澳洲坚果转录本序列与莲科(Nelumbonucifera)植物较为相近,相似度达39.56%,其次是博落回(Macleayacordata),相似度为10.74%(图3)。经过KOG数据库进行富集后,将所有Unigene序列分为25类同源蛋白簇,一般功能预测(General function prediction only)富集到18 636个Unigene,翻译后的修饰、蛋白周转、分子伴侣(Posttranslational modification,protein turnover,chaperones)富集到7 503个Unigene,信号转导机制(Signal transduction mechanisms)富集到6 890个Unigene,这 三个簇是Unigene富集最多的,细胞运动(Cell motility)富集到43个,是Unigene富集最少的(图4)。
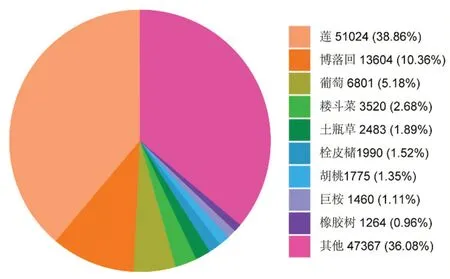
图3 Unigene的NR分类
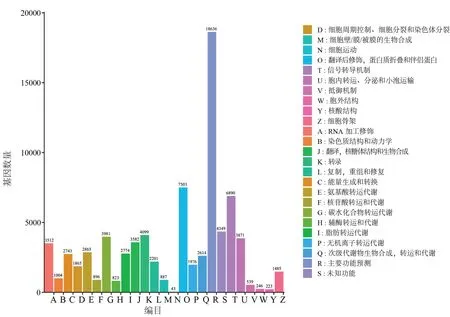
图4 Unigene的KOG分类
从RNA-Seq结果中可以看出,在澳洲坚果果仁发育过程中,有很多Unigene基因表达呈现上调或下调(表1),表 明 果 实 发育过程中有很多基因及其产物参与到脂肪酸的合成和积累中。
2.2 果仁中脂肪酸合成途径基因表达变化
对7个发育阶段的转录组数据进行分析,发现富集到脂肪酸生物合成(fatty acid biosynthesis)途径的Unigene共437条,占总Unigene的0.5%。将437条Unigene序列在KEGG数据库中比对后找到17个同源脂肪酸合成相关蛋白。生物机体中脂肪酸的合成都是通过脂肪酸合成途径来完成的,对脂肪酸合成途径中相关基因的研究有助于人们深入认识这一合成途径的运行机制。
将7个发育阶段分别进行两两比较,对每组两两比较获得的差异表达Unigene分别进行富集性分析,结果显示,每组差异表达的Unigene中都有一些在KEGG数据库(https://www.kegg.jp/)中可以富集到脂肪酸生物合成途径中(代谢图登录号为ko00061),并找到同源蛋白。这些Unigene的变化在果仁油脂合成中起着重要作用,可能引起澳洲坚果在不同发育阶段中不同类型脂肪酸的合成和积累,其基本信息见表1。本文重点挑选9个澳洲坚果果仁脂肪酸生物合成途径中的关键酶的功能作用进行介绍,并观察它们在7个不同发育时期的表达变化规律。

表1 澳洲坚果果仁7个不同发育时期差异基因
(1)乙酰辅酶A羧化酶(Acetyl CoA carboxylase)
在植物的脂肪酸生物合成过程的起始反应中,催化乙酰辅酶A生成丙二酰辅酶A[5]。乙酰辅酶A羧化酶是一个多酶复合体,由乙酰辅酶A羧化酶生物素羧基载体蛋白(Acetyl-CoAcarboxylase biotin carboxyl carrier protein,accB)、乙酰辅酶A羧化酶生物素羧化酶(Acetyl-CoAcarboxylase biotin carboxylase,accC)和乙酰辅酶A羧化酶羧基转移酶(Acetyl-CoAcarboxylase carboxyl transferase)组成,而羧基转移酶又包含α-亚基(accA)和β-亚基(accD)[6]。其机理是以ATP提供反应活化能,将碳酸氢盐上的羧基转移到生物素羧基载体蛋白的长臂上,继而在羧基转移酶的催化下随机转移到乙酰-CoA上形成丙二酰-CoA[7]。accB基因在Ⅵ期和Ⅶ期与Ⅰ期、Ⅱ期相比,都有所上调,Ⅵ期与Ⅳ期相比,则表达量有所下调。accC、accA、accD基因在两两比对结果中既有上调,也有下调。但上调时期都保持一致,只有下调的时期略有不同,accD在第Ⅲ期与第Ⅶ期相比较,没有上下调的明显变化(表2)。
(2)ACP-S丙二酰转移酶([acyl-carrier-protein]S-malonyltransferase)
该酶催化酰基载体蛋白(ACP)与丙二酰辅酶A中的丙二酰进行转酰化反应,形成丙二酰—ACP[8],从而为后续的缩合反应提供底物。ACPS丙二酰转移酶基因Ⅶ期与前几个时期相比,呈现明显的下调(表2)。
(3)3-酮脂酰-ACP合酶III(3-oxoacyl-[acylcarrier-protein]synthase III)
该酶在脂肪酸合成起始反应阶段中起作用,催化乙酰辅酶A和丙二酰ACP进行缩合,生成3-酮基丁酰ACP,并进入循环反应[9]。3-酮脂酰-ACP合酶III的第Ⅶ期与第Ⅱ期、第Ⅲ期、第Ⅳ期、第Ⅴ期相比,呈现明显的下调(表2)。
(4)3-氧代酰基-ACP合酶II(3-oxoacyl-[acylcarrier-protein]synthase II)
与酮酰基合成酶类似,该酶在肽链上有一个活性位点(半胱氨酸残基),通过硫脂键与延长的酰基链连接[10]。随着澳洲坚果的发育,发育前期与后期相比,3-氧酰基-ACP合酶基因也呈现下调(表2)。
(5)3-氧代酰基-ACP还原酶(3-oxoacyl-[acylcarrier-protein]reductase)
该酶主要参与多不饱和脂肪酸的生物合成过程,是一种以NAD+或NADP+为受体、作用于供体CH-OH基团上的氧化还原酶,即在NAD+或NADP+参与下,催化底物生成β-羟酰基-ACP(βhydroxyacyl-ACP)[11]。3-氧酰基-ACP还原酶基因在整个发育阶段,既有上调,也有下调(表2)。
(6)3-羟酰基-ACP脱水酶(3-hydroxyacyl-[acyl-carrier-protein]dehydratase)
该酶能催化羟酰-ACP脱掉一个水分子,生成丁烯酰-ACP[12],与第Ⅱ期相比。该基因在Ⅶ期既有所上升,也有所下降,第Ⅶ期与第Ⅰ期、第Ⅱ期、第Ⅲ期、第Ⅳ期、第Ⅴ期相比都有所上升(表2)。
(7)烯脂酰-ACP还原酶I(enoyl-[acyl-carrier protein]reductase I)
在植物脂肪酸合成途径中,该酶催化脂肪酸合成第一个循环的最后一步,通过NADH减少连接酰基载体蛋白的脂肪酸酰基链C2和C3之间的反式双键参与脂肪酸的生物合成[13,14],即催化反-2-烯脂酰ACP还原为脂酰ACP。与前5个时期相比,第Ⅵ期和第Ⅶ期都呈现明显的下调(表2)。
(8)长链酰基CoA合酶(long-chain acyl-CoA synthetase)
该酶是酰基激活酶家族成员之一,分为5种不同的亚型,由不同的基因编码。主要催化12~20碳链的脂肪酸合成脂酰辅酶A。这也是机体体内甘油三酯合成及脂肪酸β氧化的第一步反应[15]。该酶在不同阶段都表现出既有上升又有下降的趋势,也是因为多个基因编码该酶,因此在结果中能看到既有上升也有下降(表2)。

表2 澳洲坚果果仁脂肪酸生物合成途径关键酶基因在不同阶段的表达模式
(9)脂酰基-ACP硫脂酶(fatty acyl-ACP thioesterase)
该酶在决定植物细胞中合成的游离脂肪酸的种类和链长起着重要的作用。常分为两类不同但又相关的酶,即FATA和FATB[16]。大部分FATA由核基因编码,具有很高的C18∶1-ACP活性和相对较低的C18∶0-ACP活性,因此,FATA可能决定这植物体内的C18∶1输出到质体外的水平[15]。FATB倾向于生成百合的acyl-ACP脂酰碳链,虽然其也参与非饱和acyl-ACP脂肪酸的生物合成。在大多数的植物中,FATB催化C16∶0的生成[17-18]。
3 讨论
到目前为止,澳洲坚果果仁脂肪酸的分子生物学研究基础仍然很薄弱,能够对其研究进行参考的相关山龙眼科作物的脂肪酸背景研究较少,这严重制约着澳洲坚果生物学性状的分子机制研究。在本次研究中,利用澳洲坚果在不同发育阶段的果仁为材料进行转录组测序,将差异表达的基因进行GO分类和代谢途径等分类,初步明确了各个基因编码的蛋白质功能,这为进一步研究澳洲坚果果仁发育的分子机制提供了必要的数据支撑,并为揭示基因表达变化脂肪酸积累之间的关系奠定了研究基础。
澳洲坚果果仁富含的不饱和脂肪酸具有很高的经济价值,研究果仁中油脂的转化和积累的分子机制有助于为澳洲坚果遗传育种提供改良方向,同时对其他油料作物的基础研究也有一定的参考价值。本研究富集得到与脂肪酸合成相关的重要酶类,同时初步分析了它们在果仁发育中的表达变化规律,这对我们后续的研究具有重要的启迪作用。澳洲坚果从Ⅰ~Ⅶ个时期的发育过程中,有4个酶在后期都出现明显下调,分别是:ACP-S丙二酰转移酶、3-酮脂酰-ACP合酶III、3-氧代酰基-ACP合成酶Ⅱ和烯脂酰-ACP还原酶I。脂肪酸合成途径分起始反应和循环反应两个部分,前两个酶在脂肪酸合成的起始反应中起重要作用,后两个在循环反应中起作用。当前两个酶减少,会影响到脂肪酸的后期合成,猜测是因为澳洲坚果发育到后期,临近采摘时已经成熟,果仁中不再继续合成和积累新的脂肪酸,因此,在脂肪酸合成的起始反应阶段就有所减少。在脂肪酸从头合成过程中,烯脂酰-ACP还原酶I第一次发生作用是还原巴豆酰-S-ACP,消耗一个NADPH和一个H+,形成丁酰-S-ACP,此后进入脂肪酸合成的延伸循环,第一轮延伸产生含4个C的丁酰-S-ACP,经过几次重复,与丙二酰-ACP发生缩合反应,每一轮增加2个C原子,从而延伸了酰基-S-ACP的链长。经过7次循环,最终形成C16-S-ACP,该产物可经软脂酰-ACP硫脂酶的催化形成游离的软脂酸。此时,C16脂肪酸作为一方面可以进一步延伸碳链形成C18脂肪酸,另一方面在去饱和酶的作用下,可以形成单不饱和,单不饱和脂肪酸进一步去饱和形成多不饱和脂肪酸。从这个催化过程中可以推测,烯脂酰-ACP还原酶I的存在能影响C16烯酸和C16烷酸的初步形成,在澳洲坚果发育后两个时期该酶有所减少,该酶可能在前5个发育时期起重要作用,能直接影响C16烷酸的形成和积累,后期则因为底物C16烷酸积累到一定量,因而合成速率减缓,从而影响C16烯酸和C18烷酸的形成和积累,进而影响澳洲坚果的果仁品质。这与澳洲坚果后期积累不饱和脂肪酸的趋势是相关的,表明这些基因的表达量与果仁发育过程中脂肪酸合成和积累是有影响的。但是关于这些酶在澳洲坚果果仁脂肪酸合成过程中的表达模式还未探明,鲜有报道,因此,对其在澳洲坚果果仁中的分子机制还有待进一步研究。其他有明显差异的酶既有上调也有下调,则是因为多个基因可以形成该种酶,为此,在分析过程中还要注意多个不同基因的变化,进一步去分析每个基因在不同发育阶段的变化趋势。
本研究通过RNA-Seq揭示了澳洲坚果果仁的脂肪酸合成机制,并分析其基因的表达变化规律,这有望为植物油脂合成机制的解析提供理论参考,丰富油脂合成的研究内容,并为进一步的理论研究和澳洲坚果的遗传改良提供潜在的基因资源。
