硫酸化修饰对红枣多糖结构及抗氧化活性的影响
2022-05-01巩晓佩郭筱兵毛晓英张连富
巩晓佩 张 建 郭筱兵 毛晓英 张连富,2
(1. 石河子大学食品学院,新疆 石河子 832000;2. 江南大学食品学院,江苏 无锡 214122)
红枣(ZiziphusjujubaMill.)又称大枣、枣子、刺枣,为鼠李科枣属植物[1],具有多糖、维生素、黄酮、环核苷酸、多酚、生物碱等活性物质[2-3]。这些生物活性物质具有抗氧化、抗肿瘤、保护肝脏、抗菌等生物活性[4]。中国作为世界上枣主产国,干枣产量占世界产量的98%[5]。新疆南疆地区由于早晚温差大及光照时间长等优势成为中国红枣生产最佳地区。因南疆地区红枣加工产业单一,红枣产量逐年升高的同时也产生了大量残次红枣,造成红枣资源的大量浪费,残次红枣资源的再利用成为人们日益关注的问题。对红枣生物活性物质进行深入研究,可进一步开发利用南疆残次枣资源。

研究拟以残次红枣为研究对象,纯化红枣多糖(ZJP-1)后进行硫酸化修饰后得到红枣多糖硫酸化衍生物S-ZJP-1,通过光谱技术对其组成和结构进行鉴定,并通过体外活性试验探究红枣多糖的体外抗氧化活性,以期为进一步开发利用南疆残次红枣资源提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
残次红枣:新疆石河子农贸市场;
正丁醇、吡啶、三氯甲烷、氯磺酸、刚果红、DPPH、硫酸亚铁、甲酰胺、苯酚:分析纯,天津市富宇精细化工有限公司;
单糖标准品(阿拉伯糖、葡萄糖、半乳糖、鼠李糖、果糖、甘露糖、半乳糖醛酸和葡萄糖醛酸共8种):色谱纯,上海源叶生物科技有限公司;
抗坏血酸、EDTA-2Na:分析纯,上海启仁化工有限公司。
1.1.2 仪器设备
真空冷冻干燥机:HX-10-50B型,上海圣科仪器设备有限公司;
多功能酶标仪:ENK-PRO型,美国Bioteck公司;
400兆超导核磁共振波谱仪:AVANCE Ⅲ HD型,德国Bruker公司;
傅里叶变换红外光谱仪:Nicolet IS 10型,美国Thermo公司;
紫外可见分光光度计:TU-1901型,北京普析通用仪器公司;
扫描电子显微镜:S-3400N型,日本Hitachi公司。
1.2 方法
1.2.1 红枣多糖的提取纯化
(1) 多糖提取:参考Yang等[12]的方法稍作修改。将干燥的红枣粉末用体积分数为95%的乙醇在70 ℃下回流,持续4 h,收集残余物冷冻干燥。将干燥后残余物用沸水萃取,合并上清液,60 ℃减压浓缩至原来的1/4~1/5,脱蛋白(Sevag法),脱色(AB-8大孔树脂),加无水乙醇(V无水乙醇∶V滤液=4∶1)置于冰箱冷藏静置过夜,4 000 r/min 离心15 min,收集沉淀物,经冷冻干燥24 h后得到红枣粗多糖(ZJP)。
(2) 分离纯化:参考杨燕敏等[13]的方法略作修改。将ZJP在蒸馏水中溶解,离心除沉淀,放入DEAE-52离子交换柱中,用蒸馏水和0.2 mol/L NaCl溶液先后进行洗脱。使用自动部分收集器进行收集,用硫酸苯酚法显色,并在490 nm检测吸光度。将红枣多糖溶液通过Sephadex-200葡聚糖凝胶柱进行进一步分离和纯化。冷冻干燥,以获得纯的红枣多糖(ZJP-1)。
1.2.2 硫酸化红枣多糖衍生物的制备 参考Zhang等[14]的方法,分别称取50 mg的ZJP-1、S-ZLP-1,用甲酰胺进行溶解,超声30 min后加入酯化试剂,反应结束后冰水浴冷却,用4 mol/L的NaOH中和至pH为7。4 ℃下透析3 d。透析结束后加3倍体积的无水乙醇,4 ℃静置12 h,收集沉淀,冷冻干燥24 h后得到硫酸化红枣多糖(S-ZJP-1)。
1.2.3 多糖理化性质的测定
(1) 硫酸基含量:采用BaCl2—明胶法[15],标准曲线方程为y=0.398 8x+0.045 8,R2=0.997 6。
(2) 总糖含量:采用苯酚—硫酸法[16],标准曲线方程为y=0.461 5x+0.060 3,R2=0.999 4。
(3) 蛋白质含量:采用考马斯亮蓝法[17],标准曲线方程为y=1.069 4x+0.035 9,R2=0.999 1。
(4) 单糖组成:采用离子色谱法[18]。精密称量10.00 mg 样品置于安瓿瓶中,加入3 mol/L 三氟乙酸(TFA)10 mL,120 ℃水解3 h。准确吸取5 mL酸水解溶液转移至试管中氮吹吹干,加入5 mL水涡旋混匀。吸取100 μL溶液,加入900 μL去离子水,经12 000 r/min离心5 min取上清液分析。色谱柱:DionexCarbopac TMPA20 (3 mm×150 mm);流动相:A为H2O;B为250 mmol/L NaOH;C为50 mmol/L NaOH + 500 mmol/L NaOAc;流速0.3 mL/min;进样量5 μL;柱温30 ℃;检测器为电化学检测器。
1.2.4 红外光谱分析 称取ZJP-1、S-ZLP-1各1 mg,取20 mg溴化钾(KBr)混合并研磨均匀后进行压片,扫描波长范围为4 000~400 cm-1。
1.2.5 高碘酸氧化分析 参考Xue等[19]的方法略作修改,分别称取25 mg ZJP-1、S-ZLP-1与15 mL的50 nmol/L NaIO4溶液混合,测定223 nm处的吸光度值,至终吸光度值不变为止,蒸馏水作为对照组,根据标准曲线y=0.075 1x+0.087 5,R2=0.997 3,按式(1)计算高碘酸的消耗量。取2 mL混合溶液,用0.01 mol/L NaOH溶液滴定,以酚酞为指示剂,根据式(2)计算甲酸生成量。
A=(50-A1)×15,
(1)
A0=(0.01×Ai)×Aj,
(2)
式中:
A——高碘酸消耗量,mmol;
A1——反应后高碘酸浓度,mol/L;
A0——甲酸生成量,mmol;
Ai——NaOH溶液滴定体积,mL;
Aj——反应体积,mL。
1.2.6 刚果红试验 参考徐雅琴等[20]的方法测定ZJP-1、S-ZLP-1多糖组分是否有三螺旋结构。称少量的ZJP-1、S-ZLP-1组分配制成质量浓度为2 mg/mL的溶液,取1 mL浓度为0.0,0.2,0.4,0.6,0.8,1.0 mol/L NaOH溶液分别与1 mL的待测样品混合,然后加入2 mL的80 μmol/mL 刚果红溶液,室温放置10 min,于200~600 nm 范围内扫描最大吸收波长并记录。
1.2.7 扫描电镜分析 ZJP-1、S-ZLP-1的表面形态用SEM观察,放大倍数为100倍和400倍。
1.2.8 多糖的抗氧化性分析
(1) DPPH自由基清除能力:参考Li等[21]的方法稍作修改,准备0.1 mmol/L DPPH溶液并在黑暗中贮存。分别准备0.1,0.2,0.3,0.4,0.5 mg/mL ZJP-1和S-ZJP-1溶液。取2 mL多糖溶液与2 mL 0.1 mmol/L DPPH溶液,混合静置30 min,测量510 nm处吸光度。以VC为阳性对照,根据式(3)计算ZJP-1和S-ZJP-1的DPPH自由基清除率。
(3)
式中:
A——DPPH自由基清除率,%;
A0——不加多糖的吸光度;
A1——加入多糖后的吸光度;
A2——不加DPPH溶液的吸光度。
(2) 还原力:参考Ji等[22]的方法,准备0.2 mol/L磷酸盐缓冲液(pH 6.6),1%铁氰化钾溶液,10%的三氯乙酸溶液和0.1%的三氯化铁溶液,分别准备0.1,0.2,0.3,0.4,0.5 mg/mL ZJP-1和S-ZJP-1溶液,50 ℃水浴30 min 后加入2 mL 10%三氯乙酸溶液,以5 000 r/min离心20 min,加入2.5 mL蒸馏水和1.5 mL 0.1%氯化铁溶液,静置10 min后测量700 nm处吸光度值。以EDTA-2Na为阳性对照,按式(4)计算ZJP-1和S-ZJP-1的还原能力。
(4)
式中:
A——还原力;
A0——不加样品的吸光度;
A1——加入样品后的吸光度;
A2——不加FeCl3溶液的吸光度。
1.3 数据处理
所有试验重复3次,用SPSS软件进行数据统计处理,采用Origin 8.5软件制图。
2 结果与分析
2.1 纯化红枣多糖及硫酸化红枣多糖的理化指标
由表1和表2可知,硫酸化修饰后的红枣多糖取代度为0.45,与ZJP-1相比,S-ZJP-1的总糖和蛋白质含量均下降,其中多糖含量降低可能是硫酸化修饰过程中酸性条件引起了多糖的降解。两种红枣多糖均由3种单糖构成,分别是葡萄糖、阿拉伯糖、半乳糖,不同单糖所占摩尔分数不同。说明不同的硫酸化修饰并未改变红枣多糖的单糖组成,硫酸化会导致硫酸化衍生物的单糖组成的微小变化,不会改变硫酸化多糖主链。伯继芳等[23]也发现硫酸化结构修饰不会破坏杏鲍菇多糖主链。

表1 ZJP-1和S-ZJP-1的单糖物质的量组成Table 1 The quantitative composition of the monosaccharides of ZJP-1 and S-ZJP-1%

表2 ZJP-1和S-ZJP-1的理化指标†Table 2 Physical and chemical indexes of ZJP-1 and S-ZJP-1
2.2 红枣多糖及其硫酸化多糖的结构表征

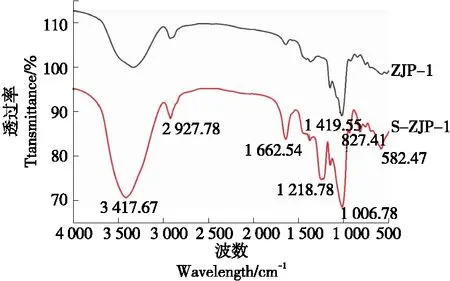
图1 ZJP-1和S-ZJP-1的红外光谱Figure 1 IR spectrum of ZJP-1 and S-ZJP-1
2.2.2 高碘酸氧化分析 高碘酸氧化是一种选择性的氧化反应,一般作用于多糖分子中二羟基和三羟基连接处。可通过高碘酸消耗量和甲酸生成量判断出糖苷键的位置[27]。由图2中NaIO4的标准曲线计算结果得,ZJP-1消耗2.31 mmol的高碘酸并生成0.92 mmol的甲酸,S-ZJP-1消耗2.14 mmol的高碘酸并生成0.81 mmol的甲酸。高碘酸的消耗量大于甲酸生成量的2倍,推测存在只消耗高碘酸而不产生甲酸的类型,即存在(1→2)和(1→4)连接的糖苷键。既消耗高碘酸又生成甲酸说明ZJP-1和S-ZJP-1均存在(1→6)连接的糖苷键。其中也可能存在不消耗高碘酸且不生成甲酸的类型,存在少量(1→3)连接的糖苷键。综上,通过高碘酸氧化的反应原理初步推断多糖ZJP-1和S-ZJP-1中均存在(1→2)(1→4)(1→6)和少量(1→3)连接的糖苷键。
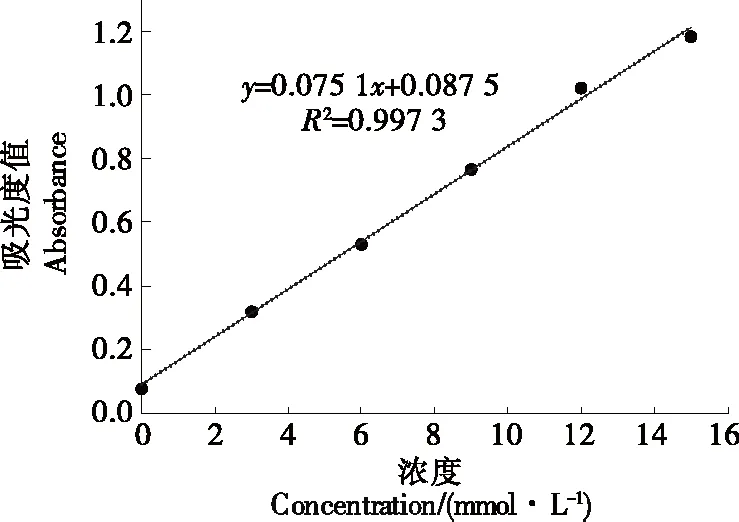
图2 ZJP-1和S-ZJP-1的高碘酸钠标准曲线Figure 2 NaIO4 standard curve of ZJP-1 and S-ZJP-1
2.2.3 刚果红试验 在碱性溶液中,含有三股螺旋结构的多糖会与刚果红形成复合物,其最大吸收波长会产生红移;由此判断多糖是否具有三股螺旋结构[24]。由图3可以看出,NaOH溶液浓度从0.0~0.5 mol/L,两种红枣多糖ZJP-1和S-ZJP-1与刚果红反应,其最大吸收波长均随NaOH溶液浓度的增加而逐渐减小,可以判断这两种红枣多糖不具备三螺旋结构。这与Barbara等[28]研究结果一致,一般多种单糖组成的多糖不易形成三股螺旋结构。
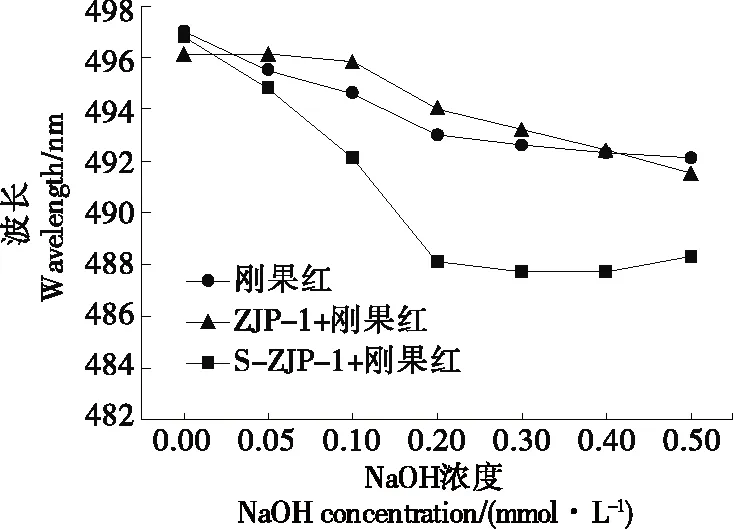
图3 ZJP-1和S-ZJP-1的刚果红试验结果Figure 3 Experimental results of Congo red of ZJP-1 and S-ZJP-1
2.2.4 扫描电镜 从图4可以看出,ZJP-1和S-ZJP-1多糖微观结构有明显差异。ZJP-1多为不规则的大块片状结构,而S-ZJP-1为不规则小块片状结构,说明硫酸化处理改变了红枣多糖的结构。Qian等[29]也指出不同种类、提取纯化方法和结构改性方法处理后多糖的微观结构有差异。

图4 ZJP-1和S-ZJP-1的扫描电镜图像Figure 4 Scanning electron microscope images of ZJP-1 and S-ZJP-1
2.3 多糖抗氧化活性
2.3.1 DPPH自由基清除能力 由图5可知,两种红枣多糖均显示较强的DPPH自由基清除活性,且两种红枣多糖的DPPH自由基清除活性随红枣多糖质量浓度的增加而升高。当质量浓度<0.2 mg/mL时,ZJP-1的DPPH自由基清除活性高于S-ZJP-1。但当质量浓度>0.2 mg/mL时,S-ZJP-1较ZJP-1显示出更强的DPPH自由基清除活性,当质量浓度达到0.5 mg/mL时,其DPPH自由基清除活性为47.6%,而ZJP-1为40.4%,说明经硫酸化修饰改变多糖的理化性质和空间构象使多糖DPPH自由基清除能力明显增强,同时,较高质量浓度的硫酸化修饰的红枣多糖相比纯化红枣多糖有更高的DPPH自由基清除能力,与宋见喜等[30]结果一致。
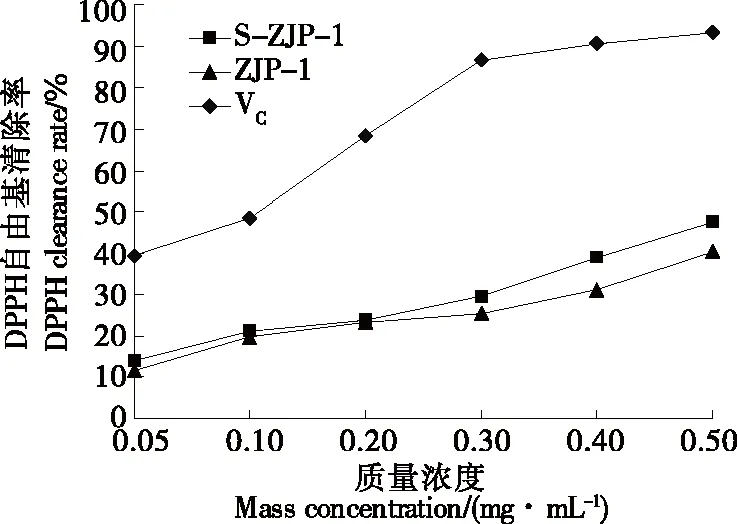
图5 ZJP-1和S-ZJP-1的DPPH自由基清除作用Figure 5 DPPH clearance of ZJP-1 and S-ZJP-1
2.3.2 总还原力 由图6可知,ZJP-1和S-ZJP-1均有一定程度的还原力,并随着质量浓度的增加,两种红枣多糖的还原力上升,为浓度依赖型。其中S-ZJP-1较ZJP-1显示出更强的还原力,当S-ZJP-1质量浓度达到0.5 mg/mL时,其还原力最强,为0.531,而此时ZJP-1的还原力为0.419。经过硫酸化修饰的红枣多糖相比纯化红枣多糖还原力增高,可能与两种红枣多糖的分子量与糖苷键有关。申进文等[31]研究也发现多糖提取物具有较强的体外抗氧化性能,其还原力随多糖浓度的增大逐渐增强。
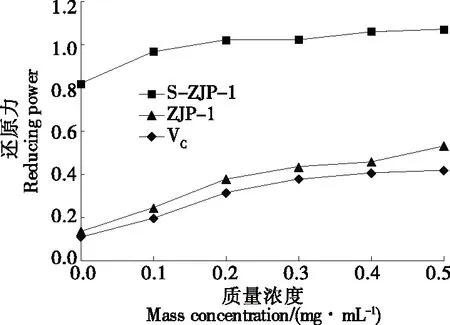
图6 ZJP-1和S-ZJP-1的还原力作用Figure 6 The reducing power effect of ZJP-1 and S-ZJP-1
综上,S-ZJP-1对DPPH自由基的清除能力以及还原能力均优于ZJP-1。这是因为多糖引入硫酸基后,改变了多糖的空间构象,从而引起了生物活性的改变。
3 结论
结果表明,纯化红枣多糖和硫酸化红枣多糖均为吡喃型多糖,由半乳糖、葡萄糖和阿拉伯糖3种单糖组成,不含三螺旋结构,均为无规则片状形态。纯化红枣多糖和硫酸化红枣多糖均具有较好的抗氧化性,且硫酸化红枣多糖的抗氧化性强于纯化红枣多糖。综上所述,硫酸化修饰并未破坏红枣多糖的主链结构,只取代多糖残基上的某一些羟基,从而改变多糖的分子结构,提高其生物活性,在抗氧化方面具有很好的应用前景,尤其在功能性食品、医药领域以及化妆品行业的广泛应用。关于硫酸化多糖体外活性与其取代度、分子量等的构效关系以及作用机制有待进一步研究。
