坛紫菜PhGME基因克隆及差异表达分析
2022-05-01魏鹏华王文磊纪德华谢潮添陈昌生
魏鹏华,王文磊,许 凯,徐 燕,纪德华,谢潮添,陈昌生
(1.集美大学水产学院,福建 厦门 361021;2.福建省水产生物育种与健康养殖工程研究中心,福建 厦门 361021;3.农村农业部东海健康养殖重点实验室,福建 厦门 361021)
0 引言
坛紫菜(Pyropiahaitanensis)是我国特有的暖温带栽培品种,隶属红藻门(Rhodophyta)原红藻纲(Protoflorideae)红毛菜目(Bangiales)红毛菜科(Bangiaceae),2019年养殖面积为1.48×104hm2,养殖产量为8.08万吨[1],约占紫菜总产量的75%以上,经济效益和生态效益可观。坛紫菜叶状体主要生活在潮间带的中高潮区域,在潮涨潮落变化之间,坛紫菜会遭遇温度、光照和盐度等环境因子的变化,这些频繁变化的环境因子对坛紫菜的生理特征产生较大影响。因此,坛紫菜已成为大型海藻逆境胁迫研究的代表性物种,而坛紫菜相关功能基因的克隆和表达分析将使人们更深入地了解坛紫菜对高温[2]、失水[3-4]、高光[5]和盐胁迫[6]等逆境胁迫的应答机制,并可为坛紫菜抗逆新品种的选育提供理论依据。
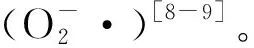
植物体内AsA主要有4种生物合成途径,其中L-半乳糖途径占主导地位[17]。L-半乳糖是GDP-D-甘露糖经由GDP-L-半乳糖、L-半乳糖和L-半乳糖-1,4-内酯作为中介合成的[18]。GDP-甘露糖-3,5-表异构酶(GME)是AsA生物合成中的关键酶之一。Wolucka等[18]研究发现,拟南芥(Arabidopsisthaliana)悬浮细胞内GME的活性与细胞中的AsA含量呈正相关。Ma等[19]在研究胁迫对拟南芥影响时发现,过表达GME基因后,转基因植株的AsA含量增加了1.5倍以上,而且植株的抗氧化能力也得到了提升。同样,GME的过表达也使水稻中的AsA含量增加,并增强了转基因水稻(Oryzasativa)对盐胁迫的耐受性[20]。在番茄(Lycopersiconesculentum)中过表达SlGME1和SlGME2基因后,转基因植株体内AsA含量也显著提高,进而增加了对盐胁迫和冷胁迫的抵抗力[21]。以上结果说明GME在植物AsA合成以及抗氧化过程中发挥着重要作用。那么,作为AsA生物合成中的限速酶,GME基因是否参与坛紫菜AsA的合成进而调控坛紫菜应答逆境胁迫,目前尚不清楚。
因此,本研究对坛紫菜中GME基因进行了全长克隆和生物信息学分析,并采用实时荧光定量PCR技术(qPCR)对PhGME基因在不同程度高盐胁迫条件下的表达特征进行了分析。研究结果可为坛紫菜逆境胁迫响应机制的研究提供功能基因。
1 材料与方法
1.1 实验材料及胁迫处理
实验材料:本实验所用的坛紫菜W-28、Z-26-R品系叶状体取自福建省坛紫菜种质资源库[22]。选取长度为15~20 cm、叶面平滑、无卷曲且生长状况良好的叶状藻体进行后续实验。其中W-28(TK)为厚叶品系、Z-26-R(TN)为薄叶品系。
培养条件:温度21 ℃,光照强度50 μmol/(m2·s),光周期12 L∶12 D,每两天更换一次新鲜的PES(provasoli’s enrichment solution)培养液。
高盐处理:选取15~20 cm左右健康完整的藻体,置于500 mL锥形瓶,培养液盐度110,光照强度50 μmol/(m2·s),光周期12 L∶12 D。胁迫处理0,0.5,6 h 后,分别提取其总RNA,用于高盐胁迫条件下基因表达水平的qPCR分析[23]。
1.2 叶绿素荧光参数Fv/Fm测定
本实验采用德国Walz公司生产的叶绿素荧光仪DIVING-PAM对藻体的最大光合效率(Fv/Fm)进行测定,测定前对藻体进行暗处理15 min。
1.3 引物及其序列
本研究中GME基因的克隆、验证、阳性菌落筛选及基因表达水平定量分析所采用的引物序列如表1所示,引物由厦门佰进生物科技有限公司合成。

1.4 PhGME基因的全长克隆及验证
根据坛紫菜转录组数据库中unigene基因的注释结果,选取注释结果为GDP-甘露糖-3,5-表异构酶基因的unigene17305作为PhGME基因全长克隆的核心序列。根据选取的核心序列设计普通PCR引物进行序列扩增验证(见表1)。扩增产物经琼脂糖凝胶电泳后,用通用型DNA纯化回收试剂盒(艾科瑞,湖南)对目的片段进行回收,扩增结束后于1%(质量分数)琼脂糖凝胶电泳检测,再与pMD19-T载体(TaKaRa,日本)连接后导入感受态细胞E.coli DH5α中,筛选出阳性克隆后进行放大培养,挑取阳性克隆单菌落,接种到含Amp的10 mL LB液体培养液中,37 ℃震荡培养过夜,摇好的菌液送至厦门铂瑞生物技术有限公司测序。根据测序结果,获得PhGME基因全长序列。
1.5 PhGME基因的生物信息学分析
利用NCBI的BlastN(http://blast.ncbi.nlm.nih.gov/Blast.cgi)程序对所获得的PhGME全长基因序列进行检测。采用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)软件分析PhGME基因的开放阅读框及其所编码氨基酸的序列。使用在线软件ExPASy Prot Param(http://web.expasy.org/protparam/)分析PhGME基因所编码蛋白质的一级结构。使用在线软件Predict Protein (https://www.predictprotein.org/)分析PhGME基因所编码蛋白质的二级结构。使用EXPASY(http://expasy.org/tools)对PhGME氨基酸序列的三级结构进行预测。使用在线网站SignalP(http://www.cbs.dtu.dk/services/SignalP/)分析PhGME基因是否存在信号肽。通过在线软件TMHMM Serverv.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)分析PhGME基因所编码蛋白质是否存在跨膜结构域。使用在线网(http://www.cbs.dtu.dk/services/YinOYang/)预测PhGME潜在的糖基化位点。采用DNAMAN进行氨基酸多重序列比对,并通过MEGA 6.0软件采用Neighbor-Joining (NJ)法构建PhGME蛋白质系统进化树。
1.6 PhGME基因在逆境胁迫下表达水平的qPCR分析
提取坛紫菜样品总RNA,参照Prime ScriptTMRT Reagent Kit with gDNA Eraser试剂盒(Takara)说明书完成定量模板的合成。
根据已获得的PhGME基因序列设计qPCR正反向引物(见表1)。以坛紫菜UBC基因作为内参(见表1),进行PhGME基因在不同时间高盐胁迫条件下的表达水平的qRT-PCR分析。
qRT-PCR扩增反应体系(20 μL):10 μL 2×SYBR Green Master Mix(艾科瑞),6.8 μL无核酸水,2 μL 10×稀释的模板,正反向引物(20 mmol/L)各0.4 μL,以及0.4 μL ROX Dye。扩增程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 31 s;40个循环。荧光定量PCR扩增在ABI 7300型定量PCR仪(Applied Biosystems,美国)上进行,每个处理梯度设置3个生物学重复和2个技术重复。坛紫菜PhGMEmRNA表达水平计算使用2-△△CT方法[24],计量数据资料均采用平均值±标准误(mean±SE)表示,并使用SPSS 17.0软件进行显著性分析(P<0.05为显著水平)。
2 结果
2.1 坛紫菜PhGME基因的全长克隆、验证及序列分析
以坛紫菜Unigene 0017305序列为核心序列,通过普通PCR扩增和测序获得一条1411 bp的基因序列(见图1)。经全长序列验证和BLAST比对,确认该基因为坛紫菜GDP-甘露糖-3,5-表异构酶基因,命名为PhGME。

通过ORF Finder在线软件分析发现,PhGME基因开放阅读框为第31个碱基到第1290个碱基,可编码419个氨基酸。通过NCBI保守结构域分析网站对该蛋白质进行预测,结果表明:PhGME含有NADB保守结构域(见图2)。

2.2 不同物种GME多序列比对
使用EXPASY(http://expasy.org/tools)对PhGME氨基酸序列的三级结构进行预测,结果如图3所示。蛋白质三级结构的预测结果表明,PhGME存在结合GDP-β-L-半乳糖的活性位点,富含甘氨酸(GXXGXXG)结合位点。

根据坛紫菜GME氨基酸序列,在NCBI中进行BLAST同源检索与比对,获得相似度较高的其他植物的GME氨基酸序列。将坛紫菜GME与角叉菜(Chondruscrispus)的同源蛋白质序列进行多重比对(见图4),结果显示,它们的氨基酸序列一致性为99%。

2.3 不同物种PhGME蛋白质相似性分析及进化树构建
在GenBank数据库中,BLAST搜索其他物种PhGME基因的氨基酸序列。将坛紫菜的PhGME氨基酸序列,同拟南芥(Arabidopsisthaliana)、烟草(Nicotianaattenuata)、水稻(Oryzasativa)、莱茵衣藻(Chlamydomonasreinhardtii)、苜蓿(Medicagotruncatula)、海洋球石藻(Emilianiahuxleyi)和角叉菜等多种物种的GME氨基酸序列进行比对。在此基础上用Neighbor-Joining(NJ)法构建了PhGME氨基酸序列系统进化树。进化分析结果如图5所示,高等植物单独聚为一大枝,绿藻门的莱茵衣藻、海洋球石藻和微藻聚为一枝,而PhGME与红藻门角叉菜聚为一枝,这说明PhGME基因较为保守。

2.4 PhGME蛋白质基本性质预测
使用在线软件对PhGME基因编码的蛋白质进行基本理化性质分析(Expasy,https://web.expasy.org/protparam/)。结果显示,PhGME蛋白质分子式为C2041H3187N573O613S28,相对分子质量为46 457.91 u,理论PI值为6.76,属于不稳定性蛋白质。
在线(http://www.cbs.dtu.dk/services/YinOYang/)预测表明,PhGME存在16个潜在的O-连接糖基化位点(Tyr5、Tyr13、Tyr28、Tyr50、Tyr359、Tyr515、Tyr545、Tyr912、Tyr941、Tyr956、Tyr1318、Tyr1327、Tyr1328、Tyr1342、Tyr1351、Tyr1359)。
利用在线分析工具SignalP和TMHMM对PhGME基因信号肽和跨膜结构进行预测,结果表明,PhGME蛋白质有一个信号肽,序列为AGACTTAAGAACATGATTACGCCAAG,且该基因无跨膜结构域。利用PSORT网站在线Prediction工具对该蛋白质进行亚细胞定位预测,结果显示,PhGME定位于细胞质的可能性最大(见表2)。

表2 PhGME蛋白质亚细胞定位预测Tab.2 Subcellar location prediction of PhGME基因在细胞中表达位置Gene expression position in cells概率Rate/%细胞质Cytoplasm0.45微体(过氧化物酶体)Microbody(peroxisome)0.30线粒体基质空间Mitochondrial matrix space0.10
2.5 PhGME启动子序列顺式作用元件分析
对PhGME基因编码区起始密码子上游2 kb左右区域内的启动子序列进行分析,结果显示:该序列中含有1个与分生组织表达有关的顺式作用元件(CAT-box),1个参与细胞周期调控的顺式作用元件,2个与植物激素响应相关的作用元件(包括1个脱落酸响应元件(ABRE),1个与生长素响应元件(TGA-element));此外,还含有2个参与茉莉酸甲酯(MeJA)反应的顺式调控元件和5个与光响应相关的顺式作用元件。

表3 PhGME启动子序列中的主要顺式作用元件

续表
2.6 高盐胁迫下坛紫菜藻体叶绿素荧光参数Fv/Fm变化
本实验测定不同高盐处理时间下的坛紫菜Fv/Fm,观察厚叶品系(TK)、薄叶品系(TN)在高盐胁迫下的耐受情况。由图6可知:高盐胁迫下,坛紫菜叶状体的光合参数显著下降,TK品系的Fv/Fm在每个时间点虽有下降但均显著高于TN品系(P<0.05);当高盐(110)胁迫处理0.5 h时,TK品系下降至0.6左右,TN品系下降至0.2左右;当高盐胁迫处理8 h时,TK品系下降至0.4以下,TN品系下降至0.2以下,趋近于0(P<0.05),此时藻体光合系统遭受严重损伤,且TN品系遭受的损伤更为严重,说明TK品系较之TN品系更耐受高盐胁迫。因此,本研究挑选0.5 h和6 h作为盐胁迫条件进行后续实验。

2.7 高盐胁迫下坛紫菜不同品系的PhGME基因差异表达分析
基因表达水平的定量分析是研究基因功能的前提。本研究采用qRT-PCR技术分析了PhGME基因在高盐胁迫条件下的相对表达水平的变化。PhGME基因的表达水平在TK品系和TN品系中有不同的转录丰度。图7显示出高盐胁迫处理不同时间的坛紫菜PhGME基因的表达分析结果:高盐(110)处理0.5 h、6 h,TK品系PhGMEmRNA的相对表达水平均高于TN品系(P<0.05);处理6 h,相较于对照组,TN品系的基因表达量略有上升;随着盐胁迫时间延长,TK品系的基因表达量呈逐渐上升趋势(P<0.05);处理6 h,TK品系PhGME基因的表达水平是正常盐度条件下生长的1.48倍。
2.8 高盐胁迫下不同坛紫菜品系的抗坏血酸含量变化
由图8可以看出,坛紫菜叶状体在遭受高盐胁迫时,AsA含量均有增加。高盐处理0.5 h、6 h后,TK品系的AsA含量相较于未胁迫组分别增加了10倍和43倍;而TN品系实验组的AsA含量分别是对照组的4倍和5倍。

3 讨论
本研究克隆获得了坛紫菜PhGME基因,该基因编码的蛋白质包含1个NAD结合域(NAD-binding)(见图2),属于NADB Rossmann超级家族[25]。PhGME还具有GXXGXXG保守结构,这与文献[26]的研究结果一致。研究[26]表明,红藻GME基因除了具备特有的底物结合位点外,还应具有属于短链脱氢酶家族(SDRs)的GXXGXXG保守结构。
研究[27-28]表明,在番茄中过表达SlGME1和SlGME2基因,不仅可以提高番茄叶片和果实中AsA的含量,还可以增加其对低温、高盐及氧化胁迫的耐受性。同样GME的过表达也使水稻中的AsA含量增加,并增强了转基因水稻对盐胁迫的耐受性[20]。大型海藻中也有相关报导,例如,随着盐胁迫处理时间的延长或盐度的增加,条斑紫菜(Pyropiayezoensis)藻体内AsA的合成基因显著上调,AsA含量相较于对照组也显著增加了1.5倍以上[29-30]。本研究也得到相同的研究结果,不同厚度品系藻体中的AsA含量均有增加(见图8)。其中,TK品系在高盐胁迫6 h后,AsA含量增长趋势相较于未胁迫组明显上升,且TK品系的AsA含量是对照组的43倍。高盐胁迫处理6 h后,两个坛紫菜品系中PhGME基因的表达水平都显著上调,而且耐盐品系TK中PhGME基因的表达水平更高,是正常盐度条件下的1.48倍(见图7)。因此,高盐胁迫诱导坛紫菜PhGME基因转录水平上升,可能促进了藻体内AsA合成,清除过多的ROS,维持藻体的氧化还原平衡。
综上所述,GME基因作为植物中一类响应逆境胁迫的基因,在坛紫菜响应高盐胁迫时发挥了重要的作用。高盐胁迫下GME参与坛紫菜藻体中AsA的合成,清除过多的ROS,维持坛紫菜细胞内的氧化还原平衡。因此,本研究为理解坛紫菜的耐高盐机制,培育耐高盐品系,提供了新的视野和理论基础。
