荷包牡丹的组培快繁技术研究
2022-04-29魏进莉



摘 要:为解决荷包牡丹(Lamprocapnos spectabilis 'Amore Rose')的快繁问题,以荷包牡丹试管苗的叶片为外植体材料,进行了组培快繁技术的试验研究,建立了快繁技术体系。结果表明,以幼嫩新叶为外植体材料,更有利于愈伤组织及丛生芽的形成;初代培养基以MS+0.5 mg·L-1 6-BA+0.5 mg·L-1 KT+0.1 mg·L-1 NAA为最优,丛生芽的诱导率为85.7%;继代增殖培养基以MS+0.5 mg·L-1 6-BA +0.05 mg·L-1 NAA为最优,增殖系数达3.5;生根培养基以1/2 MS+0.5 mg·L-1 NAA+0.5 mg·L-1 IBA为最优,生根率达到98%;在草炭∶珍珠岩∶蛭石=7∶3∶2的优质移栽基质上,炼苗成活率达95%以上。最适宜的培养温度为20±1 ℃。用荷包牡丹的幼嫩试管苗叶片,通过愈伤组织诱导获得再生植株,成功建立了组培快繁技术体系。
关键词:荷包牡丹;幼嫩新叶;丛生芽;组织培养;玻璃化
中图分类号:Q943.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2022.04.003
Study on Tissue Rapid Propagation of Lamprocapnos spectabilis 'Amore Rose'
WEI Jinli
(Beijing Florascape Co., Ltd., Beijing 100093, China)
Abstract: In order to solve the problem of rapid propagation of Lamprocapnos spectabilis 'Amore Rose', the leaves was used as the explants to conduct the research of tissue culture techniques of propagation, and establish the sterile rapid propagation system in vitro. The results showed that it was easier to form callus and buds with young new leaves as explants. MS + 0.5 mg·L-1 6-BA+0.5 mg·L-1 KT+0.1 mg·L-1 NAA was the suitable medium for explants induction of callus and cluster buds, the induction rate of cluster buds was 85.7%; MS+0.5 mg·L-1 6-BA+0.05 mg·L-1 NAA was the optimizing medium for multipropagation, the multiplication coefficient could reach up to 3.5; 1/2 MS+0.5 mg·L-1 NAA+0.5 mg·L-1 IBA was the best medium for rooting, the rooting rate could reach to 98%. After 30 days transplanted into greenhouse, the survival rate of young plants were over 95%.The optimum culture temperature was 20±1 ℃. Regenerated plants were obtained from the leaves of young test tube plantlets of Lamprocapnos spectabilis 'Amore Rose' through callus induction, and the technical system of tissue culture and rapid propagation was successfully established.
Key words: Lamprocapnos spectabilis'Amore Rose'; young new leaves; cluster buds; tissue culture; glass transition
荷包牡丹(Lamprocapnos spectabilis (L.) Fukuhara)又稱铃儿草、铃心草、璎珞牡丹、荷包花、蒲包花、土当归、活血草、锦囊花等,是罂粟科荷包牡丹属多年生宿根草本花卉,原产中国河北和东北地区,日本和西伯利亚[1]。荷包牡丹耐寒、耐半阴,花期较早,在4—6月份,且花期较长,在绿化中可增添早春园林的色彩,尤其适合我国北方寒冷地区的栽植与应用[2]。其株高30~60 cm,叶丛美丽,总状花序,花色有玫红、粉红和白色等,花朵玲珑,形似荷包,色彩绚丽,是盆栽和切花的好材料,也适宜于布置花境和在树丛、草地边缘湿润处丛植,亦可供庭园栽培观赏,是景观效果极好的宿根花卉[3],在园林绿化应用中极其广泛;同时,其全草可入药,具有很好的药用价值,其内含物荷包牡丹碱具有镇静和镇痛作用,被广泛应用医学研究领域,尤其近年来应用于癌症的治疗研究,荷包牡丹碱对肝癌、胃癌和肺癌细胞的转移、侵袭、增殖和生长具有抑制作用[4-6],开发前景非常广阔。目前,国内荷包牡丹的繁殖是通过分株法、扦插法和播种法来繁殖,扦插繁殖6—7月进行,成活率较低[7];分株繁殖3月初与10月进行,每2~3年方可进行一次分株[8],受到季节和环境的影响限制,使得繁殖难度大效率低;播种繁殖,10月进行播种,翌年春季发芽,移栽后2~3年才能开花[9],效率也很低。因此,通过组织培养技术能有效地解决荷包牡丹的快速繁殖问题。
目前,有关荷包牡丹的组培繁殖技术,在国内尚未见有公开报道的相关资料。本研究中的材料是从国外新引进的优良品种,数量只有几十株,若用常规的方法来繁殖,除了繁殖效率低之外,可供取材的母本基数也甚少,很难在较短时间内大量繁殖走向市场。为满足广大爱好者和消费者的需求,荷包牡丹的组织培养技术研究,建立无性离体快繁体系和实现工厂化生产育苗是亟待解决的问题。本研究的结果,也可为其他的组培育苗或育种提供参考依据。
1 材料和方法
1.1 试验材料
以荷包牡丹(Lamprocapnos spectabilis 'Amore Rose')的试管苗叶片为材料,来源于从美国Terra Nova公司新引进的试管苗。
1.2 试验方法
1.2.1 叶片诱导丛生芽 用来进行叶片诱导的培养基是在MS培养基的基础上,添加不同浓度水平的6-BA、KT和NAA,以及白砂糖30 g·L-1和琼脂粉4.5 g·L-1,培养基的pH值为5.8~6.2,灭菌温度121 ℃,时间20 min。准备好培养基以后,将供试材料在超净工作台上的无菌条件下,切取带有0.5~1 cm左右长叶柄的叶片为外植体材料,根据叶片大小可切分成2~3小片,将切分好的叶片平铺接种于培养基上,试验培养基共设5个处理,每个处理接种5瓶重复,每瓶接种7个外植体材料,接种完成后放入培养室进行培养(无特殊说明,培养条件均为以进口的飞利浦LED灯为光源,光强度为30 μmol·m-2·s-1,光照时长为每天10 h,培养温度为20 ± 2 ℃),培养30 d时观察、转接并记录结果。
1.2.2 丛生芽的继代增殖培养 丛生芽继代增殖的培养基是在MS培养基的基础上,添加不同浓度水平的6-BA和NAA,其它同上。将叶片诱导所得愈伤组织以及不定芽,以1~2个芽为一丛进行分割后,接种到丛生芽继代增殖培养基上,试验培养基共设6个处理,每个处理接种5瓶重复,每瓶接种5个试验材料,培养30 d时观察、转接并记录结果。
1.2.3 增殖苗在不同温度下进行培养 以增殖苗为试验材料,接种到增殖培养基上,放入光照培养箱中进行培养,培养温度设置为18 ℃±1 ℃,20 ℃±1 ℃,22 ℃±1 ℃高、中、低3种不同的温度处理,每个处理5瓶重复,每瓶接种10个试验材料,培养30 d时,观察、转接并记录结果。
1.2.4 诱导生根培养 生根培养的培养基是以1/2 MS培养基为基础,添加不同浓度水平的IBA和NAA,以及白砂糖20 g·L-1,其它同上。将继代扩繁所得的丛生芽苗切成单株,选取植株标准达到株高3 cm和叶片数量4片及以上的无根单株壮苗,接种到生根培养基上,培养基共设7个处理,每个处理接种5瓶重复,每瓶接种10株苗,生根培养25 d时观察统计结果。
1.2.5 生根苗的移栽炼苗 将生根后的瓶苗移到温室,拧松瓶盖放在苗床上,并用遮阳网进行遮光,以避免阳光直射造成培养瓶内温度过高和光过强而使苗损伤,在瓶内炼苗2~3 d后将苗从培养瓶中取出,清洗干净根部的培养基[10],栽到装有炼苗专用基质块(按体积比优质草炭∶珍珠岩∶蛭石=7∶3∶2)的128孔穴盘上,栽完苗后立即喷一次水,喷施一次多菌灵1 000倍或甲霜猛辛1 000倍液,随后放到炼苗床上进行养护,养护30 d时,统计成活率。
1.3 数据处理及分析
愈伤组织诱导率(%)=出愈伤组织的外植体数/接种的外植体数×100;芽诱导率(%)=分化出芽的愈伤组织外植体数/接种的外植体数×100;增殖倍数=接种后苗的总数量/接种前的总数量;可生根率(%)=可用来接生根苗的数量/苗的总数量×100;生根率(%)=有根的苗数量/最初接种的进行生根培养的苗数量×100。
采用Excel 2010和SPSS18.0软件进行数据整理、统计和分析显著性差异。
2 结果与分析
2.1 叶片诱导丛生芽
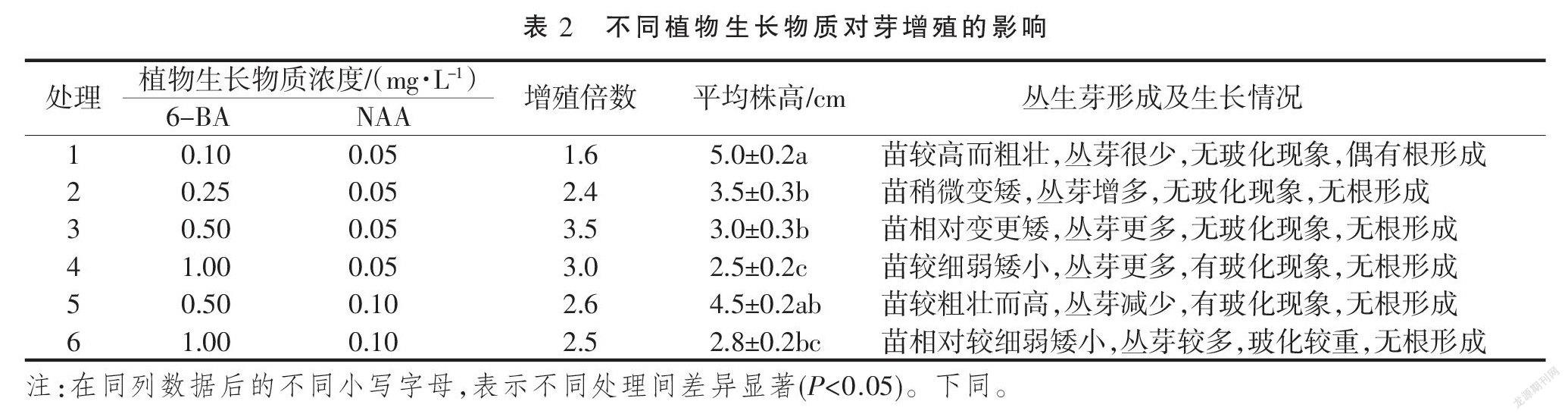
将切分好的外植体叶片接种到不同的芽诱导培养基上(图1- A),培养10 d时开始形成愈伤组织,20 d后开始形成丛生芽,30 d时已形成较多的丛生芽,并且有1~2 cm的完整小植株长起来。在外植体诱导丛生芽的过程中,植物生长物质的种类及浓度对丛生芽的诱导形成都有着不同程度的影响。在不添加任何植物生长物质的情况下,外植体叶片不会形成愈伤组织;在添加有细胞分裂素6-BA的培养基中,只有少数外植体诱导形成了较少的丛生芽,多数外植体只形成了较小的胚状愈伤组织块,没有芽的形成,并且在添加较低浓度6-BA的培养基里连愈伤组织都没有形成;而在添加了6-BA和KT两种细胞分裂素的培养基中,有较多的胚状愈伤组织和丛生芽形成(图1-B),当KT的浓度增高时,有利于愈伤组织的形成,同时随着6-BA和KT浓度的增高出现了玻璃化现象。在5个不同处理中,以同时添加0.5 mg·L-1 6-BA和KT两种细胞分裂素的处理3培养基中的培养效果性状表现为最佳,丛生芽的诱导率为85.7%,具体见表1。
2.2 丛生芽的继代增殖培养
在外植体诱导丛生芽所得结果的基础上,将由外植体培养获得的不定芽,以1~2个芽为一丛切分后接种到继代增殖培养基上,培养30 d时形成丛生芽。在继代增殖培养过程中,不同的植物生长物质浓度不同对芽增殖的影响也有所不同。6-BA浓度增高时有利于芽的形成和增多,NAA浓度增高时有利于苗长高大。6-BA与NAA的配比比例和浓度越低时,苗相对较为高而粗壮,有利于生根培养;比例越高,有利于芽的形成,但随着培养基中6-BA和NAA的浓度增大,玻璃化现象越严重,使有效增值倍數变低。在增殖培养基中,6-BA和NAA的添加浓度分别为0.5,0.05 mg·L-1时,也就是在处理3中增殖倍数最高,达到3.5,并且苗的生长情况相较也最佳;处理1中的苗更有利于生根培养,具体见表2。
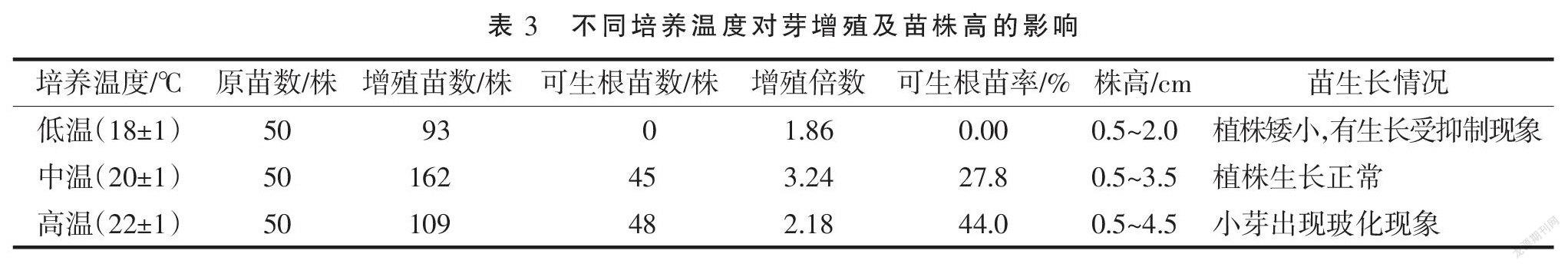
2.3 增殖苗在不同温度下进行培养
在18±1 ℃这样较低的温度下培养时,荷包牡丹的增殖苗生长相对较为缓慢,植株变得较为矮小,高度仅为2 cm,能够用来进行接种生根培养的苗很少,在这样的温度环境下培养时,苗的生长周期变长,使得大量的生产出苗很难实现;当温度升高到20±1 ℃这样的中等温度时,苗生长变得较快,芽苗增多的同时苗的质量也变得较好,苗株高能达到3 cm以上,可用来接种生根培养的大好苗数量增多,培养效果相较为最佳;当培养温度升高到22±1 ℃时,在前期阶段苗生长较快并且苗长得更高大一些,苗株高能达到4 cm以上,但到了后期开始出现玻璃化现象,尤其是基部的小芽随着培养时间的增长玻璃化更为严重,使得整体芽苗的品质变差,能用来接种生根培养的大好苗数量明显下降,具体见表3。
2.4 诱导生根培养
将继代扩繁所得的切去基部小芽和愈伤组织的单株大苗接种到生根培养基上(图1-C),培养15 d时开始有根形成;到20 d时多数苗有根形成;再到25 d时根系长达2 cm以上(图1-D),生根率达到98%。试验结果表明,植物生长物质的种类和浓度对根的形成有着较大影响,在荷包牡丹的生根培养过程中发现,将NAA和IBA结合起来使用时,生根效果明显好于其中一种单独使用的效果,在适宜的浓度中生根率和根的整齐度都明显变好。不论是结合起来使用,还是单独使用,在添加的植物生长物质的浓度过高时,对根的形成和生长都出现抑制现象。在7个不同的处理中,以处理5的培养效果为最佳。具体见表4。
2.5 生根苗的移栽炼苗
荷包牡丹的生根苗从培养瓶移出栽入炼苗基质后,将基质及苗全部用50%多菌灵1 000倍液喷施浸透,然后放在温室温度20~25 ℃和空气湿度70%~85%的环境条件下养护,养护期间每隔7~10 d喷施一次浓度稀释1 000倍的速溶复合肥(氮磷钾含量比例为20∶20∶20),养护到15 d时已长出2片新叶(图1-E),养护到30 d时根能够长满穴包住基质,长出4片左右新叶,株高为6 cm左右,苗健壮,成活率达到95%以上。
3 结论与讨论
在以荷包牡丹的无菌叶片为外植体接种培养获得丛生芽的过程中发现,植物生长调节剂是影响外植体材料形态发生的最关键因素,植物愈伤组织诱导及不定芽分化较大程度取决于植物生长调节剂的种类和浓度[11],不同的植物生长调节剂种类和浓度,对外植体诱导形成愈伤组织及丛生芽有着不同程度的影响。在同等植物生长调节剂浓度水平下,越幼嫩的叶片组织启动形成愈伤组织越早,并且愈伤组织易形成丛生芽,但随着植物生长调节剂的浓度水平越高时易玻化[12-14];越老的叶片启动越慢甚至有的不启动,也不易形成芽。另外,当激素浓度越高时,越有利于愈伤组织的形成,尤其是KT对愈伤组织形成的促进作用明显大于6-BA,但当其浓度过高时,愈伤变得松散而不利于芽的形成;适当降低细胞分裂素与生长素的比值也会对愈伤组织的增殖起到一定的促进作用[15-16]。
荷包牡丹对温度比较敏感,当温度较低光照较强时,玻璃化现象减少或无玻化,而当温度低于18 ℃时,苗生长相对缓慢而植株矮小,甚至出现生长受阻现象;当温度高于22 ℃以上时,会有玻璃化现象出现,随着温度的升高玻璃化苗的数量明显增多,叶色为深绿色,呈水浸状,即使剩余的没有玻璃化的好苗质量有所降低,再次转接或者接种生根苗的效果也不如中温下培养的好。因此,在荷包牡丹的组织培养快繁过程中,温度的控制很重要。
在生根培养过程中发现,在6-BA含量较低的培养基中,培养的苗增殖系数低,但苗壮而植株单一,这样的苗更容易生根。在工厂化大量生产时,根据需求调控6-BA和NAA浓度比例,在生根培养前进行一次壮苗培养,这样有利于提高苗的质量和降低生产成本[17]。经测算,结合温度控制和壮苗培养,可使生产成本相较低温下大幅下降30%以上。
另外,在荷包牡丹的培养过程中还发现,在苗生长过程中会分泌代谢产物使培养基慢慢褐变,由浅黄色到黄褐色逐渐变化,并随时间越长颜色越深,温度越高褐化现象也越明显。这种培养基的褐变现象对苗生长影响不明显,因此没有进行深入研究。
参考文献:
[1] 马利娜, 马健. 观赏花卉珍品——荷包牡丹[J]. 中国园艺文摘, 2017, 33(7): 168-169.
[2] 潘伟, 张爽. 荷包牡丹的繁殖与栽培管理技术[J]. 中国园艺文摘, 2010, 26(3): 97-98.
[3] 姚如伟. 浅谈荷包牡丹的栽培技术与应用[J]. 现代农业, 2021(3): 64-65.
[4] 郭锰, 张成辉, 吴婷婷. 荷包牡丹碱对人肝癌MHCC97-H细胞转移、侵袭的影响及机制研究[J]. 中草药, 2019, 50(22): 5515-5520.
[5] 汪诗卉, 陈剑群, 董秋菊, 等. 荷包牡丹碱对人胃癌 SGC-7901细胞生长的作用及机制初探[J]. 中华临床医师杂志(电子版), 2013, 7(11): 4898-4901.
[6] 刘岩, 张虹, 金雪, 等. 荷包牡丹碱对人肺癌A549细胞生长及端粒酶活性的抑制作用[J]. 中国药理学与毒理学杂志, 2011, 25(6): 543-546.
[7] 马冬梅. 荷包牡丹栽培繁殖技术[J]. 种子世界, 2010(1): 35-36.
[8] 沈慧. 荷包牡丹扦插繁殖[N]. 中国花卉报, 2005-06-11.
[9] 兑宝峰. 荷包牡丹栽培管理[N]. 中国花卉报, 2014-07-08(008).
[10] 马艳, 王静飞, 刘婷, 等. 胡杨杂种叶片组培技术研究[J]. 中国野生植物资源, 2019, 38(4): 1-6, 12.
[11] 马崇坚, 郑声云, 卓海标. 粉葛种苗离体繁殖技术初步研究[J]. 广东农业科学, 2013, 40(15): 28-30, 35, 4.
[12] 白艳荣, 蒋亚莲, 王进英. 花毛茛组培快繁技术研究[J]. 北方园艺, 2021(1): 48-53.
[13] 陆从巍, 赵震虎, 王鹏, 等. 提高花卉组培苗移栽成活率的技术[J]. 农业科技通讯, 2005(4): 22-23.
[14] 梁立东, 李明文. 俄罗斯杨树新品种N12玻璃化组培苗恢复培养的研究[J]. 林业科技, 2020, 45(4): 1-3.
[15] 蔡祖国, 徐小彪, 周会萍. 植物组织培养中的玻璃化现象及其预防[J]. 生物技术通讯, 2005, 16(3): 353-355.
[16] 刘宾照, 高红梅, 陶艳. 不同浓度3种激素对花毛茛組培增殖率的影响[J]. 安徽农业科学, 2013, 41(8): 3350-3351, 3417.
[17] 魏进莉, 李丽芳, 于学斌. 紫叶狼尾草的组织培养与快速繁殖[J]. 植物生理学报, 2015, 51(2): 207-211.
