脂肪酸结合蛋白在缺血性肠病患者中的相关性研究
2022-04-28张伟伟王家旭黄炎东唐少波
张伟伟 王家旭 黄炎东 唐少波
脂肪酸结合蛋白在缺血性肠病患者中的相关性研究
张伟伟 王家旭 黄炎东 唐少波
(南宁市第一人民医院,广西 南宁 530022)
目的:通过检测缺血性肠病(ICBD)患者肠脂肪酸结合蛋白(I-FABP)表达水平,为ICBD患者的早期诊断、治疗监测以及预后评估提供客观指标。方法:连续选取南宁市第一人民医院2015年3月至2020年6月急性腹痛的患者72例,其中行肠系膜CTA及肠镜确诊ICBD的患者21例为观察组。另外51例为对照组,对各组患者年龄、性别、白细胞计数(WBC)、C-反应蛋白、D-二聚体以及I-FABP表达水平进行比较,运用受试者工作特征曲线(ROC),分析I-FABP预测其诊断的价值。结果:观察组I-FABP、D-二聚体高于对照组,差异有统计学意义(<0.05);各组患者年龄、性别、体温、WBC、C反应蛋白等其他指标比较,差异无统计学意义(>0.05)。I-FABP以131.5 ug/L为截断值,I-FABP评估患者患缺血性肠病风险的曲线下面积分别为0.850(95%CI0.762~0.938,<0.05)。结论:早期检测患者血清I-FABP有助于ICBD的早期诊断。
缺血性肠病;肠脂肪酸结合蛋白;诊断价值
引言
缺血性肠病(Ischemic bowel disease,ICBD)由于腹腔动脉、肠系膜上动脉、肠系膜下动脉及其分支血管发生血运障碍引起的肠壁血流灌注不良,导致了相应肠道缺血性损害,临床上可表现为恶心、呕吐、腹胀、腹痛、腹泻、血便,严重者则甚至会出现肠坏死、肠穿孔、腹膜炎、感染性休克,进而危及生命。按发生部位不一样,可分为小肠缺血或肠系膜缺血,大肠缺血或结肠缺血或缺血性结肠炎。临床肠系膜缺血进一步分类为急性缺血和慢性缺血。虽然缺血性肠病在临床实践中并不常见,但如果不及时识别和治疗,其发病率和死亡率可能会很高。随着人口老龄化趋势加剧,缺血性肠病发病率越来越高[1],由于老年人个体差异明显,而且缺血性肠病的早期临床征象和相关辅助检查缺乏特异性,极易误诊和漏诊。大多数缺血性肠病患者属于轻度至中度严重程度,并伴有良性病程。但对于暴发性、坏疽性或穿孔性结肠炎、非保守治疗无效、慢性溃疡性结肠炎和缺血性结肠结构,很少需要手术治疗。肠道供血不足可导致急性肠系膜缺血,死亡率为60%至90%,这种高死亡率部分往往与发现晚和缺乏有效的早期诊断测试有关。因为缺血性肠病的早期诊断对开始治疗至关重要,因此临床上急需一种新的检测手段。理想的检测是一个非侵入性的简单生化检测,用以增加临床可疑的缺血性肠病早期诊断,并将提高病人的选择放射性检测的准确性,可以立即进行便捷的床边诊断[2]。
脂肪酸结合蛋白(I-FABP)是肠上皮细胞分泌的一种水溶性蛋白质[3],主要位于小肠黏膜层,当发生肠黏膜缺血时释放入血[6]。目前越来越多的研究表明肠脂肪酸结合蛋白(Intestinal fatty acid binding protein,I-FABP)参与肠道黏膜损伤[3,4],I-FABP已经成为研究热点,例如Sahin[5]发现I-FABP水平有助于急性肠系膜缺血的诊断。Kanda[7]的研究表明血清I-FABP在诊断小肠缺血的敏感性、阳性预测值和阴性预测值方面比传统生化指标更有效。Cronk[8]的研究也表明I-FABP是机械性小肠阻塞缺血的敏感指标。Kittaka[9]认为I-FABP水平是鉴别绞窄性肠梗阻和单纯性肠梗阻的有用指标。然而Salim[10]的研究发现急性肠系膜缺血患者血清I-FABP水平与对照组比较无统计学意义,但是急性肠系膜缺血患者尿I-FABP明显高于对照组,故其认为尿I-FABP是一种非侵入性的生物标志物,具有高度的特异性和敏感性,可用于精确诊断急性肠系膜缺血。故Ding等[11]的meta分析认为I-FABP在ICBD的诊断研究结果差异较大,I-FABP在缺血性肠病诊断中的准确性还有待进一步研究。虽然I-FABP已经成为研究热点,但更多的是在动物方面的研究,而I-FABP在ICBD患者中的研究报道较少,而且I-FABP在缺血性肠病的诊断价值中的研究结果仍存在较大差异。因此本研究旨在探讨肠型脂肪酸结合蛋白(I-FABP)在ICBD患者早期诊断中的作用。
D-二聚体是纤维蛋白单体经活化因子XIII交联后,再经纤溶酶水解所产生的一种特异性降解产物,是一个特异性的纤溶过程标记物。只要机体血管内有活化的血栓形成及纤维溶解活动,D-二聚体就会升高,常用于监测血栓性的疾病,例如缺血性肠病、心肌梗死、脑梗死、肺栓塞、静脉血栓形成、弥漫性血管内凝血等均可导致D-二聚体升高。Yang[12]等在肠坏死患者中的研究发现D-二聚体水平作为诊断肠坏死指标的最佳临界值预计为1.965 mg/L,敏感性为84.0%,特异性为45.6%,阳性预测值为60.7%,阴性预测值为74.0%。以1.65 mg/L d-二聚体作为鉴别可逆性肠缺血和肠坏死的临界值,敏感性为84.0%,特异性为70.0%。加上联合应用D-二聚体和腹膜刺激征进行平行分析可靠的阴性预测值,有助于排除肠道坏死的诊断。因此本研究同时检测D-二聚体。
1 资料与方法
1.1 一般资料
连续选取南宁市第一人民医院2015年3月至2020年6月急性腹痛的患者72例,其中行肠系膜CT血管造影及肠镜确诊为ICBD的患者21例,为观察组。另外51例为对照组。排除标准:(1)腹部外伤、肿瘤、休克、生命体征不稳定、严重肝、肾的脏器功能不全;(2)孕产妇、小于18周岁;(3)不能配合完成本研究、死亡、转院、放弃治疗的病例。入选病例的一些临床特点如表1所示。
表1 入选病例的临床特点(±)
1.2 方法
检测指标两组患者入院后I-FABP、C-反应蛋白、D-二聚体水平。入组后采集静脉血样5 mL,3000 r/min高速离心,分离上层血清,-80℃保存待检测。检测方法D-二聚体检测采用法国Stago公司提供STR-A型全自动血凝分析仪,及原装配套的D-二聚体试剂。按照试剂说明书进行严格的操作。I-FABP及C-反应蛋白检测使用酶联免疫法(ELISA)检测,两种试剂均购自武汉博士康生物公司,按照试剂说明书进行严格的操作。
采用SPSS26.0进行分析数据,结果图用GraphPad Prism 5.0软件以mean±SD的形式输出。两组比较采用非配对t检验,不服从正态分布时用秩和检验,方差不齐时用t'检验,三组比较采用完全随机设计F检验,相关性分析根据数据类型进行Pearson或者Spearman相关性分析。<0.05为差异有统计学意义。运用受试者工作特征曲线(ROC),分析I-FABP诊断的价值。以<0.05为差异有统计学意义。
2 结果
2.1 基本特征
相关分析表明,I-FABP的表达与入选病例的年龄、性别、白细胞无相关性;与D-二聚体、C-反应蛋白呈正相关性,D-二聚体、C-反应蛋白越高,I- FABP水平越高,详见表2。
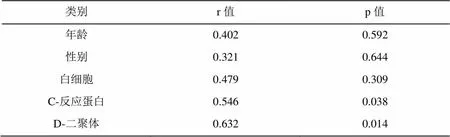
表2 I-FABP的表达与入选病例特点的Spearman相关分析
<
注:差异具有统计学意义(0.05)
2.2 I-FABP的表达
为了了解缺血性肠病中I-FABP、D-二聚体、C-反应蛋白的表达,用检测了血清I-FABP、D-二聚体、C-反应蛋白的表达。结果显示观察组I-FABP、D-二聚体比对照组显著升高,差异有统计学意义;观察组年龄、性别、白细胞、C-反应蛋白比对照组无明显差异,差异无统计学意义。详见表3。
表3 两组I-FABP、D-二聚体、C-反应蛋白等比较(±)

表3 两组I-FABP、D-二聚体、C-反应蛋白等比较(±)
类别观察组对照组P值 性别(男/女)9/1221/31>0.05 年龄(岁)64.02±11.1659.07±9.87>0.05 白细胞(×10 9 /L)12.38±1.8511.08±1.36>0.05 C-反应蛋白(mg/L)43.26±21.8535.72±16.23>0.05 D-二聚体(ug/L)3.28±1.022.18±0.70<0.05 I-FABP(ug/L)228.23±81.69124.89±62.37<0.013
<
注:差异具有统计学意义(0.05)
2.3 评估价值分析
ROC曲线示,I-FABP以131.5 ug/L为截断值,D-二聚体以2.7 ug/L为截断。I-FABP评估患者患缺血性肠病风险的曲线下面积分别为0.850(95%CI0.762~0.938,<0.05)。D-二聚体评估患者患缺血性肠病风险的曲线下面积分别为0.756(95%CI0.607~0.906,<0.05)。I-FABP诊断缺血性肠病的敏感度为95.2%,特异度为76.5%;D-二聚体诊断缺血性肠病的敏感度为71.45,特异度为70.2%。I-FABP联合D-二聚体联合(均为阳性)评估患者患缺血性肠病风险的曲线下面积为0.875(95%CI0.796~0.952,<0.05)诊断缺血性肠病的敏感度为95.2%,特异度为78.1%。见图1及表4。

图1 I-FABP、D-二聚体及I-FABP联合D-二聚体在诊断ICBD中形成的ROC曲线

表4 三组间D-二聚体、I-FABP及其联合的ROC曲线分析
3 讨论
缺血性肠病常见于有肠系膜血管动脉粥样硬化的老年人群。因此随着我国人口老龄化趋势加剧,缺血性肠病发病率越来越高[1]。缺血性肠病是临床上的急重症。其危险因素包括糖尿病、高血压、冠状动脉疾病、周边动脉阻塞性疾病、心室颤动、心衰竭、新近心肌梗死、休克、需要血液透析的慢性肾衰竭、严重脱水、慢性阻塞性肺病、风湿性自身免疫性疾病、遗传性和后天性血栓形成倾向、手术后(腹主动脉瘤、结肠切除术、分流术),以及继发于某些药物的使用比如雌激素、地高辛、达那唑、阿洛司琼、伪麻黄碱、血管加压素、精神药物、舒马曲坦、泻药和非甾体抗炎药等。而老年人的基础疾病相对较多,个体差异明显,缺血性肠病的临床表现没有特异性,故临床上缺血性肠病的诊断比较困难。目前临床上的腹部CT、腹部磁共振、腹部血管彩超虽然有助于缺血性肠病的临床诊断,但其误诊率和漏诊率高,敏感度和特异度还有待进一步提高。而肠系膜CTA及腹部血管造影(DSA)能准确地反映出肠系膜上动脉的血供及肠管灌注情况,但是由于是有创的检查、花费大,设备要求高、具有相当禁忌证,因此难以在基层医院的诊疗过程中普遍开展。进行结肠镜检查并在48小时内进行活检也是确诊缺血性肠病的主要方法,但是也因为是有创性的操作、花费大、设备要求高、检查前需提前清肠、患者检查的风险也高,因此不便于临床上及时进行。本研究发现,I-FABP与D-二聚体、C-反应蛋白呈正相关性;D-二聚体、C-反应蛋白越高,I-FABP水平越高。观察组的I-FABP、D-二聚体的表达比对照组显著升高,差异有统计学意义。说明I-FABP、D-二聚体可能与缺血性肠病有密切相关。
本研究发现观察组在年龄、性别、白细胞、C-反应蛋白方面与对照组无明显差异,差异无统计学意义。表明观察组I-FABP的表达与对照组的年龄、性别、白细胞无相关性。但是白细胞、C-反应蛋白均较正常参考值高。这可能是白细胞、C-反应蛋白作为炎症活动的指标,除缺血性肠病之外,其他胃肠道的炎症反应以及全身各系统的炎症反应均可以引起白细胞和C-反应蛋白升高,急性腹痛者大多存在不同程度的炎症反应,因此观察者及对照组在白细胞、C-反应蛋白方面无明显差异,但较正常参考范围高。
本研究发现结果显示观察组I-FABP、D-二聚体比对照组显著升高,差异有统计学意义。说明缺血性肠病患者中I-FABP、D-二聚体的表达显著高于非缺血性肠病的腹痛患者。这与Kanda T等[7]研究一致,他们的研究发现小肠缺血患者血清I-FABP水平明显高于非缺血性小肠病患者,认为血清I-FABP在诊断小肠缺血的敏感性、阳性预测值和阴性预测值方面比肌酸磷酸激酶或乳酸脱氢酶等生化指标更有效;认为血清I-FABP测定是一种非侵入性的检测方法,可能有助于急腹症患者小肠缺血风险的有效识别。Schellekens等[13]在同样的研究中,也测量了I-FABP,其研究发现粘膜缺血和跨壁缺血患者的血浆I-FABP水平均显著高于正常对照组;当肠道灌注的逐渐减少和肠细胞膜的完整性的缺失时都有助于I-FABP快速释放进入循环并进一步被肾脏排出;因此,I-FABP可以同时在血清(或血浆)和尿液中测定,但健康受试者血浆中的I-FABP浓度很低,在肠粘膜缺血后60分钟内血液中的I-FABP浓度显著升高。而Hot S等[14]研究发现肠系膜缺血组与非缺血组比较,缺血2小时后缺血组D-二聚体的表达对照组明显升高,表明D-二聚体水平可用于急性肠系膜缺血的早期诊断。
血浆I-FAB在正常健康人群中表达非常低,Kanda[7]等研究发现健康人血清I-FABP<65 ug/L。本研究发现观察组及对照组血清I-FABP的表达均明显高于其研究中正常健康人群血清I-FABP。但是本研究中I-FABP的表达在观察组中显著高于对照组的。目前考虑是因为不同程度的肠粘膜炎症均可以引起I-FABP升高,如急性胃肠道、肠结核、克罗恩病、溃疡性结肠炎、肠梗阻、创伤、休克等可以引起急性肠粘膜损伤的病因均可引起血清I-FABP浓度明显升高[15]。石卉等[16]研究表明不同程度的胃肠粘膜炎症均可引起I-FABP升高。
因为I-FABP仅存在于胃肠道内,器官特异性较高,而且对肠缺血再灌注引发的损害较为敏感[1,17],当肠黏膜绒毛受损时,大量I-FABP会释放入血,可导致血清I-FABP水平急剧升高;随着肠黏膜损伤的加重,释放入血的I-FABP逐渐增多,导致血清I-FABP水平进一步上升[18]。本研究ROC曲线示I-FABP以131.5 ug/L为截断值,I-FABP评估患者患缺血性肠病风险的曲线下面积分别为0.850,诊断缺血性肠病的敏感度为95.2%,特异度为76.5%,特异性明显不如敏感性。但是相比较于D-二聚体评估患者患缺血性肠病风险的曲线下面积分别为0.756;诊断缺血性肠病的敏感度为71.45%,特异度为70.2%。表明I-FABP的敏感性及特异性均较D-二聚体更高。这与Murat Güzel[19]的研究结论一致,他们的研究表明与白细胞增多和D-二聚体升高相比,I-FABP水平升高是诊断急性肠系膜缺血更可靠的参数。Sun D L等[20]的荟萃分析中发现I-FABP在缺血性肠病诊断中的敏感性、特异性分别为80.0%、80.0%,也表明I-FABP可能是用于确认急腹症患者急性肠缺血的一种有用的诊断有效方法。
本研究发现I-FABP联合D-二聚体联合(均为阳性)评估患者患缺血性肠病风险的曲线下面积为0.875,诊断缺血性肠病的敏感度为95.2%,特异度为78.1%。表明联合检测I-FABP和D-二聚体诊断缺血性肠病的特异度均较单独检测I-FABP或D-二聚体的要高。表明联合检测I-FABP和D-二聚体有可能可提高ICBD诊断的特异度。万嘉等[21]的研究也表明急性肠系膜上静脉血栓形成患者中D-二聚体、肠脂肪酸结合蛋白水在异常升高,认为D-二聚体、肠脂肪酸结合蛋白可作为急性肠系膜上静脉栓塞的早期诊断指标。胡东来等[22]在小儿绞窄性肠梗阻的研究中发现联合检测血清中D-二聚体及肠脂肪酸结合蛋白有助于早期预测小儿绞窄性肠梗阻,并且有助于评估绞窄性肠梗阻的严重程度;两者联合检测时可以提高绞窄性肠梗阻早期诊断的敏感性。因此,联合检测I-FABP和D-二聚体有可能有助于提高缺血性肠病诊断的特异度。
4 结束语
综上所述,I-FABP表达水平与缺血性肠病密切相关,I-FABP、D-二聚体对缺血性肠病的诊断有一定的临床意义。联合检测I-FABP和D-二聚体有可能有助于提高缺血性肠病诊断的特异度。但由于本研究入选病例数有限,I-FABP诊断准确性还有待进一步研究。
[1] 周洁,何伯圣. 缺血性肠病的研究进展[J]. 交通医学,2019,33(4): 369-371,375.
[2] Abdelrasoul G N, MacKay S, Salim S Y, et al. Non-invasive point-of-care device to diagnose acute mesenteric ischemia[J]. ACS Sensors, 2018, 3(11): 2296-2302.
[3] Ho S S C, Keenan J I, Day A S. The role of gastrointestinal-related fatty acid-binding proteins as biomarkers in gastrointestinal diseases[J]. Digestive Diseases and Sciences, 2020,65(2): 376-390.
[4] Khadaroo R G, Fortis S, Salim S Y, et al. I-FABP as biomarker for the early diagnosis of acute mesenteric ischemia and resultant lung injury[J]. PLoS One, 2014, 9(12): e115242.
[5] Sahin A, Altay D A, Demir S, et al. Comparison of the diagnostic values of vascular adhesion protein-1 and intestinal fatty acid-binding protein in the diagnosis of acute mesenteric ischemia[J]. European Journal of Trauma and Emergency Surgery, 2019, 45(3): 545-553.
[6] Bazzi C, Rizza V, Olivieri G, et al. Tubular reabsorption of high, middle and low molecular weight proteins according to the tubulo-interstitial damage marker N-acetyl-beta- D-glucosaminidase in glomerulonephritis[J]. Journal of Nephrology, 2015, 28(5): 541-548.
[7] Kanda T, Tsukahara A, Ueki K, et al. Diagnosis of ischemic small bowel disease by measurement of serum intestinal fatty acid-binding protein in patients with acute abdomen: a multicenter, observer-blinded validation study[J]. Journal of Gastroenterology, 2011, 46(4): 492-500.
[8] Cronk D R, Houseworth T P, Cuadrado D G, et al. Intestinal fatty acid binding protein (I-FABP) for the detection of strangulated mechanical small bowel obstruction[J]. Current Surgery, 2006, 63(5): 322-325.
[9] Kittaka H, Akimoto H, Takeshita H, et al. Usefulness of intestinal fatty acid-binding protein in predicting strangulated small bowel obstruction[J]. PLoS One, 2014, 9(6): e99915.
[10] Salim S Y, Young P Y, Churchill T A, et al. Urine intestinal fatty acid-binding protein predicts acute mesenteric ischemia in patients[J]. Journal of Surgical Research, 2017, 209: 258-265.
[11] Ding C M, Wu Y H, Liu X F. Diagnostic accuracy of intestinal fatty acid binding protein for acute intestinal ischemia: a systematic review and Meta-analysis[J]. Clinical Laboratory, 2020, 66(6): 191139.
[12] Yang K, Wang W, Zhang W H, et al. The combination of D-dimer and peritoneal irritation signs as a potential indicator to exclude the diagnosis of intestinal necrosis[J]. Medicine, 2015, 94(40): e1564.
[13] Schellekens D H S M, Reisinger K W, Lenaerts K, et al. SM22 a plasma biomarker for human transmural Intestinal ischemia[J]. Annals of Surgery, 2018, 268(1): 120-126.
[14] Hot S, Egin S, Ilhan M, et al. The value of potassium, pH and D-dimer levels in early diagnosis of acute mesenteric ischemia: an experimental study on rats[J]. Archives of Medical Science, 2019, 17(1): 236-240.
[15] Simoes A L, Figueira R L, Goncalves F L, et al. Temporal profile of intestinal tissue expression of intestinal fatty acid-binding protein in a rat model of necrotizing enterocolitis[J]. Clinics, 2016, 71(7): 412-419.
[16] 石卉, 吴本俨. 肠脂肪酸结合蛋白在缺血性肠病中的研究进展[J]. 中华老年多器官疾病杂志, 2011, 10(6): 556-559.
[17] Adriaanse M P M, Mubarak A, Riedl R G, et al. Progress towards non-invasive diagnosis and follow-up of celiac disease in children; a prospective multicentre study to the usefulness of plasma I-FABP[J]. Scientific Reports, 2017, 7(1): 8671.
[18] Guillaume A, Pili-Floury S, Chocron S, et al. Acute mesenteric ischemia among postcardiac surgery patients presenting with multiple organ failure[J]. Shock, 2017, 47(3): 296-302.
[19] Guzel M, Sozuer E M, Salt O, et al. Value of the serum I-FABP level for diagnosing acute mesenteric ischemia[J]. Surgery Today, 2014, 44(11): 2072-2076.
[20] Sun D L, Cen Y Y, Li S M, et al. Accuracy of the serum intestinal fatty-acid-binding protein for diagnosis of acute intestinal ischemia: a Meta-analysis[J]. Scientific Reports, 2016, 6: 34371.
[21] 万嘉,杨镛,李珊珊,等. D-二聚体、肠脂肪酸结合蛋白在急性肠系膜上静脉血栓形成患者中的临床意义[J]. 中国全科医学,2019,22(24): 2933-2936.
[22] 胡东来,舒强,陈青江,等. D-二聚体联合肠脂肪酸结合蛋白早期预测小儿绞窄性肠梗阻的作用研究[J]. 中华小儿外科杂志,2019(8): 713-718.
Reaserch on the Correlation of Fatty Acid Binding Protein in Patients with Ischemic Bowel Disease
Objective: To detect the expression level of intestinal fatty acid binding protein (I-FABP) in patients with ischemic bowel disease (ICBD), so as to provide objective indicators for early diagnosis, treatment monitoring and prognosis evaluation of patients with ICBD. Methods: 72 patients with acute abdominal pain in The First People's Hospital of Nangningfrom March 2015 to June 2020 were selected continuously, including 21 patients with icbd diagnosed by mesenteric CTA and colonoscopy as the observation group. The other 51 cases were the control group. The age, sex, white blood cell count (WBC), C-reactive protein, D-dimer and the expression level of I-FABP in each group were compared. The diagnostic value of I-FABP was analyzed by using the receiver operating characteristic curve (ROC). Results: The levels of I-FABP and D-dimer in the observation group were significantly higher than those in the control group (<0.05); there were no significant differences in age, sex, body temperature, WBC, C-reactive protein and other indexes among the groups (>0.05) . I-FABP was truncated at 131.5 ug/l, the areas under the curve of I-FABP in assessing the risk of ischemic bowel disease were 0.850 (95%CI0.762~0.938,<0.05). Conclusion: Early detection of serum I-FABP is helpful to the early diagnosis of ICBD.
ischemic bowel disease; intestinal fatty acid binding protein; diagnostic value
R574
A
1008-1151(2022)03-0094-04
2021-11-28
张伟伟(1977-),男,南宁市第一人民医院消化内科副主任医师,副教授,研究方向为消化系统疾病的诊治及消化内镜的应用。
