亚热带落叶乔木叶蜡正构烷烃单体碳同位素季节变化特征及影响因素
2022-04-28闫超阳黄咸雨
杨 婷, 闫超阳, 黄咸雨, 2*
亚热带落叶乔木叶蜡正构烷烃单体碳同位素季节变化特征及影响因素
杨 婷1, 闫超阳1, 黄咸雨1, 2*
(1. 中国地质大学(武汉) 地理与信息工程学院 流域关键带演化湖北省重点实验室, 湖北 武汉 430078; 2. 中国地质大学(武汉) 生物地质与环境地质国家重点实验室, 湖北 武汉 430078)
叶蜡正构烷烃单体碳同位素组成已经成为陆相沉积古生态重建的重要研究方法。现代过程研究是提升叶蜡正构烷烃指标解译的重要环节, 而目前关于落叶乔木叶蜡烷烃单体碳同位素组成(δ13Calk)的季节性变化研究还比较有限。本文对两种典型亚热带落叶乔木(小叶栎、枫香)开展了为期2年的叶蜡烷烃δ13Calk研究。两个树种叶蜡烷烃的δ13Calk值在春季偏正, 随后迅速偏负, 秋季变幅较小, 趋于稳定。这种季节性变化特征和初期利用储存的老碳而后期利用新合成的糖类有关。在生长季末期, 两种落叶乔木叶蜡烷烃相对于叶片的碳同位素分馏系数处于−6‰ ~ −8‰, 相对于文献报道的平均值偏负, 这可能是因为生长季后期仍有少量的长链正构烷烃合成。研究结果揭示, 基于落叶乔木叶蜡烷烃单体碳同位素进行古环境重建时需要考虑环境信号的季节性。
落叶乔木; 叶蜡烷烃; 单体碳同位素; 表观分馏系数; 季节变化
0 引 言
植物叶蜡覆盖在植物组织外表面, 是叶片角质层的主要成分。叶蜡主要由长链脂肪族化合物构成, 包括长链正构烷烃、脂肪酸、脂肪醇等。它的主要生理功能是调节叶片的水分蒸腾损失(Eglinton and Hamilton, 1967)。在各种叶蜡脂类中, 正构烷烃由于结构稳定、分布广泛等特点, 受到了最多的关注, 也被广泛应用于古气候和古环境重建(Feakins et al., 2016; Li et al., 2016; 刘丰豪等, 2018)。植物叶蜡正构烷烃的合成与植物类型、外界环境条件变化有关, 温度、降水及相对湿度等环境因子会影响植物叶蜡的含量和组成(Sachse et al., 2012; Bush and Mcinerney, 2013; Diefendorf and Freimuth, 2017)。基于不同植物来源的正构烷烃组成及主峰碳的差异可以区分物源信息, 已经建立了一系列的古环境指标。例如, 长链正构烷烃的平均碳链长度(ACL; Poynter et al., 1989)、碳优势指数(CPI; Cooper and Bray, 1963)以及中等碳链的占比(aq; Ficken et al., 2000)等指标。
伴随着色谱同位素比值质谱技术的发展, 正构烷烃的单体同位素组成被越来越多地应用于古环境研究。叶蜡烷烃单体同位素能够更为灵敏地反映外界环境条件变化, 揭示丰富的气候信息(Diefendorf and Freimuth, 2017; Liu and An, 2020)。长链正构烷烃的碳同位素组成(δ13Calk)已经被用于反映干湿等古气候变化和有机质来源(Jia et al., 2015; 刘畅等, 2019)。叶蜡烷烃δ13Calk值主要受控于温度、湿度、光照强度、大气CO2浓度和植被类型等因素(Diefendorf and Freimuth, 2017; Liu et al., 2019)。此外, 叶蜡正构烷烃的主要合成时间也是需要重点考虑的因素之一, 这会决定哪些季节的环境信号能够被δ13Calk记录下来(Huang et al., 2018; Suh and Diefendorf, 2018; Tipple and Ehleringer, 2018)。然而, 对于植物整个生长季中正构烷烃单体碳同位素组成变化的研究还相对较少, 已有的少量研究集中在温带地区(Pedentchouk et al., 2008; Suh and Diefendorf, 2018; Tipple and Ehleringer, 2018), 缺乏对其他地区特别是亚热带地区的研究。
在亚热带季风气候地区, 气温和降水的季节性变化显著(丁一汇等, 2013)。6月下旬至7月中旬, 长江中下游地区进入梅雨期, 降雨量大且相对集中; 梅雨过后的盛夏时节, 该地区容易发生“伏旱”现象。在这种波动频繁的气候条件下, 探究亚热带植物叶蜡正构烷烃单体碳同位素组成的季节变化规律, 有助于我们理解亚热带地区叶蜡烷烃单体碳同位素的古气候意义。本研究选取了两种典型的亚热带落叶乔木(小叶栎、枫香), 在前期调查叶蜡烷烃组成、氢同位素组成和叶片总有机碳同位素组成(δ13Cbulk)的基础上, 探讨叶蜡烷烃δ13Calk的季节变化特征, 揭示控制其季节变化的因素, 服务于落叶乔木叶蜡烷烃单体碳同位素的古环境应用。
1 研究材料及方法
1.1 研究区域
本文的研究地点是武汉市南望山。武汉市(113°41′~115°05′E, 29°58′~31°22′N)是湖北省省会城市, 气候为亚热带季风性湿润气候, 夏季受东亚夏季风影响, 高温多雨; 冬季受冬季风影响, 寒冷干燥。根据南望山上的空气温湿度仪记录, 2014年至2015年期间, 夏季平均温度为26 ℃, 冬季平均温度为5 ℃, 季节变化较明显(Huang et al., 2018)。相对湿度具明显季节性, 月变化量不大, 总体上2014年的相对湿度(约60%)大于2015年的相对湿度(约40%)(图1)。

细线表示日平均变化, 粗线表示十日平均变化。
武汉位于中亚热带向北亚热带过渡地区, 地带性土壤主要包括红壤、黄棕壤和黄壤, 地带性植被以常绿落叶阔叶混交林为主。20世纪60~70年代以来的人类活动破坏了南望山上的原生植被, 人工种植了大量的马尾松。此后, 经过自然次生演替, 落叶乔木小叶栎、枫香以及常绿乔木樟树等逐步占据了植被的主导地位。长期监测点位于南望山山顶开阔地带(33°31′40″N, 114°23′31″E, 海拔约为87 m), 光照良好, 生长着多株成年的小叶栎和枫香。
1.2 样品采集及脂类提取
样品采集时间的设计参照同纬度的合肥站(31°49′21.30″N, 117°13′18.25″E)落叶树种的物候信息。该站监测的垂柳(a)初始展叶时间在3月上旬至3月中旬(中国气象局气候变化中心, 2020)。枫香和小叶栎的叶片样品采集时间为2014年3月至2015年11月, 包含两个完整的叶片生长季。在植物叶片生长初期(3月底至5月底, 属于春季)每1至2周采集一次, 叶片成熟期(6月及以后, 属于夏季和秋季)一个月采集一次。叶片采集选取成熟植株, 高约5~10 m, 叶片采集位置位于约3 m高的向阳处。在2014年和2015年, 第一次叶片采集时间都在3月下旬, 采集的是已经初步伸展开的嫩叶。
采集的叶片先用水冲洗干净, 再用超纯水淋洗3遍后用铝箔包裹进行冷冻干燥, 以确保无灰尘等杂物混入。冻干后的叶片先剪碎, 再用二氯甲烷和甲醇的混合溶液(体积比为9∶1)进行超声萃取, 提取时间为15 min, 重复4次。合并后的萃取液经减压旋转蒸发浓缩, 再通过硅胶柱层析得到烷烃及非烃组分, 洗脱试剂依次为正己烷、二氯甲烷和甲醇的混合溶液(体积比为1∶1)。
1.3 脂类仪器分析
烷烃组分在岛津GC 2010型气相色谱仪上进行定量。色谱柱为DB-5毛细管柱(长30 m, 内径0.25 mm, 膜厚0.25 μm)。载气为氦气, 流速1 mL/min。升温程序为: 初始温度70 ℃, 以10 ℃/min的速率升至210 ℃, 保持30 min。进样口温度为300 ℃。检测器为氢火焰离子化检测器(FID)。内标为胆甾烷。通过内标峰面积来计算丰度, 并根据相关的响应因子进行调整。
正构烷烃单体碳同位素分析在Thermo Delta XP同位素比值质谱仪上进行。气相色谱仪为Thermo Trace GC。色谱柱为DB-5 MS毛细管柱。气相色谱升温程序为: 初始温度50℃, 保持1 min, 然后以10 ℃/min的速率升至210 ℃, 保持2 min, 之后再以4℃/min的速率升温至300 ℃, 保持2 min, 最后以10 ℃/min的速率升至310 ℃, 保持25.5 min。每个样品至少重复测两次, 保证精度<0.5‰。实验室标准为购自美国印第安纳大学的C16~C30烷烃标样及配置的C23~C33奇碳数烷烃标样。内标为角鲨烷(δ13C=−19.8‰)。最终碳同位素值是相对维也纳拟箭石(VPDB)标准的结果。参照Chikaraishi and Naraoka (2003)计算叶片总有机质和长链烷烃间的碳同位素表观分馏系数。
2 结 果
2.1 叶蜡正构烷烃组分变化
Huang et al. (2018)已经发表了本项研究的烷烃含量数据, 这里简要地介绍2014~2015年小叶栎和枫香烷烃组成的变化特征。在全部样品中, 正构烷烃都表现出了明显的奇偶优势, 只是两种乔木的主峰碳略有差别(图2)。小叶栎中C29与C31相对含量比例相当, 同为优势组分, 在所有正构烷烃组分中占绝对优势(均>30%)。枫香以C31组分占比最大, 同时有大量的C29和C33, 其他组分的比例较低。以上特征与前人已经报道的乔木叶蜡烷烃的组成相符(Sachse et al., 2012; Bush and McInerney, 2015)。这两种植物的正构烷烃浓度变化具有相似的季节模式, 在5~7月出现一个峰值, 然后降低但维持在一个相对稳定的浓度值(表1; Huang et al., 2018)。另外, 正构烷烃的分子分布也随叶片生长的季节变化而变化。在两个生长季中, 两种植物的ACL和CPI都在叶片生长初期较低, 随后达到一个高值, 在叶片成熟期趋于稳定(表1)。
表1显示, 在两个完整的生长期内, 枫香叶片的总烷烃浓度、ACL值及CPI值整体都高于小叶栎。另外, 两种植物2015年的总烷烃浓度高于2014年。枫香两个生长期的ACL值基本相近, 平均值分别约为31.14和31.10, 小叶栎的ACL值2014年高于2015年。两种植物CPI值两年间整体变化趋势相似。
2.2 叶片有机碳同位素季节变化
Huang et al. (2018)报道了小叶栎和枫香的总有机碳同位素值(δ13Cbulk)。小叶栎的δ13Cbulk值在两年观测期间的变化范围为−30.8‰ ~ −26.7‰。在生长初期, 小叶栎的δ13Cbulk值为整个生长季的最高值, 随后随着叶片的扩展开始偏负, 在6月初δ13Cbulk值仍呈现小幅度下降的趋势, 但整体趋于稳定(图3)。整体来看, 小叶栎的δ13Cbulk值2014年变幅大于2015年, 2014年春季的δ13Cbulk值较2015年春季偏正约1‰, 而在夏季和秋季, 小叶栎2014年与2015年的δ13Cbulk值及变化模式则较为相似。枫香的δ13Cbulk值分布范围为−31.3‰ ~ −26.0‰。同小叶栎一样, 枫香的δ13Cbulk值也存在相似的季节变化模式(图3)。2014年与2015年, 枫香的δ13Cbulk值季节变化趋势整体一致, 但2014年相较于2015年偏正, 尤其是叶片刚开始扩展及叶片停止扩展时期, 分别偏正了1.6‰和1.5‰。

图2 2014~2015年小叶栎(a)和枫香(b)正构烷烃平均组成
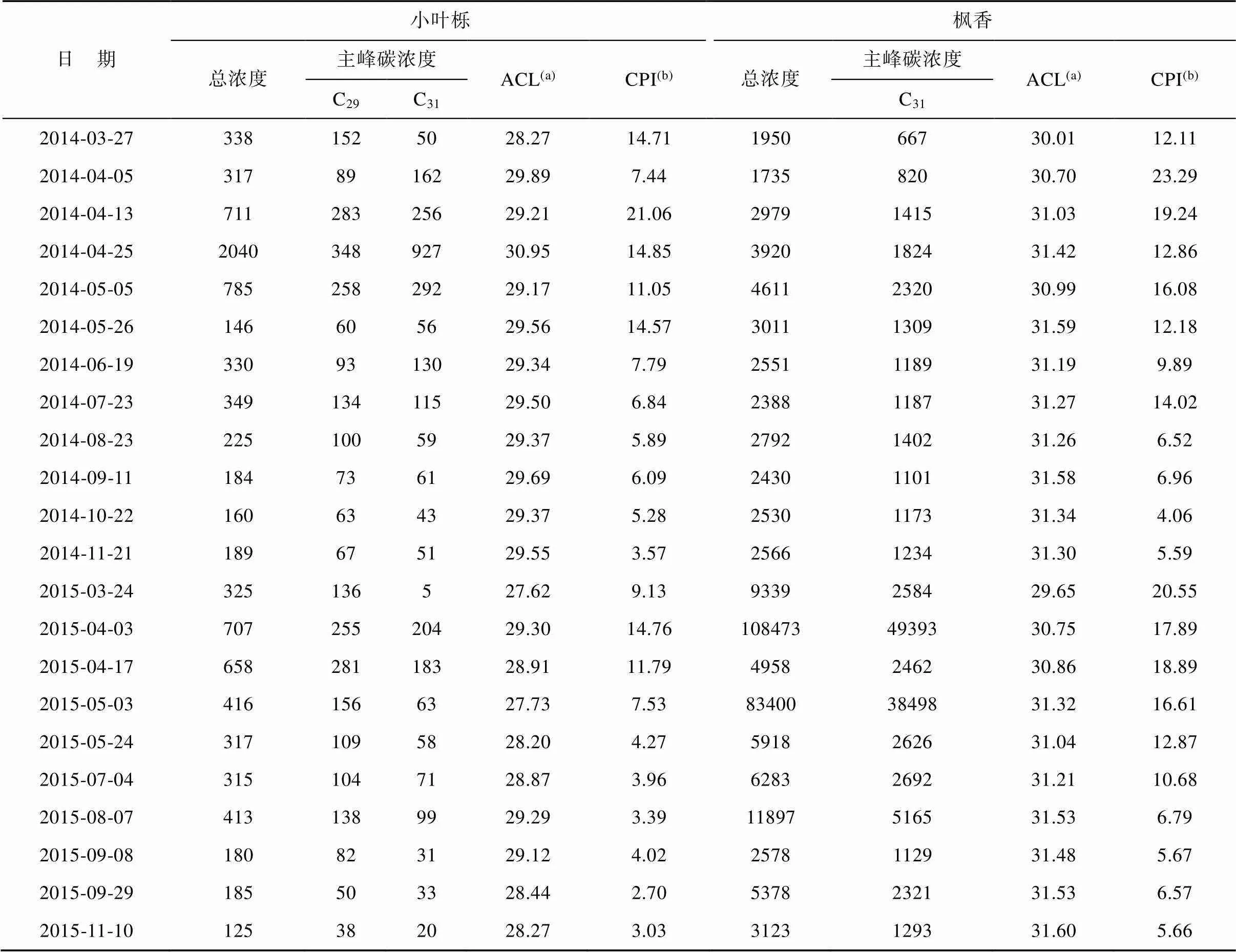
表1 2014~2015年小叶栎和枫香正构烷烃总浓度(μg/g, 以干重计算, 下同)、主峰碳浓度(μg/g)、ACL及CPI数据

2.3 叶蜡正构烷烃单体碳同位素季节变化
小叶栎主要正构烷烃C29和C31的δ13Calk值变化范围分别为−39.4‰ ~ −32.3‰和−40.0‰ ~ −32.4‰ (图4)。2014年和2015年变化趋势基本一致: 春季δ13Calk值总体偏正, 夏季逐渐偏负, 秋季变化幅度较小且趋于稳定。小叶栎δ13Calk值在2014年5月和6月均出现正偏现象, 随后δ13Calk值再次偏负。比较而言, 2015年的变化较稳定, 3月底至4月C29和C31的δ13Calk值迅速偏正, 随后偏负, 在9月达到一个低值后小幅回升, 随后保持稳定。
枫香正构烷烃的主峰为C31, 其δ13Calk值分布范围为−40.1‰ ~ −32.9‰。C33的δ13Calk值为−40.1‰ ~ −34.9‰(图4)。枫香正构烷烃C31和C33的δ13Calk值在两个生长期变化趋势基本一致。枫香正构烷烃单体碳同位素在2014年4月逐渐偏负, 之后叶片成熟期变幅较小。2015年4、5月逐渐偏负, 之后开始偏正, 8月达到最高值, 随后呈小幅偏负趋势, 但仍保持较春季更偏正的δ13Calk值。2014年和2015年两个生长期枫香的δ13Calk最高值出现的时间不同, 2014年出现在早春, 2015年则出现在夏季。并且整个生长期2014年的δ13Calk值均大于2015年。
同δ13Cbulk值一样, 小叶栎和枫香主要烷烃的δ13Calk值存在较为相似的季节变化模式。另外, 两种植物的δ13Calk值的季节变化表现出了差异性。2015年两种植物的δ13Calk值季节变化相较于2014年小, 并无频繁起伏。但是, 两个生长季中两种植物δ13Calk值的峰值出现时间并不一致。2014年小叶栎δ13Calk值的最高值出现在早春和7月, 最低值出现在生长期后期(11月), 枫香与小叶栎一致; 2015年小叶栎δ13Calk值最高值则出现在5月, 最低值在叶片成熟期(9月), 枫香的最高值出现在成熟期(9月), 最低值在5月底。
3 讨 论
3.1 正构烷烃δ13Calk季节变化的可能原因
经过两年的观测, 发现小叶栎和枫香叶蜡正构烷烃的δ13Calk值均表现出了明显的季节性变化规律(图4)。叶片在生长初期, δ13Calk值偏正, 随后逐步偏负,在成熟期则保持相对稳定。δ13Calk的变化模式与δ13Cbulk大致相同, 也和前人报道的落叶乔木的季节变化结果相符(Tipple and Pagani, 2013; 丁一汇等, 2013; 中国气象局气候变化中心, 2020)。上述季节性变化可能与落叶乔木的生长特性有关。在叶片生长初期, 落叶植物主要利用前一个生长季末期储存的碳水化合物(Newberry et al., 2015; Cormier et al., 2018)。在植物体内, 光合产物在从叶片向其他非光合组织迁移的过程中会发生碳同位素逐步正偏的现象(Gleixner et al., 1993; Badeck et al., 2005), 使得储存在枝条或树干的碳水化合物相对富集13C(Vogado et al., 2020)。伸展初期的叶片利用这些储存的碳水化合物使得其δ13Calk与δ13Cbulk偏正。随着新生叶片的扩展及叶片光合能力的增强, 大量新的碳水化合物(具有偏负的碳同位素组成)被合成, 这些新合成且具有较负碳同位素值的糖类能够供应叶蜡脂类的合成, 使得叶片的δ13Calk值也逐步偏负。而在叶片生长后期, 从叶片成熟到衰老, δ13Calk保持着相对稳定的值, 但仍存在小幅度的变化。这可能是由于成熟叶片合成新的正构烷烃(Huang et al., 2018), δ13Calk值随之发生变化。需要注意的是, 小叶栎在每个生长季最早期的样品表现出较为偏负的δ13Calk值(图4), 说明还有其他因素会影响δ13Calk值的变化, 需要开展更长时间的监测研究。

图3 2014~2015年小叶栎(a)和枫香(b)总有机碳同位素值变化
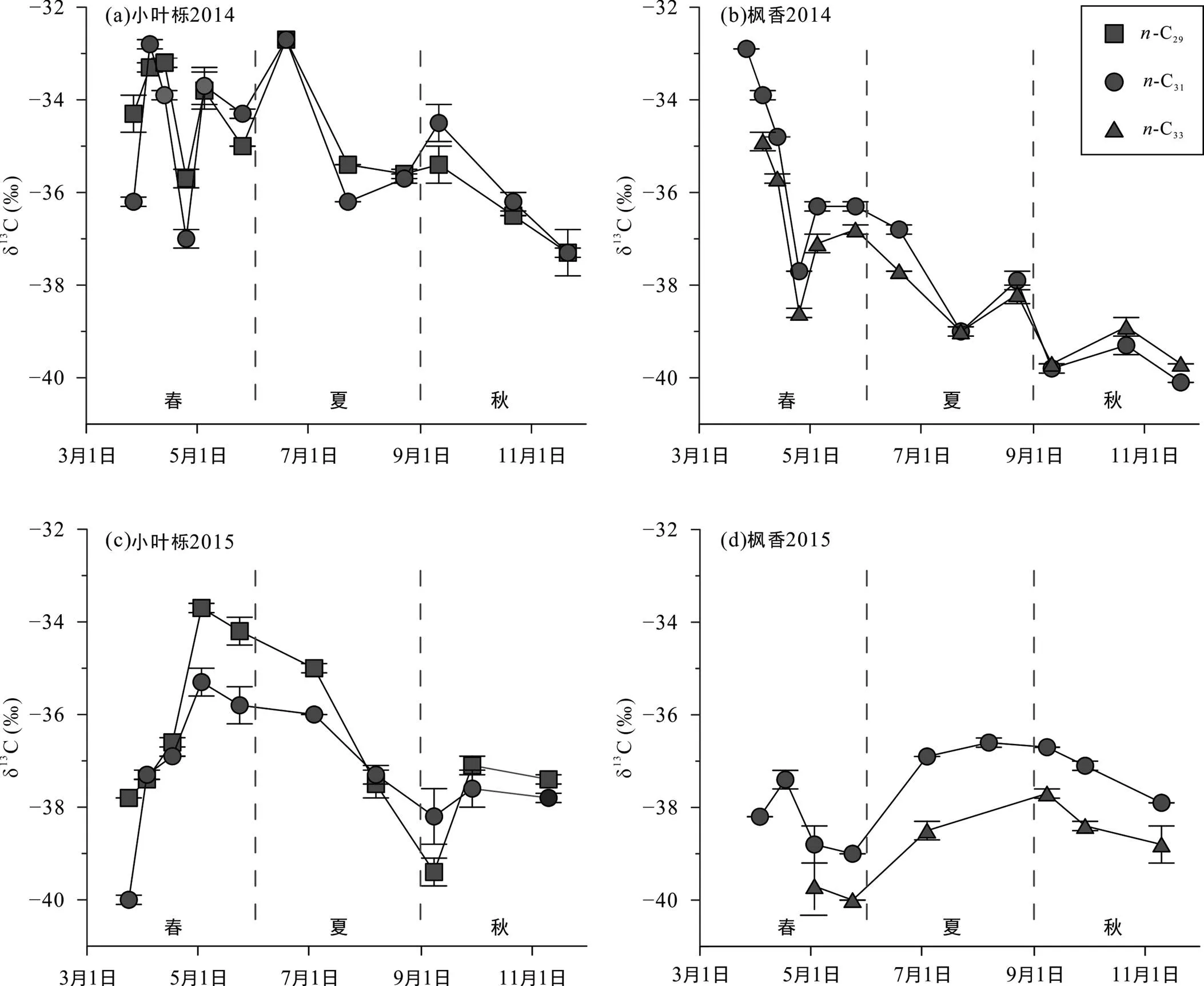
图4 2014~2015年小叶栎(a、c)和枫香(b、d)主要烷烃单体碳同位素值变化
3.2 表观分馏系数变化
在两年的监测期内, 两种植物δ13Calk的变化并不和δ13Cbulk变化完全同步, 这可以用叶蜡烷烃与叶片之间的碳同位素表观分馏系数(app)进行表征(图5)。在6月底之前, 两种植物的app值都表现出较大的波动幅度。从7月开始,app值相对稳定, 除了2014年枫香以外, 变化范围为−6‰ ~ −8‰。叶片在春季表现出较大的app波动幅度, 可能反映了叶片有机质与叶蜡烷烃合成时间的不同步性。本次研究的两种落叶植物叶蜡烷烃含量的变化表明, 叶蜡烷烃在春季被大量地合成, 在夏季成熟阶段也有少量地合成(Pedentchouk et al., 2008; Kahmen et al., 2011)。前人调查的温带地区落叶乔木也发现, 叶蜡烷烃主要是在生长初期被合成(Kahmen et al., 2011; Tipple and Pagani, 2013)。
值得注意的是, 本次调查的两种落叶乔木的叶蜡烷烃在成熟阶段的app值比之前报道的偏负。例如, Suh and Diefendorf (2008)调查的北美的落叶乔木成熟期app值是(−4.3±1.4)‰。Diefendorf and Freimuth (2017)集成的C3被子植物的平均app值是−5.2‰(C29烷烃), −5.6‰(C31烷烃)和−5.4‰(C33烷烃)。相对来讲, 南望山成熟阶段的app值处在集成数据的低值端。由于武汉所在亚热带地区并没有比其他地区更高的降雨量或相对湿度, 这种负偏的app值很可能和新合成烷烃在总烷烃中占比有关。在温带地区开展的研究普遍认为, 烷烃主要是在生长季初期合成(Kahmen et al., 2011; Tipple and Pagani, 2013)。在武汉这样的气候条件下, 初夏梅雨期的强降雨以及后续的盛夏伏旱都可以给植物叶片带来较大的环境压力, 使得植物新合成烷烃来抵抗环境的压力。在这个阶段, 植物的光合能力达到了最佳状态, 利用光合作用新合成的糖类, 可以造就相对负偏的app值。已经发表的南望山植物叶蜡烷烃单体氢同位素数据也支持上述认识, 支持新合成烷烃对成熟阶段叶蜡烷烃的重要贡献(Huang et al., 2018)。
3.3 年际和植物间差异
本次研究发现, 生长在非常相似环境的两种落叶乔木, 其叶蜡烷烃组成和δ13Calk值的季节性变化却表现出明显的差异性(图4)。枫香合成的叶蜡烷烃具有更大的ACL值, 以C31为主峰, 而小叶栎以C29为主峰(图2)。在δ13Calk值的季节性变化上, 小叶栎在叶片萌发后的较长一段时间内仍维持在相对偏正的阶段, 例如在2014年, 较大的δ13Calk值持续到6月底(图4)。与之不同的是, 枫香叶蜡烷烃δ13Calk值会在5月初开始快速下降。上述差异性可能和物种本身的生物学属性有关。两种植物分属于不同的科属, 前期研究已经发现了不同植物属种间叶蜡烷烃的差异性(Oakes and Hren, 2016; Zhao et al., 2018)。同时, 也可能和这两种落叶乔木的叶片结构有关(Freimuth et al., 2017; Suh and Diefendorf, 2018)。小叶栎的叶子属于披针形, 叶面积较小, 而枫香叶片阔卵形, 叶面积比小叶栎显著偏大。在2017年对成熟叶片的调查中, 小叶栎叶片平均面积是17.8 cm2, 而枫香叶片平均面积是68.8 cm2(均统计10片成熟叶片; Huang et al., 2018)。不同的叶片面积会影响叶蜡的单位产量, 进而和叶片的光合速率关联。当然, 这还无法解释为何两种植物的主峰碳有差别。值得关注的是, 在高等植物中, 随着碳链长度的增加, 其δ13Calk值通常表现出负偏的趋势(Smith et al., 2007; Zhao et al., 2018)。这也体现在本次研究中, 例如, 枫香C33烷烃的δ13Calk值比C31烷烃偏负。
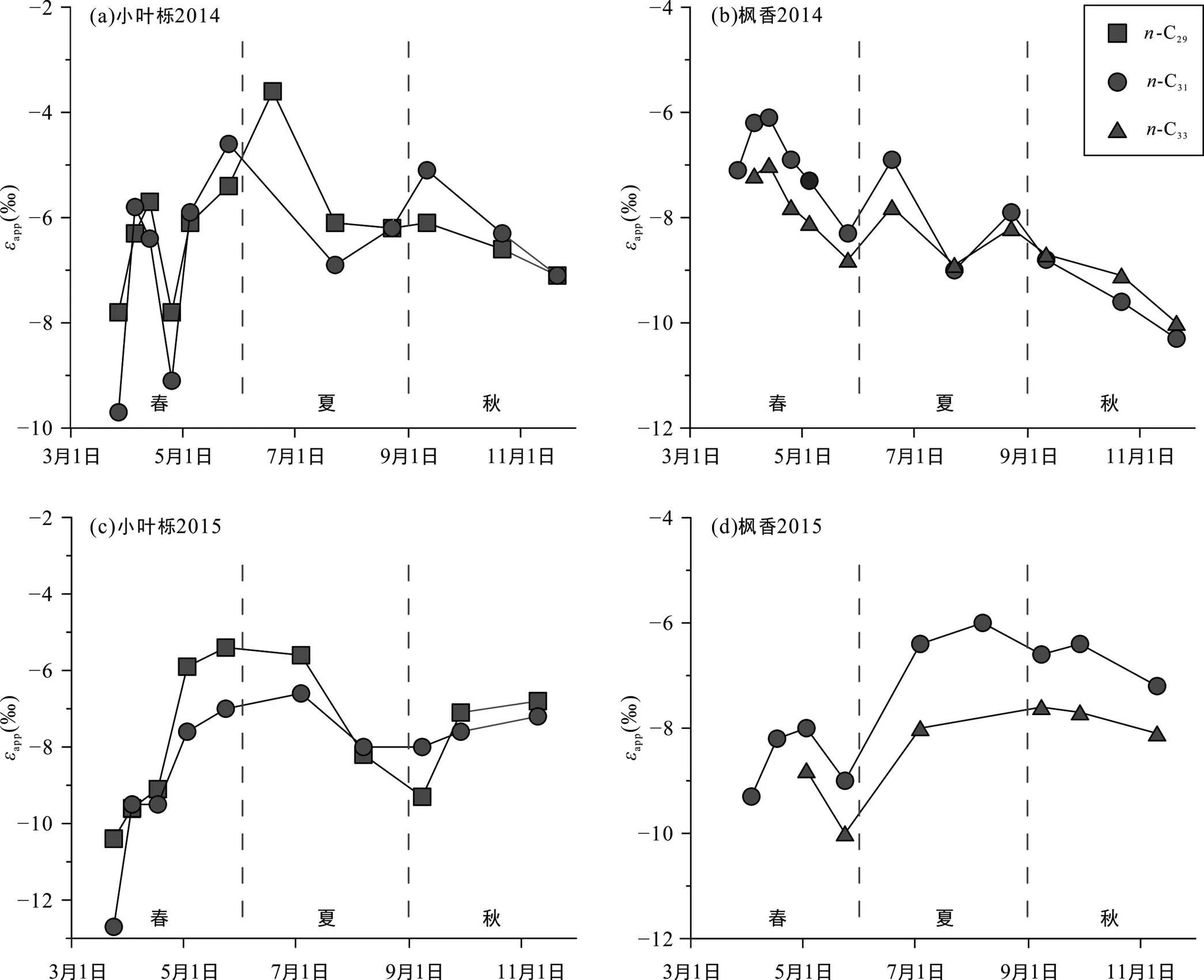
图5 2014~2015年小叶栎(a、c)和枫香(b、d)的主要烷烃碳同位素表观分馏系数(εapp)变化
小叶栎δ13Calk值在2014年和2015年间也表现出了差异性。2014年春季(3月至5月)的波动性比2015年同期更明显。到了生长季末期, 2014年的δ13Calk值在−36‰左右波动, 而2015年生长季末期的δ13Calk值基本维持在−38‰, 比2014年同期偏负。同小叶栎相比, 枫香在2014年和2015年间的差异性就更明显些。2014年, 枫香δ13Calk值整体呈下降趋势, 整个生长季的变化范围约为7‰。而在2015年, 枫香δ13Calk值先是处在较低值(<−38‰), 从6月初开始上升到了约−37‰(C31烷烃), 生长季末期的δ13Calk值略低于2014年同期。但总的来讲, 2015年枫香δ13Calk值的变化范围明显小于2014年。对同一批样品的叶蜡烷烃单体氢同位素(δ2Halk)调查也发现, 2015年两种植物的δ2Halk值都比2014年相对偏负。这种年间差异的原因并不清楚。2014年和2015年武汉市平均气温基本相同, 而2015年平均相对湿度(44%)低于2014年(56%)。2015年的大部分月份的平均湿度均低于2014年同期(Huang et al., 2018)。一般来讲, 相对干旱的环境下, 叶蜡烷烃δ13Calk值会相对偏正(Diefendorf and Freimuth, 2017), 是因为叶片为防止水分流失而关闭叶片上的气孔, 使得大气中的CO2进入叶片内部受到了阻碍, 影响了碳同位素的分馏系数(Farquhar et al., 1989; Sun et al., 2016; Wang et al., 2018)。但这种解释同实际情况是相反的。为了查明年间差异的原因, 还需要进行更长时间的观测, 并且需要结合温室控制生长条件实验, 定量地评估生物因素和环境因素的影响(Kahmen et al., 2011)。另外, 对比同一批样品的叶蜡烷烃单体碳、氢同位素发现, 在两个生长季, 两种同位素值之间的相关性不显著(图6)。这表明, 叶蜡烷烃单体碳、氢同位素组成除了受到相同因素(如相对湿度)的影响外, 各自还会受到其他因素的影响, 导致两种同位素信号间的关联较弱。在今后的研究中, 需要开展更长时间的观测, 进一步关注叶蜡烷烃单体碳、氢同位素之间的潜在关系和更多的植物类型, 将有潜力发掘更多的环境或生态信号(Feakins et al., 2018)。
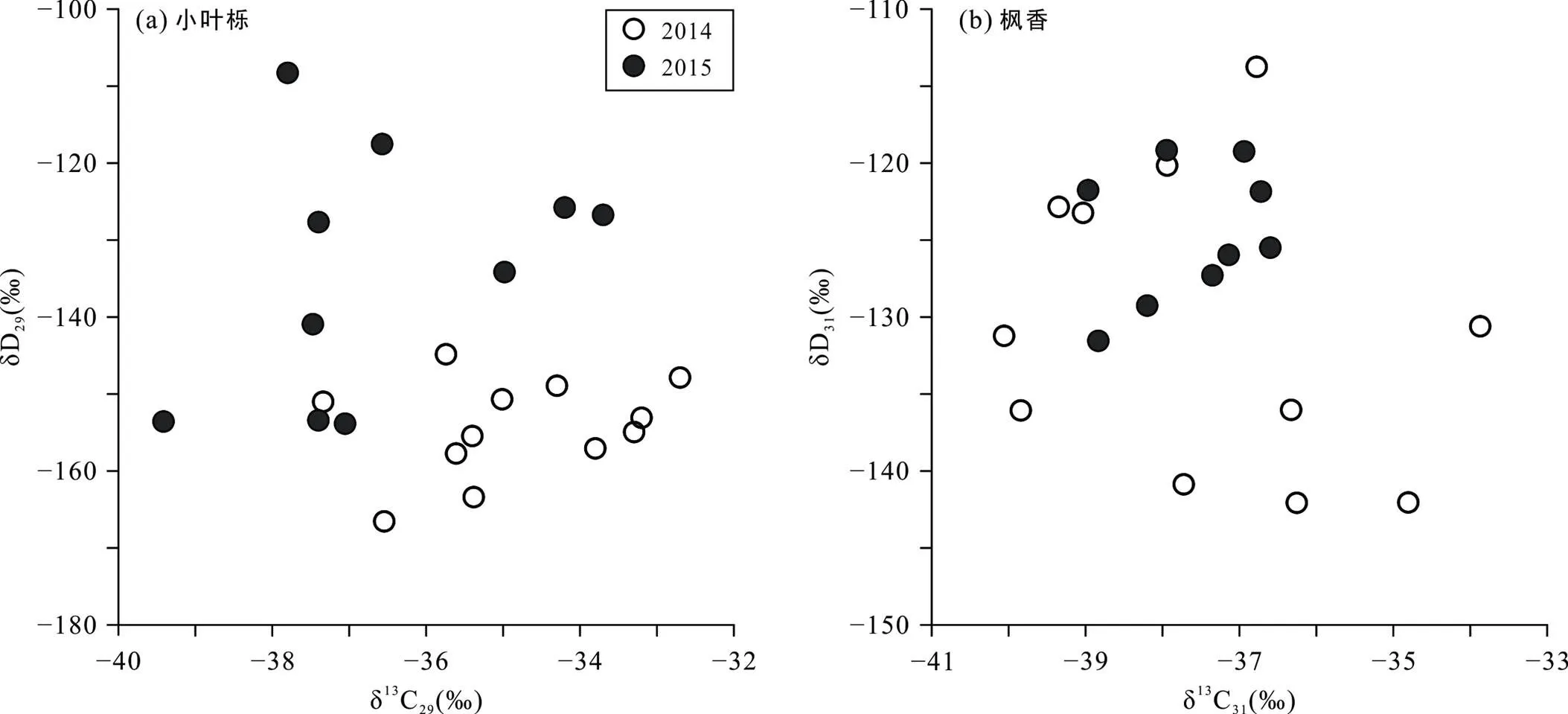
图6 2014~2015年小叶栎(a)和枫香(b)叶蜡烷烃主峰碳的碳同位素与氢同位素组成对比
4 结 论
本研究对武汉市南望山两种典型的亚热带落叶乔木(小叶栎、枫香)的叶蜡烷烃单体碳同位素组成开展了为期两年的季节变化监测。两种植物的总有机碳同位素值和单体碳同位素值具有相似的季节变化模式。叶片的碳同位素值春季偏正, 夏季偏负, 秋季小幅度偏负且较为稳定。生长初期的碳同位素值偏正与落叶乔木冬季储存富集13C的碳水化合物有关; 而夏季的同位素值偏负则是由于利用了新鲜的光合作用产物。在生长季末期, 两种落叶乔木叶蜡烷烃相对于叶片的碳同位素分馏系数为−6‰ ~ −8‰, 处于已报道的落叶乔木表观分馏系数的低值。结合前期同一批样品叶蜡烷烃单体氢同位素的研究结果, 这种偏负的表观分馏系数可能是因为生长季后期仍有少量的长链正构烷烃合成。本研究揭示了亚热带落叶乔木叶蜡烷烃单体碳同位素组成存在年份间、物种间的差异, 对短时间尺度环境条件的变化比较敏感, 因此在基于落叶乔木叶蜡烷烃单体碳同位素进行古环境重建时, 需要考虑碳同位素信号的季节性影响。同时, 需要延长监测时间, 对更多代表性乔木树种进行监测, 并结合温室条件下控制环境条件的实验, 进一步提升落叶乔木烷烃单体碳同位素信号的解译能力。
致谢:感谢中国科学院广州地球化学研究所贾国东研究员和另一位匿名审稿专家在一、二审过程中提出的建设性修改意见和建议。
丁一汇, 王绍武, 郑景云, 王会军, 杨修群. 2013. 中国气候. 北京: 科学出版社: 409–410.
刘畅, 廖伟森, 胡建芳, 付少英, 向荣, 李永祥. 2019. 南海北部东沙海区海洋氧同位素3期以来沉积有机碳记录及其古气候/环境信息. 地球化学, 48(5): 483–492.
刘丰豪, 胡建芳, 王伟铭, 童晓宁, 黄超, 廖伟森. 2018. 8.0 ka BP以来长江中下游南漪湖沉积记录的正构烷烃及其单体碳同位素组成特征和古气候意义. 地球化学, 47(1): 89–100.
中国气象局气候变化中心. 2020. 中国气候变化蓝皮书2020 . 北京: 科学出版社: 79–81.
Badeck F W, Tcherkez G, Nogués S, Piel C. 2005. Post-photosynthetic fractionation of stable carbon isotopes between plant organs — A widespread phenomenon., 19(11): 1381–1391.
Bush R T, Mcinerney F A. 2013. Leaf wax-alkane distributions in and across modern plants: Implications for paleoecology and chemotaxonomy., 117: 161–179.
Bush R T, Mcinerney F A. 2015. Influence of temperature and C4abundance on-alkane chain length distributionsacross the central USA., 79: 65–73.
Chikaraishi Y, Naraoka H. 2003. Compound-specific δD-δ13Canalyses of-alkanes extracted from terrestrial and aquatic plants., 63(3): 361–371.
Cooper J E, Bray E E. 1963. A postulated role of fatty acids in petroleum formation., 27(11): 1113–1127.
Cormier M A, Werner R A, Sauer P E, Gröcke D R, Leuenberger M C, Wieloch T, Schleuchr J, Kahmen A. 2018.2H-fractionations during the biosynthesis of carbohydrates and lipids imprint a metabolic signal on the δ2H values of plant organic compounds., 218(2): 479–491.
Diefendorf A F, Freimuth E J. 2017. Extracting the most from terrestrial plant-derived-alkyl lipids and their carbon isotopes from the sedimentary record: A review., 103: 1–21.
Eglinton G, Hamilton R J. 1967. Leaf epicuticular waxes., 156(3780): 1322–1335.
Farquhar G D, Ehleringer J R, Hubick K T. 1989. Carbon isotope discrimination and photosynthesis., 40: 503–537.
Feakins S J, Bentley L P, Salinas N, Shenkin A, Blonder B, Goldsmith G R, Ponton C, Arvin L J, Wu M S, Peters T, West A J, Martin R E, Enquist B J, Asner G P, Malhi Y. 2016. Plant leaf wax biomarkers capture gradients in hydrogen isotopes of precipitation from the Andes and Amazon., 182: 155–172.
Feakins S J, Sin Wu M, Ponton C, Galy V, Joshua West A. 2018. Dual isotope evidence for sedimentary integrationof plant wax biomarkers across an Andes-Amazon elevationtransect., 242: 63–81.
Ficken K, Li B, Swain D, Eglinton G. 2000. An-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes., 31(7–8): 745–749.
Freimuth E J, Diefendorf A F, Lowel T V. 2017. Hydrogen isotopes of-alkanes and-alkanoic acids as tracers of precipitation in a temperate forest and implications for paleorecords., 206: 166–183.
Gleixner G, Danier H J, Werner R A, Schmidt H L. 1993. Correlations between the13C content of primary and secondary plant products in different cell compartments and that in decomposing basidiomycetes., 102(4): 1287–1290.
Huang X Y, Zhao B Y, Wang K, Hu Y, Meyers P A. 2018. Seasonal variations of leaf wax-alkane molecular composition and δD values in two subtropical deciduoustree species: Results from a three-year monitoring program in central China., 118: 15–26.
Jia G D, Bai Y, Yang X Q, Xie L H, Wei G J, Ouyang T P, Chu G Q, Liu Z H, Peng P A. 2015. Biogeochemical evidence of Holocene East Asian summer and winter monsoon variability from a tropical maar lake in southern China., 111: 51–56.
Kahmen A, Dawson T E, Vieth A, Sachse D. 2011. Leaf wax-alkane δD values are determined early in the ontogeny ofleaves when grown under controlled environmental conditions., 34(10): 1639–1651.
Li R C, Meyers P A, Fan J, Xue J T. 2016. Monthly changes in chain length distributions and stable carbon isotope composition of leaf-alkanes during growth of the bambooand the grass., 101: 72–81.
Liu J A, An Z S. 2020. Leaf wax-alkane carbon isotope values vary among major terrestrial plant groups: Different responses to precipitation amount and temperature, and implications for paleoenvironmental reconstruction., 202, 103081.
Liu X W, Feakins S J, Dong X J, Xue Q W, Han J, Marek T, Leskovar D I, Neely C B, Ibrahim A M H. 2019. Evaluating leaf wax and bulk leaf carbon isotope surrogates for water use efficiency and grain yield in winter wheat., 59: 718–732.
Newberry S L, Kahmen A, Dennis P, Grant A. 2015.-Alkanebiosynthetic hydrogen isotope fractionation is not constant throughout the growing season in the riparian tree., 165: 75–85.
Oakes A M, Hren M T. 2016. Temporal variations in the δD of leaf-alkanes from four riparian plant species., 97: 122–130.
Pedentchouk N, Sumner W, Tipple B, Pagani M. 2008. δ13C and δD compositions of-alkanes from modern angiospermsand conifers: An experimental set up in central Washington State, USA., 39(8): 1066–1071.
Poynter J G, Farrimond P, Robinson N, Eglinton G. 1989. Aeolian-derived higher plant lipids in the marine sedimentary record: Links with palaeoclimate // Leinen M, Sarnthein M. Paleoclimatology and paleometeorology: Modern and past patterns of global atmospheric transport. The Netherlands: Springer, Kluwer Academic Publishers: 435–462.
Sachse D, Billault I, Bowen G J, Chikaraishi Y, Dawson T E, Feakins S J, Freeman K H, Magill C R, McInerney F A, Van der Meer M T J, Polissar P, Robins R J, Sachs J P, Schmidt H-L, Sessions A L, White J W C, West J B, Kahmen A. 2012. Molecular paleohydrology: Interpreting the hydrogen-isotopic composition of lipid biomarkers from photosynthesizing organisms., 40: 221–249.
Smith F A, Wing S L, Freeman K H. 2007. Magnitude of the carbon isotope excursion at the Paleocene-Eocene thermal maximum: The role of plant community change., 262(1–2): 50–65.
Suh Y J, Diefendorf A F. 2018. Seasonal and canopy height variation in-alkanes and their carbon isotopes in a temperate forest., 116: 23–34.
Sun Q, Xie M M, Lin Y, Shan Y B, Zhu Q Z, Xu D K, Su Y L, Rioual P, Chu G Q. 2016. An-alkane and carbon isotope record during the last deglaciation from annually laminated sediment in Lake Xiaolongwan, northeastern China., 56(2–3): 189–203.
Tipple B J, Ehleringer J R. 2018. Distinctions in heterotrophic and autotrophic-based metabolism as recorded in the hydrogen and carbon isotope ratios of normal alkanes., 187(4): 1053–1075.
Tipple B J, Pagani M. 2013. Environmental control on eastern broadleaf forest species’ leaf wax distributions and D/H ratios., 111: 64–77.
Vogado N O, Winter K, Ubierna N, Farquhar G D, Cernusak L A. 2020. Directional change in leaf dry matter δ13C during leaf development is widespread in C3plants., 126: 981–990.
Wang J, Xu Y P, Zhou L P, Shi M R, Axia E, Jia Y F, Chen Z X, Li J Z, Wang G A. 2018. Disentangling temperature effects on leaf wax-alkane traits and carbon isotopic composition from phylogeny and precipitation., 126: 13–22.
Zhao B Y, Zhang Y M, Huang X Y, Qiu R Y, Zhang Z Q, Meyers P A. 2018. Comparison ofalkane molecular, carbon and hydrogen isotope compositions of different types of plants in the Dajiuhu peatland, central China., 124: 1–11.
Seasonal variations in the carbon isotope compositions of leaf wax-alkanes in two subtropical deciduous tree species
YANG Ting1, YAN Chaoyang1, HUANG Xianyu1, 2*
(1. Hubei Provincial Key Laboratory of Critical Zone Evolution, School of Geography and Information Engineering, China University of Geosciences, Wuhan 430078, Hubei, China; 2. State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences, Wuhan 430078, Hubei, China)
Carbon isotope compositions of leaf wax-alkanes (δ13Calk) have been essential tools for paleoclimate and paleoecological reconstructions. Research of modern processes has the potential to improve the interpretation of leaf wax-alkanes in geological archives. However, the understanding of seasonal variations of δ13Calkin subtropical deciduous species remains limited. Therefore, we investigated the seasonal variations in the carbon isotope compositions of two typical subtropical deciduous trees (,) over two years. During the spring, the δ13Calkvalues in the two tree species were relatively positive, then turned negative, and finally showed near-constant in the fall. Such a seasonal pattern possibly relates to the utilization of stored carbohydrates at the initial stage of leaf development and the use of newly synthesized sugars in the later stages. At the end of the growing season, the apparent fractionation of carbon isotopes between the bulk leaves and-alkanes ranged from −6‰ to −8‰, which may be due to the secondary synthesis of long chain-alkanes in small amounts at the end of the growth period. These results suggest that the seasonality of environmental factors may affect the δ13Calksignals of deciduous trees preserved in geological archives.
deciduous trees; leaf wax-alkanes; compound-specific carbon isotope; apparent fractionation; seasonal variations
P593
A
0379-1726(2022)02-0213-10
10.19700/j.0379-1726.2022.02.005
2020-09-02;
2020-10-25
国家自然科学基金项目(41807435)资助。
杨婷(1995–), 女, 硕士研究生, 地理学专业。E-mail: tyang622@163.com
黄咸雨(1981–), 男, 教授, 主要从事泥炭地分子地球生物学研究。E-mail: xyhuang@cug.edu.cn
