定量蛋白质组学分析SDF2L1过表达后鼻咽癌细胞中的差异蛋白*
2022-04-28罗承长苏琪盛黎小红莫武宁
罗承长,苏琪盛,黎小红,杨 峥,莫武宁
(广西医科大学第一附属医院检验科,南宁 530021)
鼻咽癌(NPC)是最常见的头颈部恶性肿瘤之一[1]。在全球范围内,每年确诊的NPC患者约有8.7万例[2]。中国是NPC发病率和病死率较高的国家之一[3]。由于NPC发病部位隐匿,早期症状不明显,超过50%的患者就诊时已处于中晚期,预后较差[4]。因此,寻找有效基因靶点对NPC的临床诊断及治疗具有重要意义。研究发现,基质细胞衍生因子2样1(SDF2L1)在胰腺癌、乳腺癌和卵巢癌中发挥重要作用[5-7]。本课题组前期研究显示,SDF2L1在NPC细胞中呈低表达,且与肿瘤细胞增殖、侵袭和迁移密切相关[8]。然而,SDF2L1在NPC中的具体调控机制尚不清楚。本研究采用非标记蛋白质定量(LFQ)分析技术结合生物信息学方法预测受SDF2L1调控的下游关键基因,探究SDF2L1在影响NPC细胞生物学功能的潜在机制,为进一步认识NPC的发生发展机制、研发新治疗靶点提供新思路。
1 材料与方法
1.1细胞和主要试剂 本课题组前期已经在5-8F细胞系的基础上成功构建稳定过表达SDF2L1的NPC细胞系(5-8Fg)和空载细胞系(5-8F1)[8]。胎牛血清(FBS)、DMEM培养基(美国Gibco);磷酸盐缓冲液(PBS)和青—链霉素混合液(大连美仑生物);尿素、二硫苏糖醇(DTT)、羧基氨基甲烷(Tris)、碘乙酰胺(IAA)、甲酸(美国Sigma);SDS和RNA引物(上海生工);胰蛋白酶(北京华利世);质谱级乙腈、荧光抗体(美国Thermo);BCA蛋白检测试剂盒、蛋白酶抑制剂(南京碧云天);Trizol试剂(日本TaKa-Ra);All-In-One 5X RT Master Mix和EvaGreen 2X qPCR Master Mix试剂盒(美国Applied Biological Materials);核糖体蛋白L14(RPL14)抗体、GAPDH抗体(英国Abcam)。
1.2细胞培养 用含10%FBS和1%青—链霉素的DMEM培养基培养5-8Fg和5-8F1细胞,置于37℃、5%CO2的细胞培养箱中培养,每24 h更换1次培养液,取对数生长期细胞进行后续实验。
1.3蛋白的提取 待细胞长至90%汇合后使用适量PBS缓冲液清洗,加入0.5 mL SDS裂解液裂解,收集至EP管中。在3个不同时期分别收集生长良好的5-8Fg和5-8F1细胞各3个样品以达到重复3次试验的目的。分别向同一时期5-8Fg和5-8F1样品中加入0.5 mL Lysis缓冲液[8 mol/L尿素+100 mmol/L Tris-HCl(pH=7.6)+蛋白酶抑制剂],冰浴超声15 min,12 000 r/min离心15 min,取上清,使用BCA法进行定量。每个样品分别取20μg混合pool用于建库。
1.4蛋白质酶切 取蛋白样品100μg,每组蛋白样品按适当的体积比加入DTT使其终浓度为0.05 mol/L,56℃孵育40 min,用8倍体积的尿素缓冲液对样品进行稀释;在超滤管中加入稀释后的蛋白样品,离心;加入200μL尿素缓冲液,离心;加入100μL含50 mmol/L IAA的尿素缓冲液,避光孵育20 min,离心;加入100μL尿素缓冲液,混匀,离心10 min,重复该步骤两次;加入100μL 50 mmol/L ABC,离心,重复该步骤两次;加入80μL含有50 mmol/L胰酶的ABC(胰酶与蛋白比例为1∶50~1∶100),振荡1 min;将超滤管放入37℃的水浴锅酶解16~18 h,转移到新的收集管中,离心,收集;再在超滤管中加入50μL ABC,离心,收集。用nano-drop蛋白浓度检测模式进行测定。
1.5液相色谱—串联质谱 将所有样品依次进行LC-MS/MS检测。样品经LC系统进样,色谱柱分离,从LC流出的被分离组分通过接口进入离子源,组分经过离子化后,第一级质量分析器会根据质荷比将组分分离,最后串联进入第二级质量分析器进行二级质谱分析,获得质谱原始数据。
1.6质谱结果定量分析将LC-MS/MS原始文件导入MaxQuant软件1.5.2.8进行查库,根据搜索引擎-Andromeda进行LFQ分析。MaxQuant软件根据每次分析中每个肽段的同位素峰整合LFQ算法,利用所有分析中共有肽段比率的中值来计算蛋白比率,将得出的结果与uniprot数据库进行对比,利用反库来计算每个肽段和蛋白质的假阳性率(FDR)。应用meta X软件作定量值归一化,缺失值补全,蛋白定量值计算和统计检验分析,最终按照|差异倍数(FC)|≥1.5且P<0.05筛选DEPs。
1.7蛋白相互作用(PPI)网络构建 通过STRING数据库(https://string-db.org/)构建PPI,并由Cytoscape软件3.7.2进行可视化。
1.8差异蛋白的功能富集分析 应用R软件中的“clusterProfiler”包对DEPs进行GO功能注释及KEGG信号通路富集分析,调整P<0.05视为显著富集。
1.9受SDF2L1调控的关键蛋白质的筛选 通过Cytoscape软件中的MCODE及Cytohubba插件筛选受SDF2L1调控的关键基因。这两种方法获得的交叉基因被认为是关键基因。Cytohubba是根据节点的中心度来筛选基因,包括点度中心性(Degree)及接近中心性(Closeness)。
1.10受SDF2L1调控的关键蛋白质的验证Oncomine数据库(https://www.oncomine.org/)囊括了31例NPC患者及10例正常人的基因表达情况。关键表达蛋白质验证标准为|FC|≥1.2、P<0.05且处于差异蛋白的前15%。
1.11实时荧光定量PCR(RT-qPCR)法检测RPL14基因表达用Trizol试剂从组织和细胞中提取总RNA,使用All-In-One 5X RT MasterMix合成cDNA,按照EvaGreen 2X qPCR Master Mix试剂盒说明书进行PCR扩增。引物序列如下:RPL14上游:5’-TTAAGAGCTTCAA-AGGCAGC-3’,下游:5’-TTTTGACCCTTCTGAGCTTTG-3’;GAPDH上游:5’-TGGGTGGACCATGAAG-3’,下游:5’-GTGTCGCTGTTGAAGTCAGA-3’。用2-△△CT法计算RPL14基因相对表达量。
1.12 Western blotting法检测RPL14蛋白表达
使用90%RIPA裂解缓冲液和10%蛋白酶抑制剂的混合物提取蛋白,SDS-PAGE凝胶电泳分离蛋白(120 V、1 h),将蛋白转移到PVDF膜(150 mA、90 min);加入一抗RPL14(1∶700)、GAPDH(1∶1 400)4℃下孵育过夜,洗膜;加入荧光二抗(1∶10 000)室温下孵育1 h,洗膜后用Odyssey红外荧光扫描成像系统进行扫膜。采用Image J软件分析蛋白条带灰度值。以RPL14蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值作为RPL14蛋白相对表达量。
1.13统计学方法用SPSS 24.0统计软件和R 3.6.3软件进行数据分析。计量资料以均数±标准差()表示,两组间比较采用Student-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 DEPs的鉴定结果 通过LFQ和串联质谱分析,共鉴定出4 969个DEPs,见表1。

表1 蛋白鉴定统计表
2.2差异表达蛋白(DEPs)的定量筛选 根据|FC|≥1.5和P<0.05,共定量出730个DEPs,其中表达下调的有434个,表达上调的有296个。DEPs绘制的火山图和热图如图1所示。

图1 蛋白质质谱的定量分析结果
2.3 GO和KEGG富集分析GO富集分析到112条细胞组分(CC)、20条分子功能(MF)和225条生物学过程(BP)。DEPs主要定位于核糖体和胞质,发挥核糖体构成、黏附蛋白结合等分子功能,参与内质网蛋白靶向、病毒转录及基因表达、蛋白质内质网的定位等生物学过程,见图2A~C。KEGG富集分析显示,DEPs显著富集于内质网蛋白加工、核糖体构成、氨基酸生物合成及内吞作用等22条信号通路,见图2D。

图2 DEPs显著富集的前30个GO条目和前10个KEGG信号通路
2.4关键DEPs的筛选将STRING网站构建的PPI导入Cytoscape软件中进行可视化分析。通过Cytohubba插件中的接近中心性得到Closeness的值,根据点度中心性得到蛋白质的Degree值,分数最高的前50个蛋白质视为关键蛋白质。此外,通过MCODE插件得到不同的子网络,其中模块1得分最高。因此,模块1内的53个蛋白质视为关键蛋白质(图3A)。最后,真正的关键蛋白质认定为Cytohubba和MCODE插件获得的31个交叉蛋白质(图3B)。

图3 差异蛋白相互作用网络的构建和关键DEPs的筛选
2.5关键DEPs的验证 通过Oncomine数据库对筛选出的31个关键DEPs进行验证,最终得到受SDF2L1调控并且在NPC细胞中显著上调的蛋白有RPL6、RPS15A、SEC61A1、RPL24、RPL37A,显著下调的蛋白为RPL14,见表2。
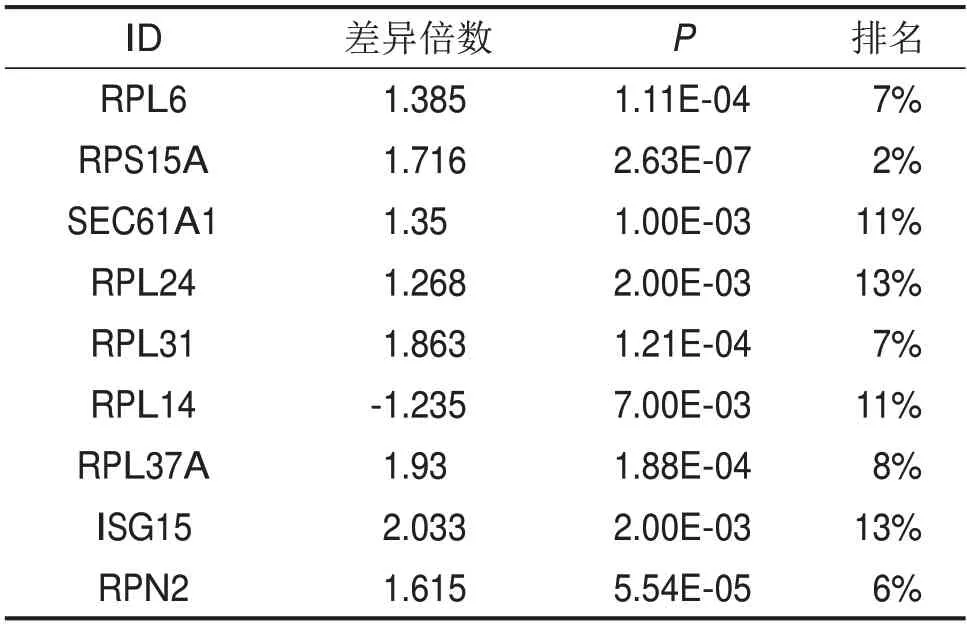
表2 SDF2L1下游关键调控蛋白在Oncomine数据库的验证
2.6 RPL14作为SDF2L1下游关键调控蛋白的验证RT-qPCR和Western blotting结果显示:5-8Fg细胞中RPL14 mRNA和蛋白表达量均低于5-8F1细胞,见图4。

图4 RPL14在NPC细胞中的表达
3 讨论
SDF2L1是一个潜在的抑癌因子,与肿瘤的发生发展有着密切联系[9]。Willis等[5]通过meta分析发现,卵巢浆液性癌患者SDF2L1低表达与不良预后相关。同样地,Kang等[6]发现,SDF2L1在乳腺癌中亦呈低表达,其表达量与患者肿瘤恶化及预后呈正比。张靖承[7]发现,SDF2L1在胰腺癌细胞与正常细胞中的表达呈现差异性,当敲低SDF2L1时,胰腺癌细胞增殖受到抑制,且癌细胞对化疗药物(吉西他滨)的敏感性提高,提示SDF2L1是一种潜在的胰腺癌化疗耐药治疗靶点。研究表明,在NPC组织和细胞中,SDF2L1显著表达下调;当SDF2L1表达沉默时可以促进NPC的增殖、迁移和体外侵袭,而过表达SDF2L1则起到相反作用[8]。蛋白质组学分析在发现癌症关键基因,了解癌症发展机制及癌症预防、诊断和治疗中具有重要的临床意义[10]。为了深入了解SDF2L1在NPC中的作用,本组首次运用LFQ技术在NPC细胞中鉴定了受SDF2L1调控的下游关键蛋白质,共得到730个DEPs。GO和KEGG富集分析揭示DEPs主要发挥核糖体构成、细胞黏附中的钙粘蛋白结合等分子功能,参与了病毒转录、翻译、细胞黏附等生物学过程,同时还涉及内质网蛋白加工、核糖体、RNA运输等信号通路。结合多种生物信息学分析得到9个受SDF2L1调控的下游蛋白,分别为RPL6、RPS15A、SEC61A1、RPL24、RPL37A、RPL31、ISG15、RPN2和RPL14,其中只有RPL14下调。蛋白组学的结果提示,核糖体蛋白质在NPC的发生发展机制中可能扮演重要的角色,SDF2L1可能在核糖体调控DNA的修复和凋亡中发挥重要作用。
核糖体蛋白在肿瘤的早期诊断、远处转移和预后监测等方面具有重要作用[11-12]。RPL14基因是核糖体蛋白L14E家族的成员,有一个高度多态的三核苷酸重复序列,在丙氨酸残基延伸中发挥重要作用[13]。研究发现,RPL14在多种癌症(包括肺癌、口腔鳞状细胞癌、肝细胞癌、食管鳞状细胞癌、结直肠癌、恶性卵巢生殖细胞瘤等)中作为抑癌因子存在[14-17]。一项荟萃分析发现,RPL14下调与乳腺癌患者不良预后有关,并且在临床患者组织中验证了RPL14的差异性表达[18]。此外,RPL14能促进宫颈癌细胞的迁移、侵袭和上皮—间充质转化[19]。同时,Sun等[20]体内、外实验显示,下调RPL14的表达可以解除miR-129-5p对宫颈癌的促进作用,提示RPL14在癌症中作为促癌因子存在。以上文献表明,RPL14在不同的癌症中可能扮演着不同角色。本研究结果显示,RPL14在SDF2L1过表达的NPC细胞中表达下调,结果与蛋白组学一致,这提示SDF2L1可能通过下调RPL14的表达,从而抑制NPC的进展,在NPC中RPL14可能发挥促癌作用。
综上所述,通过非标记定量蛋白质组学LFQ和生物信息学分析,共获得RPL6、RPS15A、SEC61A1、RPL14、RPL31、RPL37A、ISG15等9个受SDF2L1调控的关键下游蛋白,均可能在NPC的发生发展中发挥重要作用。SDF2L1可能通过抑制RPL14表达影响NPC细胞的生物学行为,但确切的分子机制仍需深入研究。下一步本组将以RPL14为靶点进行蛋白交互作用实验,进一步探索NPC中受RPL14直接调控的下游基因,为今后阐明NPC的发病机制提供更为直接的实验依据。
