羧基化聚酰胺—胺/无定形磷酸钙改善牙本质粘接的实验研究*
2022-04-28黄婧娴杨婧谢红宇严凯琦谢方方
黄婧娴,杨婧,谢红宇,严凯琦,谢方方△
(1.广西医科大学附属口腔医院牙体牙髓科,广西口腔颌面修复与重建研究重点实验室,广西颌面外科疾病诊治研究重点实验室,广西颅颌面畸形临床医学研究中心,南宁 530021;2.广西医科大学第四附属医院口腔科,柳州 545005)
龋病是人类最常见的口腔疾病,树脂粘接修复是其主要治疗手段。随着树脂粘接材料研究的深入,树脂牙本质粘接修复技术得到了飞跃发展,在粘接强度及耐久性都有显著的进步。然而,树脂牙本质粘接耐久性的改善仍是树脂粘接技术的一个难点。受树脂单体溶解度的限制,树脂单体不足以完全替换胶原微分子间的水分子,使得混合层底部存在部分暴露的胶原纤维,这些胶原纤维易被外源性细菌和内源性胶原酶降解形成粘接界面缺陷,造成粘接耐久性下降[1]。
近年来,牙本质胶原纤维仿生矿化为改善粘接界面缺陷提供了新的思路。羟基磷灰石(hydroxyapatite,HAP)是矿化胶原纤维的主要成分,仿生矿化是通过人工方法诱导HAP在脱矿胶原纤维内有序沉积。其无定形相的矿化前驱体无定形磷酸钙纳米粒子(amorphous calcium phosphate,ACP)具有重要的生物矿化调控作用,可在胶原纤维内部通过一系列分子水平的自组装,形成有序的胶原纤维内矿化[2]。自然状态下,ACP热力学极不稳定,很容易自发形成大尺寸HAP而无法进入胶原纤维内部,通过加入一些有机物或无机物添加剂可使其稳定存在[3]。根据已有研究报道,羧基化的聚酰胺—胺(carboxylated polyamidoamine,PAMAM—COOH)具有维持ACP小尺寸的能力,能诱导与牙本质相似的矿物质产生[4]。本课题组前期实验中首次合成了PAMAM—COOH/ACP纳米复合体,使用PAMAM—COOH/ACP纳米复合体再矿化完全脱矿的胶原纤维,观察到胶原纤维大部分横截面均可见高密度晶体,胶原纤维周围可见致密、连续的晶体形成,证实PAMAM—COOH/ACP纳米复合体具有诱导牙本质胶原纤维仿生矿化的能力[5]。在此基础上,本实验以自酸蚀粘接剂作为载体,探讨并评价PAMAM—COOH/ACP纳米复合体通过仿生矿化树脂—牙本质粘接界面中裸露的胶原纤维来改善粘接性能的能力,观察加入PAMAM—COOH/ACP纳米复合体后自酸蚀粘接剂粘接的树脂—牙本质粘接界面的剪切粘接强度及断裂后的粘接界面,初步探讨PAMAM—COOH/ACP纳米复合体仿生矿化技术应用于树脂—牙本质粘接缺陷改善的可行性,为其临床应用转化提供实验依据。
1 材料与方法
1.1牙齿 征得患者知情同意并签署知情同意书后,收集广西医科大学附属口腔医院口腔颌面外科新鲜完整拔除的前磨牙第三磨牙,并储存于4℃的0.1%麝香草酚溶液中,离体后的牙齿1个月内使用完毕。病例纳入标准:(1)前磨牙或第三磨牙;(2)无龋坏、无白斑,未行充填治疗或根管治疗;(3)无裂纹,牙冠完整。本研究经广西医科大学附属口腔医院伦理委员会审核并批准。
1.2实验材料和仪器 氯化钙(CaCl2)、磷酸氢二钠(Na2HPO4)、氢氧化钠(NaOH)、无水乙醇(生工生物,中国);PAMAM—COOH(Sigma,美国);人工唾液(源叶生物,中国);光固化复合树脂(3M,美国);一步法自酸蚀粘接剂幻彩-Bond(GC,日本)。恒温磁力搅拌器(新瑞,中国);多功能台式高速冷冻离心机(Eppendorf Centrifuge,德国);电热真空干燥箱(工兴,中国);电动打磨切割系统(Robert Bosch,德国);金相试样抛光机(精博,中国);大功率超声设备(新芝,中国);光固化灯(啄木鸟,中国);电脑控制万能力学试验机(威邦,中国);超景深三维显微系统(KEYENCE,日本)。
1.3 ACP的制备方法 采用溶液共沉淀法制备ACP[6]。首先制备10 mmol/L的CaCl2溶液与6 mmol/L的Na2HPO4溶液,分别用1 mmol/L的NaOH调定pH=10.00±0.05,制得的CaCl2溶液与Na2HPO4溶液按1∶1体积比快速混合,室温下搅拌反应1 min,将反应液分装在带有过滤膜的离心管中离心5 min(10 000 r/min,4℃),产物经无水乙醇洗涤后,再次离心5 min(10 000 r/min,4℃),无水乙醇洗涤离心步骤重复两次。洗涤后产物置于真空干燥箱中,37℃干燥4 h,最终可得白色粉末状ACP,于室温下干燥保存并于60 d内使用[7]。
1.4 PAMAM—COOH/ACP纳米复合体的制备方法 采用溶液共沉淀法合成PAMAM—COOH/ACP纳米复合体[6]。首先将CaCl2和PAMAM—COOH依次溶于去离子水中制备相对分子质量浓度比值为16∶1的10 mmol/L的CaCl2溶液,与6 mmol/L的Na2HPO4溶液分别用1 mmol/L的NaOH调定pH=10.00±0.05,制得的CaCl2溶液与Na2HPO4溶液按1∶1体积比快速混合,室温下搅拌反应30 min,离心、洗涤、干燥步骤同ACP,最终可得淡黄色粉末状PAMAM—COOH/ACP纳米复合体,于室温下干燥保存并于60 d内使用[7]。产物通过傅立叶红外光谱、X射线衍射验证其是否为PAMAM—COOH/ACP纳米复合体[5]。
1.5样本制备及分组 将“1.1项”中收集到的离体牙,使用电动打磨切割系统在水冷却条件下垂直于牙体长轴磨除冠部釉质,至釉—牙本质下以完全暴露牙本质面,将试样的牙本质面倒置于硅胶模具中,加入环氧树脂包埋,脱模后制成仅暴露待粘接面的1.5 cm×1.5 cm×1.5 cm立方体牙本质试样共80个,在流水下冷却下用600目碳化硅砂纸打磨待粘接面15 s,制备统一牙本质粘接面。试样用超纯水充分漂洗5 min,反复3次,并用超声振荡清洗15 min。将试样随机分为4组(n=20):(1)空白对照组(A组):试样粘接面经抛光处理后,气枪轻吹,按照厂家说明,使用一步法自酸蚀光固化粘结剂处理10 s,强吹5 s,光固化灯照射10 s,复合树脂分层充填,每层2 mm,光固化20 s,堆成4 mm厚的树脂冠;(2)ACP组(B组):试样处理完全同上,但粘接剂中加入0.3%质量分数的ACP;(3)PAMAM—COOH组(C组):试样处理完全同上,但粘接剂中加0.3%质量分数的PAMAM—COOH;(4)PAMAM—COOH/ACP组(D组):试样处理完全同上,但粘接剂中加入0.3%质量分数的PAMAM—COOH/ACP纳米复合体。
1.6剪切强度测试 将各组制好的离体牙—树脂粘接样本浸泡在人工唾液中,每24 h更换1次人工唾液,37℃恒温孵育3个月后取出。剪切强度通过电脑控制万能力学试验机测试,以MPa为单位。
1.7扫描电镜观察与断裂模式分析 所有样本测试完成后,使用SEM对牙本质断端进行观察。在超景深三维显微系统(50倍)下评估断裂模式。断裂类型有3种:(1)黏附破坏:包括断裂在粘结剂与牙本质之间和断裂在粘结剂与树脂之间;(2)内聚破坏:包括牙本质内聚断裂和复合树脂内断裂;(3)混合破坏:黏附破坏和内聚破坏均发生。
1.8统计学方法 本文数据采用SPSS 20.0统计软件进行分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1剪切强度测试结果PAMAM—COOH组和PAMAM—COOH/ACP组的剪切强度均高于空白对照组(P<0.05),但ACP组、PAMAM—COOH组、PAMAM—COOH/ACP组的剪切强度两两之间比较差异无统计学意义(P>0.05),见表1。
表1 各组粘接剂的剪切粘接强度结果

表1 各组粘接剂的剪切粘接强度结果
与空白对照组比较,△P<0.05。
2.2断裂模式分析 空白对照组、ACP组、PAMAM—COOH组、PAMAM—COOH/ACP组的断裂模式均以黏附破坏为主,除空白对照组外,其余各组均发生少量内聚破坏或混合破坏,见表2。

表2 各组牙本质粘接界面断裂类型对比
2.3 SEM观察结果 经人工唾液仿生矿化3个月,各组试件剪切强度测试后断裂面在SEM下观察(图1),空白对照组除牙本质小管内可见树脂残留外,管内和管周均未见明显矿化产物生成(A1、A2)。ACP组牙本质小管内及管周可见少量新生成矿化物,牙本质小管周围沉积矿化物不连续,高倍镜下观察到矿化产物与牙本质小管连接疏松,牙本质小管管径未见明显改变(B1、B2)。PAMAM—COOH组牙本质小管内与管周均可见新生成矿化产物,牙本质小管周围可见大块连续的矿化物沉积,高倍镜下观察到新生成矿物深入牙本质小管内侧壁,并可观察到部分小管管径减小(C1、C2)。PAMAM—COOH/ACP组牙本质小管内部及管周可见明显新生矿化产物生成,有连续的矿物沉积在牙本质小管周围,高倍镜下观察到大量新生矿物沿小管内部紧密排列,并可观察到牙本质小管管径呈不同程度的缩小(D1、D2)。
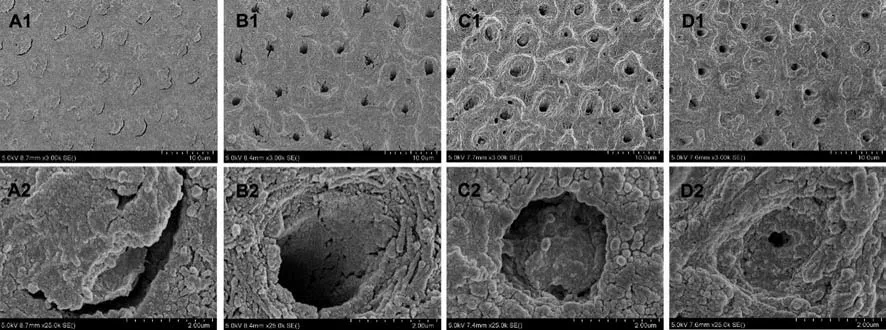
图1 剪切强度测试后各组断端SEM观察结果
3 讨论
树脂充填修复是目前临床上最主要的龋病治疗方法。牙本质粘接界面缺陷会导致继发龋的产生,影响树脂—牙本质粘接耐久性,最终造成树脂粘接失败[8]。据统计,美国因龋病修复失败而进行二次修复的费用占龋病治疗费用的50%~70%[9]。因此,牙本质粘接界面缺陷的改善具有十分重要的意义。研究表明,只有矿化的胶原纤维可以长时间保留,甚至可维持数万年稳定不变[10]。Tay等[11]提出了引导组织再矿化这一种由粒子介导的仿生再矿化模式。Huang等[12]将引导组织再矿化技术应用于自酸蚀树脂—牙本质粘接界面中,发现再矿化主要集中在胶原纤维内可具有更好的树脂粘接效果。因此,调控HAP在胶原纤维内有序沉积是改善树脂—牙本质粘接界面缺陷的关键。本课题组前期实验证实PAMAM—COOH/ACP纳米复合体尺寸为(22.03±3.85)nm,小于胶原纤维内间隙(40 nm),符合诱导形成胶原纤维内矿化的基本要求,且经壳聚糖选择性脱除胶原纤维外矿物后新矿物的形貌和密度几乎没有变化,证实PAMAM—COOH/ACP纳米复合体具有诱导胶原纤维形成纤维内矿化的能力[5]。因此本研究将PAMAM—COOH/ACP纳米复合体加入自酸蚀粘接剂中,探讨其对树脂—牙本质粘接性能的影响。
本实验结果显示,经人工唾液孵化3个月后,加入PAMAM—COOH/ACP纳米复合体的自酸蚀粘接剂,其剪切强度高于空白对照组,证实了纳米复合体加入可增强树脂—牙本质粘接强度。PAMAM—COOH组的剪切强度也高于空白对照组,且与PAMAM—COOH/ACP组无明显差异。分析原因为人工唾液中含有的游离钙、磷离子,可被PAMAM—COOH吸附,为HAP在胶原纤维上的沉积提供成核位点和矿化模板。本课题组前期研究已证实,PAMAM—COOH在矿化环境中能诱导牙本质再矿化[13]。SEM下也观察到小管内矿物的伸入及管周矿物的生成。
然而,PAMAM—COOH可快速进入胶原纤维内部并与位点结合,而大多数ACP由于失去稳定性而在胶原纤维外成核,从而导致纤维内矿化不良[14]。本实验SEM下见PAMAM—COOH组管周多有大块的矿物沉积,证实产物多为大尺寸矿物。PAMAM—COOH/ACP纳米复合体通过稳定ACP,更好地诱导纤维内矿化,以此改善牙本质粘接性能。SEM结果也证实,经人工唾液处理3个月后,与PAMAM—COOH组相比,PAMAM—COOH/ACP组形成的矿化产物与牙本质结合更加紧密,是更为理想的改善树脂—牙本质长期耐久性的添加剂。
综上,将PAMAM—COOH/ACP纳米复合体加入到自酸蚀粘接剂中改善树脂—牙本质粘接性能具有可行性。本研究将人离体牙放置于人工唾液中进行评估,是常用的体外实验方法,然而,人体口腔情况较为复杂,体外实验并不能完全模拟口腔环境,存在局限性。PAMAM—COOH/ACP纳米复合体与牙本质的结合机制及其对树脂—牙本质长期粘接效果的影响仍未明确,在其转化为临床应用前,还需要进一步研究。
