慢性阻塞性肺疾病急性加重期大鼠血清中性粒细胞弹性蛋白酶与肺功能的相关性分析*
2022-04-28兰静徐劲松阮春花夏国际
兰静,徐劲松,阮春花,夏国际
(江西省中国人民解放军联勤保障部队第908医院,南昌 330000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种破坏性肺部疾病,患病率及致死率均处于较高水平,其已成为严重的公共卫生问题[1]。COPD进入急性加重期可导致患者病情加重,肺功能随之减弱,严重者甚至发生呼吸衰竭,危及生命[2]。因此,预防COPD急性加重期(acute exacerbation of COPD,AECOPD)发生是目前治疗COPD的重要目标。有报道表明,COPD气道黏液高分泌可引发患者管腔狭窄,这种病理变化与1 s用力呼吸容积(forced expiratory volume in one second,FEV1)及FEV1/用力肺活量(forced vital capacity,FVC)具有相关性,其可贯穿于COPD始终,尤以急性发作期最为明显[3-4]。血清中性粒细胞弹性蛋白酶(neutrophil elastase,NE)参与COPD气道黏液高分泌发生发展过程,其可导致肺组织结构受损并降解表面活性物质,亦可在多途径介导下诱导黏蛋白产生[5-6]。研究证实,NE在刺激黏液产生及分泌中发挥重要作用[1]。然而,目前关于血清NE与AECOPD肺功能的研究较少。为此,本研究通过建立AECOPD大鼠模型,探究血清NE与肺功能的相关性。
1 材料与方法
1.1实验动物及分组40只Wistar大鼠购于厦门大学实验动物中心,动物生产许可证号:SCXK(闽)2018-0003,体重180~220 g,所有大鼠均饲养于SPF级动物房中,温度、湿度分别控制在22~24℃、50%~60%,均自由进食及饮水,并予以每12 h昼夜更替。
随机抽取20只Wistar大鼠作为正常对照组,不作任何处理;余20只大鼠通过熏吸香烟及气管内注射内毒素的方式建立COPD模型,建模成功后根据李建生等[7]AECOPD模型建立方法制备AECOPD模型,作为AECOPD组。
1.2材料与仪器 内毒素(上海安谱璀世标准技术服务有限公司生产);哈德门香烟(上海卷烟厂生产);金黄色葡萄球菌(北京安鑫康科技有限公司提供,菌号:ACTT25923);酶联免疫吸附试验(ELISA)试剂盒(北京强欣博瑞生物技术有限公司生产);大鼠NE试剂盒(安徽泽升科技有限公司公司生产);小动物肺功能仪(上海然哲仪器设备有限公司提供);FLUOstar OPTIMA多功能酶标仪(香港伯齐科技有限公司提供)。
1.3 AECOPD模型构建 于实验1~28 d(7 d、14 d、28 d除外)将大鼠放入密闭的有机玻璃仓,同时向玻璃仓中注入5%哈德门香烟烟雾,1次/d,30 min/次;于7 d、14 d、28 d 3个时间点,向大鼠气管内注入0.2 mL 1 mg/mL内毒素建立COPD模型。COPD模型构建成功后,于实验第29天向COPD大鼠模型鼻腔内注入0.3 mL金黄色葡萄球菌,2次/d,连续注入3 d构建AECOPD大鼠模型。
1.4苏木精-伊红(HE)染色观察两组大鼠肺组织病理形态变化 每组取5只大鼠断头处死,开胸后分离肺脏,然后采用5 mL 4%多聚甲醛固定大鼠两侧肺脏,48 h后将右肺取出经常规脱水、包埋后行切片处理,厚度约为5μm,经HE染色后置于显微镜下观察各组大鼠肺组织病理形态变化。
1.5大鼠体重的测定 分别于建模后0周、4周、8周、12周进行称重,分析两组大鼠体重变化。
1.6 ELISA法检测两组大鼠血清NE水平 每组取15只大鼠,采用40 mg/kg 2%戊巴比妥钠腹腔注射麻醉,经下腔静脉取血5 mL,然后置于离心机中以3 000 r/min的速度离心10 min,取上清液采用ELISA法检测大鼠血清NE水平,严格按照NE试剂盒说明书步骤操作,并采用多功能酶标仪于550 nm波长处对吸光度进行检测,所得吸光度值按照标准曲线计算NE水平。
1.7肺功能检测 两组大鼠均于下腔静脉取血完成后采用小动物肺功能仪检测吸气阻力(inspiratory resistance,Ri)、最大通气量(maximal voluntary ventilation,MVV)、0.3 s用力呼吸容积(FEV0.3)/FVC及呼气峰流速(peak expiratory fowl rate,PEF)。
1.8统计学方法 采用SPSS 24.0软件进行数据处理,计量资料以均数±标准差()表示,两组间比较采用独立样本t检验,采用Pearson相关性分析法分析AECOPD大鼠血清NE与肺功能指标的关系,以P<0.05为差异具有统计学意义。
2 结果
2.1两组大鼠肺组织病理形态学分析 正常对照组肺组织未见明显变化,肺泡结构完整,排列整齐,气管和支气管黏膜纤毛完整无脱落,未见明显炎性细胞浸润;AECOPD组肺泡结构明显破坏,肺泡壁变薄,肺泡腔不规则扩大,周围可见炎性细胞浸润,气道黏膜上皮杯状细胞增生,管壁纤维组织增生,支气管上皮细胞坏死、脱落,见图1。
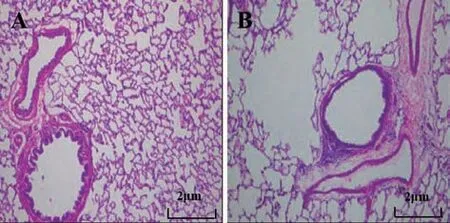
图1 两组大鼠肺组织病理形态学分析(HE染色,×100)
2.2两组大鼠体重比较AECOPD组大鼠体重增长速度较正常对照组慢,且在8周、12周时AECOPD组大鼠体重低于正常对照组(P<0.05),见表1。
表1 两组大鼠体重比较 g,
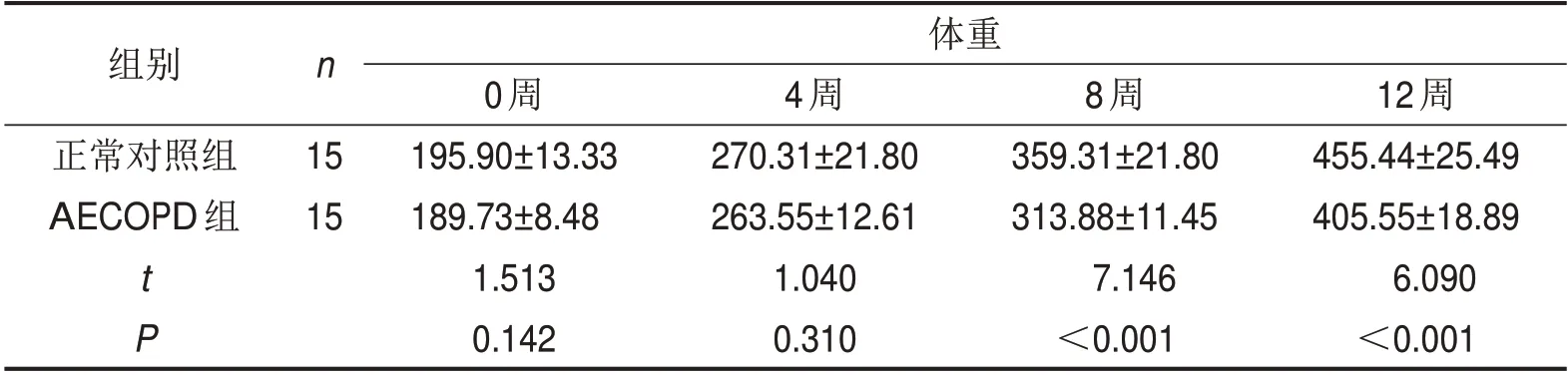
表1 两组大鼠体重比较 g,
2.3两组大鼠血清NE及肺功能指标比较AECOPD组血清NE水平与Ri均较正常对照组升高,MVV、FEV0.3/FVC、PEF均较正常对照组降低(P<0.05),见表2。
表2 两组大鼠NE及肺功能指标比较

表2 两组大鼠NE及肺功能指标比较
2.4 AECOPD大鼠血清NE与肺功能的相关性分析经Pearson分析,AECOPD大鼠血清NE与Ri呈正相关关系(r=0.530,P=0.003),与MVV(r=-0.456,P=0.011)、FEV0.3/FVC(r=-0.395,P=0.031)、PEF(r=-0.554,P=0.002)呈负相关关系,见图2。

图2 AECOPD大鼠血清NE与肺功能的相关性分析
3 讨论
AECOPD起病急骤,病情进展迅速,患者通常表现为发热、咳喘加剧、痰量增加、痰液黏度或颜色异常等,是导致COPD患者肺功能下降的重要因素[8-9]。AECOPD发生机制较复杂,临床尚未发现可有效治疗该疾病的药物及方法,治疗难度较大[10];除此之外,AECOPD呈进行性发展,随着病情的加重,气道阻力升高,可进一步引发呼吸肌疲劳及气体交换异常,加速肺功能下降,亦可导致肺动脉高压、肺心病等,严重威胁患者生命健康,给家庭及社会带来沉重的经济负担[11]。
合理的动物模型作为探索疾病的桥梁及有效手段,对多种疾病临床状态的探究具有重要价值[12]。熏吸香烟及气管内注射内毒素的方式建立COPD模型已经得到临床学者广泛认可[13],故本研究通过该方式成功构建COPD大鼠模型,且在此基础上采用鼻腔内注入金黄色葡萄球菌的方式构建AECOPD模型发现,由病理学角度来看,正常大鼠未见明显变化,AECOPD大鼠出现部分肺组织实变,肺泡结构破坏、纤维增生及炎性细胞浸润等,其肺组织病理学变化与人类AECOPD病理表现相符,可进行后续实验。并且AECOPD组大鼠体重增长速度较正常对照组慢,且在8周、12周时AECOPD组大鼠体重低于正常对照组,说明AECOPD作为慢性消耗性疾病多存在营养缺失,体重减少已成为该疾病常见表现。
气道黏液可有效抵御外来有害物质入侵,然而气道黏液过度分泌可导致黏液潴留、黏液纤毛清除功能异常等,进而导致气道阻塞及反复感染[14]。中性粒细胞可在肺内聚集并通过释放多种促炎因子而引发NE大量分泌,并进一步加重气道阻塞[15]。中性粒细胞活化后可促进NE分泌,而NE是一种破坏性极强的弹性蛋白酶,其可导致组织炎症反应,已被证实与COPD起病及进展密不可分[16]。当COPD进入急性加重期,NE活性明显上,这与中性粒细胞导致的炎症反应关系紧密[17]。目前已有报道表明,COPD患者气道分泌物中主要是NE大量聚集,而NE可促进AECOPD气道黏液高分泌[18]。汪强等[19]研究发现,AECOPD患者血清NE、高迁移率族蛋白-1水平均较COPD稳定期患者及健康老年人群显著升高,说明AECOPD患者体内存在炎症反应,且肺组织可能受到严重损伤;除此之外,稳定期患者血清NE、高迁移率族蛋白-1水平亦较健康老年人群升高,说明COPD患者处于稳定期体内亦出现慢性炎症反应,可继续损伤肺组织;两种因子持续作用可能是连续不断地气道炎症及气道重塑,是引发肺组织破坏的重要机制。肺功能指标是临床判断AECOPD患者通气障碍和气流受限的重要方法,可为临床判断患者病情改善情况提供依据[20]。本研究结果显示,AECOPD组血清NE水平与Ri均较正常对照组升高,MVV、FEV0.3/FVC、PEF均较正常对照组降低。这与李杰等[12]研究结果相一致,AECOPD大鼠血清NE水平升高,提示其体内可能存在一定程度慢性炎症反应,可诱导急性加重期气道黏液高分泌,并导致肺组织破坏。经Pearson分析,AECOPD大鼠血清NE与Ri呈正相关关系,与MVV、FEV0.3/FVC、PEF呈负相关关系,说明NE可影响AECOPD肺功能,与肺功能进行性下降密切相关,推测NE影响AECOPD肺功能的作用机制可能为:NE作为一种极强的促黏液分泌物质,其可通过促进气道黏蛋白表达及黏液释放而引发气道炎症时黏液高分泌状态的产生,此时气道内黏液过度增加,气道阻塞进一步加重,可形成严重的气流受限,最终导致AECOPD肺功能持续下降。
综上,AECOPD血清NE水平升高与AECOPD肺功能持续下降密切相关。
