艾立布林用于多线治疗后晚期乳腺癌5例报告
2022-04-28杨华申戈孙琪云周明王鲲鹏蔡金东杨刚刘冲达永
杨华,申戈,孙琪云,周明,王鲲鹏,蔡金东,杨刚,刘冲,达永
北京丰台右安门医院肿瘤科,北京 100054
近年来,转移性乳腺癌患者的生存率有所提高,以蒽环类、紫杉醇、吉西他滨、卡培他滨、长春瑞滨、铂类为基础的化疗方案延长了乳腺癌患者的总生存期(overall survival,OS)[1]。但晚期转移性乳腺癌患者长期生存率仍然不佳,因此,需要更加有效的治疗手段来改善患者的生活质量并延长生存期[2]。艾立布林是一种非紫杉烷类的微管抑制剂,属于卤代烷类抗肿瘤药物[3]。除主要的抗肿瘤作用外,临床前研究还证实了这些药物的其他潜在益处,如通过阻断上皮-间充质转化(epithelialmesenchymal transition,EMT)过程从而阻断肿瘤干细胞生成,通过血管重塑改善肿瘤微环境,减少耐药的发生并抑制转移[4-6]。既往研究表明,与医师选择的治疗方案(如蒽环类、紫杉醇、吉西他滨、卡培他滨、长春瑞滨、铂类为基础的化疗方案)相比,艾立布林可改善晚期转移性乳腺癌患者的OS[7]。早在2001年,艾立布林无论是体内试验还是体外实验均显示了良好的抗肿瘤作用[8],并在后续多项临床试验中证实了其疗效及安全性[9-13],但国内却鲜有报道,因此,本研究对2019年10月至2020年11月北京丰台右安门医院收治的5例应用艾立布林治疗的晚期乳腺癌患者的病历资料进行分析,探讨艾立布林治疗晚期乳腺癌的疗效及安全性,旨在进一步为其临床应用提供依据。
1 病历资料
选取2019年10月至2020年11月北京丰台右安门医院收治的5例晚期乳腺癌患者,均为女性。其中3例为三阴性乳腺癌[雌激素受体(estrogen receptor,ER)(-)、孕激素受体(progesterone receptor,PR)(-)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)(-)]、2 例 HER2(+++)。患者的基本信息及治疗经过见表1。第1、8天,给予甲磺酸艾立布林注射液1.4 mg/m2,每21天为1个周期,其中2例HER2(+++)乳腺癌患者在此基础上给予曲妥珠单抗(6 mg/kg,每3周1次)治疗,3例三阴性乳腺癌患者联合特瑞普利单抗注射液(240 mg,每3周1次)+顺铂注射液(第1~3天,75 mg/m2,每21天为1个周期)治疗。采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)[14]评估患者的临床疗效:完全缓解(complete response,CR),所有目标病灶消失;部分缓解(partial response,PR),基线病灶长径总和缩小≥30%;疾病稳定(stable disease,SD),基线病灶长径总和缩小<30%或增大<20%;疾病进展(progressive disease,PD),基线病灶长径总和增加≥20%,或出现新病灶。采用常见不良反应评价标准(common terminology criteria for adverse event,CTCAE)5.0版评估患者的不良反应发生情况。

表1 晚期乳腺癌患者的临床特征
病例1,女,47岁,2018年3月发现双乳肿块,2018年4月2日在北京协和医院B超引导下行右乳穿刺活检术,结果显示乳腺浸润性癌(非特殊型、低分化)。2018年5月10日行双侧乳腺切除术,术后病理示乳腺浸润性癌(非特殊型、低分化)。免疫组化结果显示,ER(-)、PR(-)、HER2(-)、Ki-67(50%~70%)。2018年6月12日开始给予吡柔比星+环磷酰胺化疗4个周期、多西他赛化疗3个周期,疗效评价为PD,疾病进展时间(time to progression,TTP)为2个月。2018年8月3日开始给予吉西他滨+奈达铂化疗9个周期,疗效评价为 PR,无进展生存期(progression-free survival,PFS)为14个月。2019年4月17日开始行双侧胸壁6MV-β线放疗,总剂量55 Gy/25 f;2019年4月19日开始口服安罗替尼+卡培他滨维持治疗。2019年10月转至北京丰台右安门医院。2019年11月11日开始给予吉西他滨+顺铂化疗2个周期,疗效评价为PR,TTP为1个月。2019年12月9日开始给予培美曲塞+顺铂+程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)治疗4个周期,疗效评价为SD,TTP为4个月。2019年12月18日基因检测结果显示,肿瘤突变负荷(tumor mutation burden,TMB)为 33.6 Mb。2020年2月20日开始给予贝伐珠单抗+培美曲塞+顺铂治疗2个周期后,疗效评价为PD,TTP为40天。2020年3月31日开始给予白蛋白紫杉醇100 mg周化疗,共9个周期,疗效评价为SD,TTP为3个月。2020年7月9日开始给予吉西他滨+白蛋白紫杉醇化疗4个周期,疗效评价为SD,TTP为70天。2020年9月18日开始给予艾立布林+特瑞普利单抗+卡铂治疗5个周期,疗效评价为PR。患者肺部转移呈癌性淋巴管炎的影像特点,应用艾立布林后肺部渗出明显吸收(图1),胸闷憋气症状明显缓解。卡氏功能状态(Karnofsky performance status,KPS)评分由化疗前的70分升高至化疗后的90分。患者化疗第13天出现3级中性粒细胞减少,给予重组人粒细胞刺激因子300 μg,连续应用6天后,中性粒细胞恢复至正常。应用艾立布林期间出现双手麻木,停用化疗药物后,麻木症状缓解。2021年1月因脑多发转移,开始行全脑放疗。
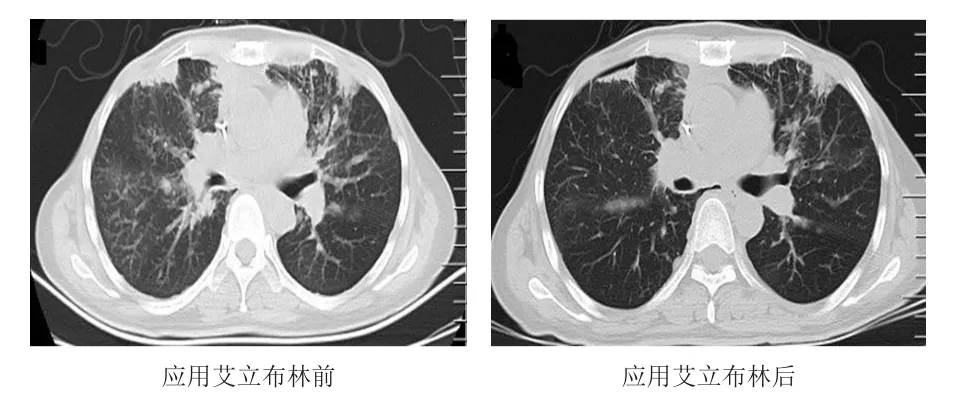
图1 病例1胸部CT图像
病例2,女,33岁,2019年1月发现右乳结节,在北京大学肿瘤医院穿刺活检显示右侧乳腺癌伴腋窝淋巴结转移;免疫组化显示ER(-)、PR(-)、HER2(-)、Ki-67(约30%)。2019年3月开始给予白蛋白紫杉醇周化疗,共13个周期,疗效评价为SD,TTP为2个月。2019年6月开始给予多西他赛+卡培他滨化疗4个周期,疗效评价为SD,随后给予吡柔比星+环磷酰胺化疗4个周期,疗效评价为PR。2019年10月转至北京丰台右安门医院。2019年12月16日,行右侧乳腺癌保乳术+腋窝淋巴结清扫术,术后病理显示右乳浸润性癌、腋窝淋巴结转移癌(7/15);术后给予多柔比星+环磷酰胺(AC)方案辅助治疗2个周期,后续改为卡培他滨辅助化疗至2020年3月,复查提示右乳肿物。穿刺活检显示浸润性乳腺癌;免疫组化显示ER(-)、PR(-)、HER2(-)、Ki-67(约65%)。2020年4月17日开始给予白蛋白紫杉醇+卡铂化疗4个周期,疗效评价为PD,TTP为3个月;更换为长春瑞滨+贝伐珠单抗治疗4个周期后,疗效评价为SD。2020年9月10日行右侧乳腺癌改良根治术+腹部皮瓣移植术,术后口服长春瑞滨维持治疗,后因胸壁转移于2020年12月22日开始给予艾立布林+顺铂化疗2个周期,疗效评价为SD。患者胸壁转移情况较治疗前无明显变化(图2)。患者第2个周期治疗后第7天出现转氨酶轻度升高,不良反应分级为1级,应用还原型谷胱甘肽治疗后1周,复查肝功能恢复正常。
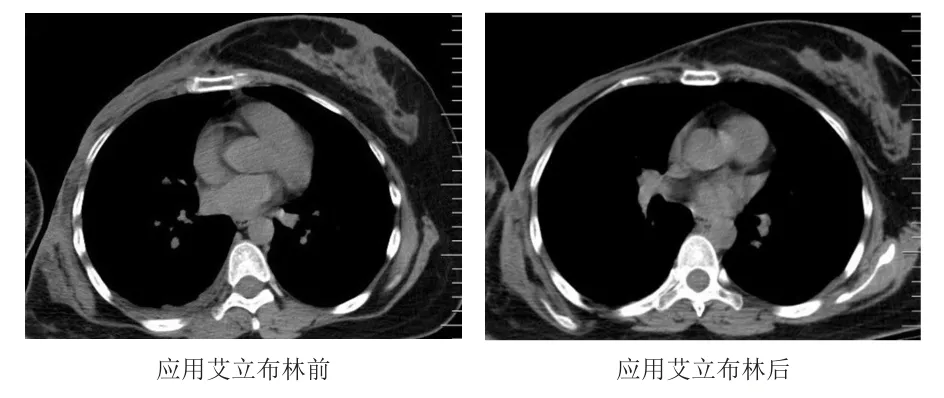
图2 病例2胸部CT图像
病例3,女,35岁。2016年4月发现左乳肿块,2016年5月6日在北京大学肿瘤医院行左侧乳腺癌改良根治术,术后病理显示:乳腺浸润性导管癌Ⅱ级,淋巴结可见转移癌(11/20);免疫组化显示,ER(+,40%)、PR(-)、HER2(+++)、Ki-67(+,5%)。术后给予表柔比星+环磷酰胺辅助化疗4个周期,紫杉醇+曲妥珠单抗治疗4个周期,继续应用曲妥珠单抗390 mg维持治疗1年;2016年7月开始口服他莫昔芬3年。2019年9月25日转至北京丰台右安门医院,检查结果提示癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原15-3(carbohydrate antigen 15-3,CA15-3)水平升高,正电子发射计算机断层显像(position emission tomography,PET)-CT检查提示病情进展。2019年10月开始给予卡培他滨口服治疗2个周期,疗效评价为SD,TTP为40天。2019年11月29日开始给予多西他赛+曲妥珠单抗治疗3个周期,疗效评价为PD,TTP为2个月。2020年2月6日因脑转移行全脑放疗,并给予贝伐珠单抗+多西他赛+吉西他滨治疗1个周期,疗效评价为PD,TTP为1个月。2020年5月25日复查PET-CT,提示病情进展。2020年6月23日开始给予长春瑞滨+曲妥珠单抗+帕妥珠单抗双靶治疗4个周期,疗效评价为PR,PFS为3个月。因肿瘤标志物水平再次升高,2020年9月23日开始给予艾立布林+曲妥珠单抗+帕妥珠单抗双靶治疗4个周期,疗效评价为PR。肿瘤标志物包括CEA、CA15-3水平明显降低,复查胸部CT显示肺部转移灶较前明显缩小(图3)。患者于艾立布林每个周期化疗后均会出现轻度乏力症状,持续约14天,可自行缓解。
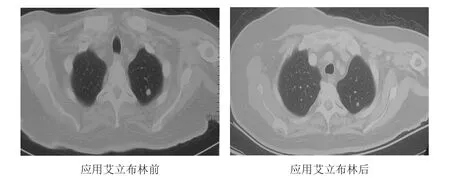
图3 病例3胸部CT 显示肺转移病灶情况
病例4,女,63岁,2011年8月25日发现左腋下肿块,2011年9月5日在中国医学科学院肿瘤医院行左侧乳腺癌改良根治术,术后病理示导管内癌伴小灶浸润,腋窝淋巴结转移(24/25);免疫组化结果显示:ER(+,80%)、PR(+,40%)、HER2(+++)、Ki-67(8%)。术后给予紫杉醇+表柔比星辅助化疗1个周期、紫杉醇+表柔比星+环磷酰胺化疗5个周期、口服依西美坦内分泌治疗1年。2013年4月发现右腋下肿块,于2013年5月22日右腋下病理活检显示:乳腺浸润性微乳头状癌,伴导管内癌,周围淋巴结可见转移癌;免疫组化结果显示:ER(-)、PR(-)、HER2(+++)、Ki-67(30%)。2013年6月28日开始给予紫杉醇+环磷酰胺+曲妥珠单抗治疗6个周期,疗效评价为SD,TTP为5个月。2013年12月至2014年5月29日给予曲妥珠单抗单药治疗。2014年11月3日开始给予卡培他滨+拉帕替尼治疗6个周期,疗效评价为SD。2015年6月18日开始给予吉西他滨化疗6个周期,疗效评价为PD。2016年1月20日开始给予依托泊苷化疗2个周期,疗效评价为PD,TTP为2个月。2016年4月7日开始给予长春瑞滨化疗2个周期,疗效评价为PD,TTP为2个月。入组T-DM1试验,2016年8月26日开始给予T-DM1治疗13个周期,疗效评价为CR,PFS为18个月,因双肺间质性改变,停用。2018年3月9日开始给予多西他赛+曲妥珠单抗治疗3个周期,疗效评价为PD,TTP为2个月。2018年7月4日开始给予曲妥珠单抗+拉帕替尼治疗3个周期,疗效评价为PD,TTP为2个月。2019年4月开始给予白蛋白紫杉醇+曲妥珠单抗治疗6个周期,疗效评价为PD。2019年12月转至北京丰台右安门医院。2019年12月12日开始给予艾立布林+曲妥珠单抗治疗2个周期,疗效评价为PR。患者应用艾立布林后锁骨上淋巴结明显缩小,疼痛减轻,数字评分法(numerical rating scale,NRS)评分从6分降至3分。因个人原因未继续抗肿瘤治疗。2020年6月4日继续给予艾立布林+曲妥珠单抗治疗2个周期,疗效评价为SD。化疗后第14天出现1级中性粒细胞减少,口服利可君2周后,恢复至正常。2020年9月因脑转移行伽马刀治疗。
病例5,女,58岁,2018年3月15日在北京大学肿瘤医院行左乳改良根治术,术后病理显示:左乳浸润性癌(非特殊型、低分化,大小2.0 cm×1.2 cm×1.5 cm),淋巴结转移(腋窝11/14、第三站2/2、腋静脉上方2/3)。免疫组化结果显示:ER(-)、PR(-)、HER2(-)、Ki-67(80%)。2018年5月4日开始给予紫杉醇+吡柔比星治疗6个周期,疗效评价为SD。2018年9月1日行左侧胸壁及左锁骨上下区域放疗。2019年4月13日开始给予白蛋白紫杉醇+阿特珠单抗治疗4个周期,疗效评价为SD,TTP为9个月。2020年3月2日开始给予艾立布林治疗3个周期,最佳疗效评价为SD,PFS为2.5个月(图4)。治疗期间出现轻度脱发、手足麻木,口服甲钴胺治疗,化疗结束后均缓解。
2 讨论
5例病例中,PR 3例、SD 2例,其中3例三阴性乳腺癌患者中PR 1例、SD 2例,2例HER2阳性患者,均为PR。一项临床研究表明,三阴性乳腺癌患者接受艾立布林治疗可延长PFS[15]。Yoshida等[4]的研究结果也显示,三阴性乳腺癌的侵袭机制与EMT相关,而艾立布林抑制了这一转变。3例三阴性乳腺癌患者中PR 1例、SD 2例,其中的PR患者肺转移呈癌性淋巴管炎,应用艾立布林后,胸部CT炎性渗出较治疗前明显吸收,血氧及活动耐力改善。曲妥珠单抗是作用于细胞表面蛋白HER2的重组DNA衍生的人源化单克隆抗体,是一种抗体依赖的细胞介导的细胞毒性反应的潜在介质[16]。多项临床试验证实,应用曲妥珠单抗联合化疗药物如卡铂、多西紫杉醇、紫杉醇、长春瑞滨或卡培他滨对转移性乳腺癌患者有效[17-20]。一项多中心Ⅱ期临床研究中,纳入52例复发或转移HER2阳性乳腺癌患者,探讨艾立布林与曲妥珠单抗联合应用的疗效,结果显示,客观缓解率(objective response rate,ORR)为71.2%,PFS为11.6个月[21]。2例HER2阳性患者给予的治疗方案为艾立布林联合曲妥珠单抗,两例患者均为PR,但PFS远短于相关报道,考虑为应用艾立布林时患者的状态为多线治疗,且肿瘤负荷较大。5例患者无论HER2的表达情况,均从艾立布林中获益,但因样本量较小,更加精准的数据需要临床更广泛的应用及验证。
既往研究证实,艾立布林无法穿过血脑屏障[22-24]。多项研究纳入标准中均排除脑转移患者,除非该脑转移患者既往接受过相关治疗,头部病灶稳定[7,25-26]。病例1、3、4、5是脑转移的患者,其中3例患者为应用艾立布林进展后发现脑转移,给予局部治疗。因此,建议应用艾立布林的同时定期复查头颅MRI,必要时给予艾立布林联合局部治疗(全脑放疗+局部加量/伽马刀)[27]。
在不良反应方面,5例患者出现的不良反应包括转氨酶升高、神经毒性、乏力及中性粒细胞减少,除中性粒细胞减少为3级不良反应外,其他均为1级。出现3级中性粒细胞减少的患者既往接受过多线化疗,本身骨髓造血能力不佳,且应用艾立布林的同时联合应用卡铂,因此,考虑出现中性粒细胞严重减少为多因素所致,并全非艾立布林单药的作用。研究显示,天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)(7.7%)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)(7.6%)、γ-谷 氨 酰 转 肽 酶(γ-glutamyl transferase,GGT)(1.7%)升高、高胆红素血症(1.4%)均是与艾立布林治疗相关的Ⅱ、Ⅲ期临床试验中常见的不良事件,但除高胆红素血症外,未见4级不良事件[27-28]。本文5例患者中,仅1例患者出现轻度转氨酶升高,还原型谷胱甘肽治疗1周后,复查肝功能恢复正常;病例1及病例4既往均接受过多线治疗,体质较差,希望在尽力控制肿瘤负荷的前提下,更加保证患者的生活质量。总体来讲,患者应用艾立布林后,耐受性良好,且不良反应可控。
本文5例患者均存在广泛转移,经多线治疗后,能够从艾立布林治疗中获益,且耐受性良好,为晚期乳腺癌患者的治疗提供了一个新选择。
