靶向生长抑素受体SSTR2的新型白蛋白亲和放射性碘标记分子探针的制备与评价
2022-04-28林晓茹方建阳李靖超郭志德张现忠
林晓茹,方建阳,李靖超,郭志德,张现忠
(厦门大学公共卫生学院,分子疫苗学和分子诊断学国家重点实验室,分子影像暨转化医学研究中心,福建 厦门 361102)
生长抑素受体(somatostatin receptor,SSTR)属于G蛋白偶联膜受体超家族,分为SSTR1~5共5种受体亚型[1],其中SSTR2在90%的神经内分泌瘤(neuroendocrine tumor,NET)中高表达[2],已成为肿瘤诊断和治疗中有潜力的靶点[3-5].由于奥曲肽衍生物Tyr3-octreotate(TATE)可以与NET细胞表面的SSTR2高特异性、高选择性结合[6],所以使用放射性核素对该肽进行标记引起广泛关注.如68Cu对1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)-TATE进行标记得到的[68Cu]Cu-DOTA-TATE,其NET正电子发射断层显像(position emission computed tomography,PET)的灵敏度和特异性均高达90%以上[7].此外,使用90Y或177Lu等核素标记DOTA-TATE,所获得的标记化合物可用于肿瘤的肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)[8-9].对于表达生长抑素的肿瘤患者,PRRT可以用于治疗不适合手术切除的患者.177Lu标记的TATE([177Lu]Lu-DOTA-TATE)已于2018年1月被美国食品药品监督管理局批准,用于治疗SSTR阳性的胃肠胰腺NET(GEP-NET),是第一个被批准用于GEP-NET的放射性药物[9].在一项涉及晚期SSTR阳性GEP-NET患者的临床试验中,与单独接受奥曲肽的患者相比,[177Lu]Lu-DOTA-TATE治疗可获得更长的无进展生存期,这意味着接受[177Lu]Lu-DOTA-TATE治疗的患者的肿瘤生长风险或死亡风险更低.尽管[177Lu]Lu-DOTA-TATE对治疗NET的患者有效,但该肽在血液中快速清除且通过肾脏代谢,限制了其在核素治疗中的进一步应用[10-12].从成像层面来说,快速的血液清除率可降低正常组织的放射毒性,提高探针在体内的靶标/本底比值,因此在肿瘤的受体靶向显像中通常被认为是一项优势.然而,在治疗层面,如果药物在血液中快速清除,那么会造成药物与靶标结合不充分,这就需要加大剂量[13].提高探针在血液中的循环时间能有助于提高探针和受体的结合[14].因此,较长的血液循环半衰期对于肿瘤PRRT是必要的[15],其疗效很大程度上取决于标记化合物的药代动力学[16].大部分多肽类核素标记化合物用于核素治疗时,其疗效常受到血液循环半衰期短的限制[17],而多次给药方式不仅提高了医疗成本,也增加了副作用的发生率[18].因此,延缓探针的血液循环半衰期,提高核素在靶标部位的绝对摄取值,成为获得更好疗效的一种有益尝试[19].
人血清白蛋白(human serum albumin,HSA)是血浆中含量最多的蛋白质(50 mg/mL).自20世纪90年代中期开始,HSA作为一种运输蛋白被广泛研究,通常被用于延长靶向炎症或肿瘤药物的生物半衰期[20-21].通过共价或非共价结合的方式将药物与白蛋白结合分子(albumin-binding molecule,ABM)连接到一起,经静脉注射入体内后形成白蛋白-结合基团-药物的三合体,能使治疗药物在体内的血液循环时间大幅延长,降低肾脏摄取的同时提高药物在肿瘤部位的摄取[22-23].
因此,本研究试图将白蛋白亲和基团修饰到TATE上,并通过延长多肽的血液循环半衰期来提高肿瘤摄取.伊文思蓝(Evans blue,EB)分子对TATE的修饰策略已被证明是一种有效的提高探针药代动力学性质的途径.研究表明EB-TATE较TATE单体的体内循环时间有明显延长,在提高探针肿瘤摄取的同时降低其肾脏中的放射性滞留[15,24-25].但EB的合成较为繁琐,需要在分子中引入双功能螯合剂1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)或DOTA才能进行核素标记.4-碘苯基丁酸(p-iodophenylbutyric acid,IPBA)是从DNA编码的化学库中筛选出的一类小分子化合物,可以和HSA以稳定的非共价形式结合,从而大大减缓其从体内清除的速率[26-28].已有研究发现,将IPBA小分子与不同靶向分子结合,探针的血液循环时间有效延长,在肿瘤中的摄取率随之增加[29-32].近期,本课题组开发了一种新型的放射性碘标记方法,在铜介导下放射性碘离子与芳香族苯硼酸类化合物Ar-B(OH)2发生氧化取代反应,即可实现放射性碘的标记[33-36],整个标记过程具有反应简单快速、标记率高等优点.因此,本研究利用该反应对4-(4-硼酸基苯基)丁酸活化酯(4-BBA-NHS)结构进行标记,以获得放射性碘标记的[131I]IPBA-NHS,并进一步通过酰胺化反应得到靶向SSTR2的新型白蛋白亲和探针[131I]IPBA-TATE,期望能够通过延长探针的血液半衰期来提高探针在肿瘤中的摄取率.值得一提的是,应用于生命科学的放射性碘同位素种类较多(131I、125I、124I、123I等),可选择性用于PET/单光子发射计算机断层显像(single photon emission computed tomography,SPECT),亦可用于放射性靶向治疗,是核素诊疗一体化平台的重要组成部分.
1 材料与方法
1.1 试验材料
1.1.1 主要实验仪器
分析天平(Discovery,OHAUS),放射性核素活度计(CRC-15R,CAPINTEC),高效液相色谱(HPLC)仪(Thermo),高分辨质谱(Waters),伽马计数器(WIZARD 2480,Perkin-Elmer),离心机(H1650,湖南湘仪离心机仪器有限公司).
1.1.2 主要试剂与耗材
1,10-邻菲罗啉(百灵威化学技术有限公司),氯化铜(CuCl2),N,N-二甲基甲酰胺(DMF)、N,N-二异丙基乙胺(DIPEA),无水乙腈、正辛醇(萨恩化学技术有限公司),HSA(Solarbio),胎牛血清(FBS)、F-12K液体培养基(Gibco BRL);超滤离心管(北京明阳科华生物技术有限公司),C-18反相放射性HPLC柱(内径4.6 mm,柱长250 mm,粒径5 μm,孔径120 nm, Thermo),C-18小柱(Waters).
1.1.3 实验动物与细胞系
所用的表达SSTR2的AR42J大鼠胰腺外分泌腺肿瘤细胞购于中国科学院上海生命科学研究院细胞研究资源中心.BALB/c正常小鼠及裸小鼠(6~8周,体质量为18~20 g,雄性)来源于厦门大学实验动物中心,所有动物实验操作均符合伦理规范.
细胞培养:将AR42J细胞置于含20%(体积分数)FBS的F-12K液体培养基中进行培养,培养条件为:37 ℃,5%(体积分数)CO2和95%(体积分数)空气.
AR42J模型小鼠的建立:将AR42J细胞(1×107个,100 μL)接种于裸鼠右上肢部位,接种完毕后形成皮下球状体,隔日观察小鼠成瘤及肿瘤生长情况,待肿瘤直径生长至7~10 mm时用于生物分布研究.
1.2 放射化学合成
本研究合成了两种基于TATE结构的放射性碘标记分子[131I]IPBA-TATE和[131I]4-碘苯甲酸(IBA)-TATE,其放射化学合成路线如图1所示.
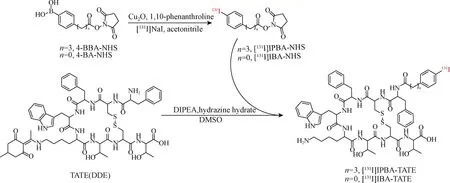
DDE.1-(4,4-二甲基-2,6-二氧代环己-1-亚基)乙基.
1.2.1 [131I]IPBA-NHS和[131I]IBA-NHS的放射性碘标记
采用本课题组开发的基于铜催化的苯硼酸放射性碘标记法[35],具体过程为:取37 MBq[131I]NaI,氮气吹干,加入1 mg 4-BBA-NHS或4-BA-NHS,随后加入50 μL催化剂(11.6 mg Cu2O, 31 mg 1,10-邻菲罗啉溶于3 mL无水乙腈混合液),50 ℃下反应30 min,通过HPLC进行分析.
1.2.2 [131I]IPBA-TATE和[131I]IBA-TATE的合成
取1 mg TATE溶于DMSO中,加入5 μL DIPEA后将混合液加入放射性碘标记的[131I]IPBA-NHS或[131I]IBA-NHS,50 ℃下反应30 min;随后加入5 μL水合肼,室温下反应10 min.通过HPLC进行分离纯化,纯化条件如表1所示.紫外检测波长为254 nm,流速为1 mL/min.
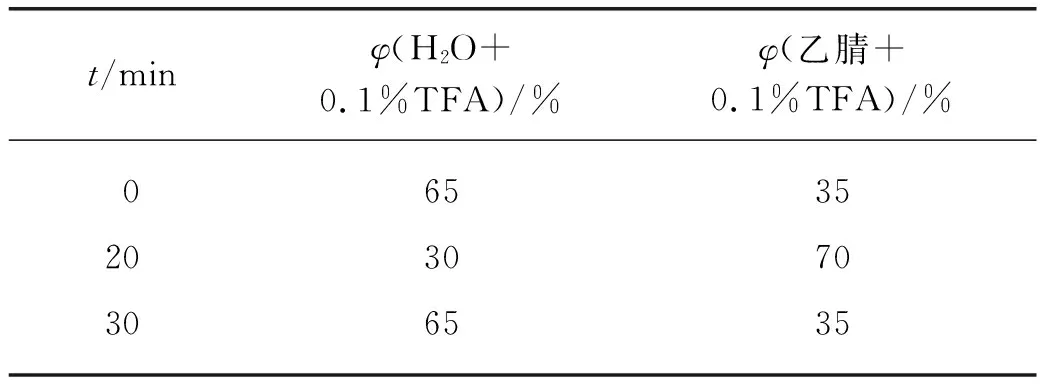
表1 [131I]IPBA-TATE和[131I]IBA-TATE的HPLC纯化条件
1.3 脂水分配系数实验
脂水分配系数实验根据文献报道的方法进行操作[37-38].取纯化后的[131I]IPBA-TATE或[131I]IBA-TATE(370 kBq)于2.5 mL的1号EP管中,加入正辛醇和磷酸盐缓冲液(PBS)各1 mL,密封后涡旋3 min,以6 000 r/min的转速离心5 min后,从有机相中取出100 μL于2号EP管中;然后加入900 μL正辛醇和1 mL PBS,再次密封后涡旋3 min,以同样的转速离心5 min,重复3次,分别取100 μL的有机相和水相于不同的EP管中,平行取样3次;最后用伽马计数器测量每个离心管中的放射性计数,计算脂水分配系数对数logP.
1.4 稳定性实验
取370 kBq的[131I]IPBA-TATE或[131I]IBA-TATE分别置于PBS、生理盐水和FBS中,在37 ℃下孵育24 h,用HPLC分析放射化学纯度.
1.5 白蛋白结合实验
1.5.1 超滤离心实验
参照已有方法[36],取37 kBq纯化后的[131I]IPBA-TATE或[131I]IBA-TATE溶于1 mL PBS中,加入5 mg HSA,在室温下孵育20 min后转移至超滤离心管中,以12 000 r/min的转速离心15 min,收集下层溶液;再往上层加入500 μL PBS,以同样的转速离心5 min,重复3次,收集下层溶液;最后用伽马计数器测定离心管上、下层的活度.
1.5.2 透析实验
根据已有方法[39-40]进行透析实验,具体操作步骤如下:取5 mg HSA溶于5 mL pH 7.4的PBS中.实验组加入200 μL(7.4 MBq)的[131I]IPBA-TATE和5 mL HSA溶液(PBS配制),对照组加入200 μL(7.4 MBq)的[131I]IPBA-TATE和5 mL PBS;室温下孵育20 min后,分别将实验组和对照组中的溶液转移至透析袋(截留分子质量7 ku),并于装有1 L超纯水的透析桶中进行透析.用伽马计数器测量不同时间点透析膜内和超纯水中的放射性计数,每组3个重复样本.按上述步骤进行[131I]IBA-TATE的透析实验.
1.5.3 药代动力学测定
在实验前3 d,将含有0.12%(质量分数)碘化钾的饮用水对BALB/c小鼠进行喂养,以抑制甲状腺对碘离子的摄取.将14.8 MBq[131I]IPBA-TATE或[131I]IBA-TATE通过尾静脉注射到小鼠体内,在不同时间点(0.5,2,4,8和24 h)通过眼眶取血的方式收集小鼠血液并称量,用伽马计数器测量血液中放射性计数,计算每克血液中所摄取的放射性剂量占总注射放射性剂量的百分率(%ID/g).最后用DAS(Drug and Statistics)软件计算血液末端清除半衰期(t1/2z,t1/2z=0.693/Zeta,Zeta为c-t曲线尾段斜率).
1.6 生物分布实验
选取正常BALB/c小鼠或AR42J荷瘤小鼠进行生物分布实验,通过尾静脉注射1.85 MBq[131I]IPBA-TATE或[131I]IBA-TATE,在给药0.5,2,4,8和24 h 后处死.对小鼠进行解剖并取出心、肝、脾、肺、肾、胃、骨、血、肉、肠、脑、子宫、卵巢、甲状腺、脑等器官进行称量,用伽马计数器进行放射性计数,计算每克组织中所摄取的放射性剂量占总注射放射性剂量的百分率(%ID/g).
2 结果与讨论
2.1 化学合成
通过高分辨质谱对[127I]IPBA-TATE和[127I]IBA-TATE进行鉴定:[127I]IPBA-TATE的[M+H+]质荷比为1 304.25,[127I]IBA-TATE的[M+H+]质荷比为1 261.28.用铜介导的苯硼酸标碘方法进行131I标记,标记过程简单且具有较好的放射化学产率.[131I]IPBA-TATE和[131I]IBA-TATE的部分理化性质见表2,经HPLC纯化后得到放射化学纯度大于95%且比活度高的标记化合物(图2),通过脂水分配系数实验测得[131I]IPBA-TATE和[131I]IBA-TATE呈亲脂性(logP>0).
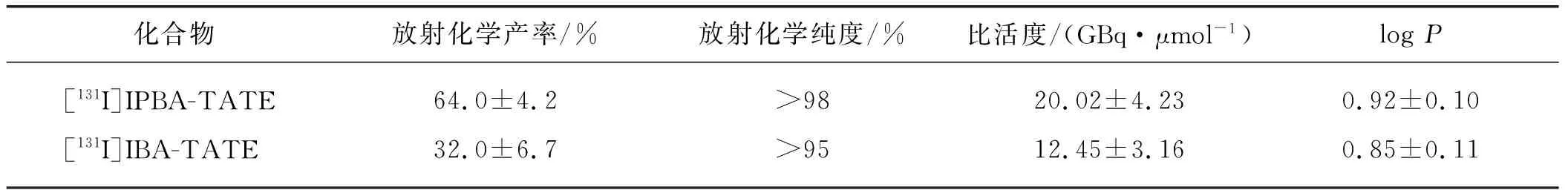
表2 [131I]IPBA-TATE和[131I]IBA-TATE的理化性质(n=3)

图2 [131I]IPBA-NHS、[131I]IPBA-TATE(a)以及[131I]IBA-NHS、[131I]IBA-TATE(b)的HPLC谱图
2.2 体外稳定性
图3为37 ℃下[131I]IPBA-TATE和[131I]IBA-TATE在生理盐水、PBS及FBS中孵育24 h的稳定性情况.通过HPLC分析得131I-在该条件下的保留时间为2.5 min左右.[131I]IPBA-TATE和[131I]IBA-TATE并未出现脱碘现象,且在不同条件下孵育24 h后其放射化学纯度均大于95%,说明[131I]IPBA-TATE和[131I]IBA-TATE具有良好的体外稳定性.该结果与已报道的结果[35-36]一致.
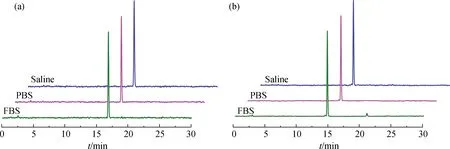
图3 [131I]IPBA-TATE(a)和[131I]IBA-TATE(b)在生理盐水、PBS及FBS中孵育24 h后的体外稳定性
2.3 白蛋白结合能力
通过超滤离心实验和透析实验两种方法在体外定性研究[131I]IPBA-TATE与HSA的结合能力.通过测定小鼠体内血液末端清除半衰期来评估靶向分子TATE连接到白蛋白结合分子IPBA后血液循环时间是否延长,以[131I]IBA-TATE作为对照组.
图4(a)和(b)分别为[131I]IPBA-TATE和[131I]IBA-TATE在体外与白蛋白的透析实验结果.随着透析时间的延长,游离的[131I]IPBA-TATE和[131I]IBA-TATE会从透析袋中析出,而结合了HSA的[131I]IPBA-TATE由于分子质量增加会滞留在透析袋中.结果表明:在含有HSA的透析袋中透析24 h后,约(82.17±0.34)%[131I]IPBA-TATE仍滞留在透析袋中;而[131I]IBA-TATE仅滞留(48.85±0.51)%.在不含HSA的透析袋中透析24 h后,[131I]IPBA-TATE和[131I]IBA-TATE的析出比例接近,均约50%.上述结果表明[131I]IPBA-TATE在体外能有效与白蛋白结合.
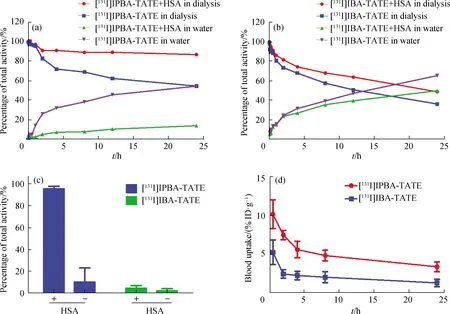
(a)~(b)透析实验;(c)超滤离心实验;(d)血液末端清除半衰期测定.
白蛋白结合超滤离心实验结果如图4(c)所示:实验组中,由于[131I]IPBA-TATE有效结合了HSA,分子质量增大,主要放射性计数都保留在离心管上层;而[131I]IBA-TATE由于和HSA结合效率低,几乎全被离心至下层.上述结果表明[131I]IPBA-TATE在体外具有较高的白蛋白结合能力,结合率约90%.
[131I]IPBA-TATE和[131I]IBA-TATE在血液中的摄取情况如图4(d)所示.[131I]IPBA-TATE的血液末端清除半衰期t1/2z=(25.50±3.35)h,约为[131I]IBA-TATE(t1/2z=(15.64±4.2)h)的1.6倍.体内数据进一步证明[131I]IPBA-TATE具有更强的白蛋白结合能力,能够达到延长血液末端清除半衰期的效果.
2.4 生物分布
2.4.1 正常小鼠中的生物分布
[131I]IPBA-TATE和[131I]IBA-TATE在正常小鼠中的生物分布结果如图5所示.通过尾静脉分别注射[131I]IPBA-TATE和[131I]IBA-TATE后,其主要分布在肝、肾及胃中,且随着循环时间的延长放射性逐渐降低.在肝脏中的摄取率最高,说明这两个探针均以肝脏代谢为主,主要原因可能是[131I]IPBA-TATE和[131I]IBA-TATE呈亲脂性,验证了2.1节结果中的推断;在胃中也有明显的放射性摄取,可能是由于SSTR2在胃中高表达所出现的生理性摄取,也可能是由于脱碘所致;但甲状腺的摄取率较低(实验前并未对小鼠注射碘化钾溶液以阻断甲状腺对游离碘离子的摄取),说明[131I]IPBA-TATE和[131I]IBA-TATE在体内稳定性较好.胃中的高放射性摄取可能是由于胃高表达SSTR2所出现的生理性摄取,也说明[131I]IPBA-TATE和[131I]IBA-TATE对SSTR2具有一定的亲和力.不同的是,[131I]IPBA-TATE在肾脏中快速清除,在注射24 h后,肾脏中的摄取仅为(3.75±0.81)%ID/g;而[131I]IBA-TATE在肾脏中的摄取于4 h 达到最大值(13.64±1.44)%ID/g,并且在24 h仍有较高的摄取,为(5.81±1.33)%ID/g.此外,还发现[131I]IPBA-TATE相比于[131I]IBA-TATE在血液中有更高的放射性滞留,在0.5 h时分别有(10.41±2.79)%ID/g的[131I]IPBA-TATE和(4.55±2.01)%ID/g 的[131I]IBA-TATE在血液中滞留,且随着血液循环时间的延长,[131I]IBA-TATE从血液中快速清除;而[131I]IPBA-TATE则清除缓慢,在注射24 h后仍有(3.30±0.50)%ID/g,这主要是由于[131I]IPBA-TATE可以和血液中的白蛋白结合.
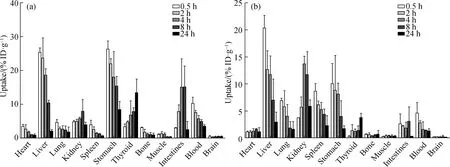
图5 通过尾静脉注射0.5,2,4,8和24 h后[131I]IPBA-TATE(a)和[131I]IBA-TATE(b)在正常BALB/c小鼠中的生物分布
2.4.2 [131I]IPBA-TATE在AR42J荷瘤小鼠中的生物分布
基于正常小鼠中的生物分布情况,选取2和4 h两个时间点对[131I]IPBA-TATE在AR42J荷瘤小鼠主要器官中的生物分布进行分析,结果如图6所示.荷瘤小鼠的生物分布同样显示[131I]IPBA-TATE在肾脏和肝脏中有高摄取,但其具体代谢途径仍需通过排泄实验进一步验证;此外,在胃、脾、肺等器官中的放射性摄取率也较高.该探针在肿瘤中2和4 h的摄取分别为(0.48±0.18)%ID/g和(1.21±0.67)%ID/g,且具有较高的瘤/肉比,分别为3.53±1.44和5.30±2.07.[131I]IPBA-TATE在表达SSTR2的胃和肿瘤中均有明显摄取,证明[131I]IPBA-TATE对SSTR2有一定的亲和力,对AR42J肿瘤有一定的靶向性.血液末端清除半衰期的延长为该探针在靶器官的进一步富集提供了可能.
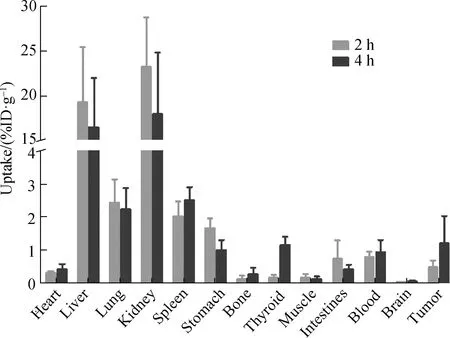
图6 通过尾静脉注射2和4 h后[131I]IPBA-TATE在AR42J荷瘤小鼠中的生物分布
3 结 论
[131I]IPBA-TATE具有标记方法简便、稳定性好等优点,可以有效地和白蛋白进行结合,血液末端清除半衰期约为25.5 h.生物分布显示[131I]IPBA-TATE能有效在肿瘤富集,且具有较高的瘤/肉比.但探针的亲脂性较高,导致其在肝脏中的摄取较高.后续可通过在蛋白结合分子和靶向分子之间引入一定长度的亲水性聚乙二醇,以达到改善探针水溶性的目的,从而降低探针在肝脏中的摄取.总的来说,[131I]IPBA-TATE是一种基于奥曲肽的新型白蛋白亲和探针,有望用于SSTR2阳性肿瘤的SPECT显像及放射性核素131I靶向治疗.
