萝卜ALMT基因家族的鉴定与表达
2022-04-27刘同金徐铭婕汪精磊刘良峰崔群香包崇来王长义
刘同金,徐铭婕,汪精磊,刘良峰,崔群香,包崇来,*,王长义,*
(1.金陵科技学院 园艺园林学院,江苏 南京 210038; 2.浙江省农业科学院 蔬菜研究所,浙江 杭州 310021; 3.江宁区农业农村局,江苏 南京 211100)
铝激活苹果酸转运蛋白(aluminium activated malate transporter,ALMT)是植物中普遍存在的一类膜蛋白,在苹果酸积累和转运、重金属胁迫、矿质营养、渗透势和pH值的调节、果实品质、气孔运动、种子发育等过程中均有重要作用。多数ALMT蛋白定位于细胞质膜、液泡膜等细胞器膜上,其N端的5~7个跨膜结构域参与运输Al激活的苹果酸,C端包含1个位于膜外的维持运输功能所必需的疏水区。
植物中第1个被克隆的ALMT基因是在耐铝小麦根尖中分离的铝诱导表达基因1。此后,多种植物的ALMT基因被陆续克隆并明确了生物学功能。模式植物拟南芥()的ALMT基因家族共14个成员,其中多个基因的功能已被研究报道。1主要在拟南芥的根中表达,其表达水平受铝胁迫、低pH值、过氧化氢和植物激素(ABA和IAA)诱导;抑制该基因的表达导致拟南芥对铝胁迫的抗性降低;此外,甘蓝型油菜()BnALMT1和BnALMT2、绒毛草()HIALMT1、苜蓿()MsALMT1、玉米(L.)ZmALMT2和大豆()GmALMT1均具有介导苹果酸外排、增强植物抵抗铝胁迫的功能。4主要在叶肉和保卫细胞中表达,其编码蛋白定位于液泡膜,介导液泡苹果酸(Mal)的外排;敲除该基因导致拟南芥气孔无法正常关闭,从而对干旱和ABA的抗性降低。6主要在保卫细胞中表达,并受液泡pH值、胞质Ca和苹果酸含量的影响。AtALMT9定位于液泡膜,参与调控气孔的开放。12主要在保卫细胞中表达,参与调控气孔的关闭。苹果()ALMT基因家族成员1和葡萄()9主要在果实中表达,影响其果实酸度。大麦()1在种子发育过程中表达,可能参与种子形成过程中营养物质的分配。大豆()5在低磷环境下显著上调表达,增强了植物对低磷胁迫的耐受性。上述研究结果表明,ALMT基因家族不同成员在植物生长发育过程中具有多种不同的生物学功能。
近年来,多种植物的ALMT基因家族被鉴定。蔷薇科植物中国白梨()、苹果、桃()、草莓()、欧洲梨()和中国李()中分别有27、25、12、16、25和12个ALMT蛋白;大豆、橡胶树()、普通烟草()和甘蓝型油菜基因组中分别有34、17、30和39个ALMT基因。但萝卜中ALMT基因家族的全基因组鉴定尚未见有研究报道。萝卜是我国重要的蔬菜作物,已完成了全基因组测序。萝卜生长发育过程中可能遭受营养元素缺乏、病虫危害、极端温度等生物和非生物胁迫。前人研究表明,ALMT基因在植物抵抗生物和非生物胁迫过程中起重要作用。因此,本研究在全基因组水平对萝卜ALMT基因家族成员进行鉴定,分析其启动子包含的顺式作用元件,并对其在萝卜不同组织中的表达,以及对生物和非生物胁迫的响应进行了分析,研究结果将为萝卜ALMT基因的生物学功能研究奠定基础。
1 材料与方法
1.1 萝卜ALMT家族成员的鉴定与蛋白质理化性质
由TAIR(http://arabidopsis.org/)网站下载拟南芥ALMT家族14个成员的蛋白质序列,在‘XYB36-2’萝卜基因组中执行本地BlastP(E-value=10),获得萝卜ALMT基因家族候选序列;将获得的候选基因在TAIR数据库中进行BlastP搜索,检查获取同源性最高的拟南芥序列是否为ALMT,若不是则排除,最终筛选获得萝卜ALMT家族成员。利用ExPASy(http://web.expasy.org/protparam/)在线软件对萝卜ALMT蛋白质的分子量、等电点等理化性质进行预测和分析;利用TMHMN Server v2.0(http://www.cbs.dtu.dk/services/TMHMM/)网站对萝卜ALMT基因家族成员的跨膜结构进行预测。
1.2 ALMT家族成员染色体定位与基因结构分析
根据‘XYB36-2’萝卜参考基因组信息文件确定ALMT基因的染色体位置和结构信息,使用MapInspect软件进行染色体定位作图;利用在线工具GSDS2.0(http://gsds.gao-lab.org/index.php)对基因外显子-内含子作图。
1.3 ALMT家族成员系统发育树构建
拟南芥ALMT蛋白质序列由TAIR(http://arabidopsis.org/)网站下载,橡胶树ALMT蛋白质序列来源于Ma等。使用MEGA5.05的ClustalW进行序列比对,邻接法(NJ,Neighbor-Joining)构建系统发育树,Bootstrap设置为1 000次。
1.4 ALMT家族成员启动子顺式作用元件分析
利用TBtools软件提取萝卜ALMT基因起始密码子上游1 500 bp序列作为启动子区域,通过PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcarehtml)的‘Search for CARE’工具预测基因启动子区的顺式作用元件。
1.5 萝卜ALMT基因家族成员的表达分析
根据前人发表的‘XYB36-2’萝卜5个不同发育时期(芽期、破肚期、膨大前期、膨大盛期和成熟期)的肉质根和5种不同组织(薹、愈伤组织、花、叶和角果)的转录组数据获得萝卜ALMT家族成员的表达量(FPKM)数据,分析其在萝卜不同组织中的表达特性。根据前人报道的绿皮绿肉和白皮白肉萝卜5个发育时期肉质根根肉的转录组数据,分析萝卜ALMT家族成员在不同根肉色萝卜中的表达差异;利用接种7 d后,抗、感萝卜自交系下胚轴的转录组数据,分析萝卜ALMT家族成员对生物胁迫的响应。利用前人报道的铬(600 mg·LKCrO)、镉(0.876 mmol·LCdCl·2.5HO)和铅[1 000 mg·LPb(NO)]胁迫萝卜根的转录组数据,分析萝卜ALMT家族成员对重金属胁迫的响应。转录组表达数据经log均一化处理,利用TBtools软件绘制表达热图。
2 结果与分析
2.1 萝卜ALMT家族成员鉴定
从‘XYB36-2’萝卜基因组中共鉴定出17个ALMT基因,根据其在染色体上的位置依次命名为1~17(表1)。RsALMT序列的氨基酸数量为404(RsALMT9)~621(RsALMT3)aa。萝卜ALMT蛋白质分子量为45.923 80~70.102 62 ku,预测等电点为6.11~9.10;不稳定指数为30.84~46.06;除RsALMT2/7/11/12/13/14/16外,萝卜ALMT家族的其他成员均为稳定蛋白;亲水性在-0.174~0.067;脂肪指数为86.60~104.03。预测萝卜ALMT家族成员N端包含5~6个跨膜结构域。
用萝卜的ALMT候选基因序列比对TAIR数据库,获得了在拟南芥中同源性最高的基因(表1)。在萝卜基因组中未鉴定到168600和417585的同源基因;8个在萝卜中仅有1个同源基因,3个在萝卜中有2个同源基因,400910在萝卜中有3个同源基因。
2.2 萝卜ALMT家族基因的染色体定位
根据‘XYB36-2’参考基因组的注释信息将ALMT家族的17个成员定位于萝卜的8条染色体(图1)。它们在染色体上的分布不均匀,1号染色体上的基因数量最多,含有4个ALMT基因;4、6和8号染色体上分别有3个ALMT基因;2、3、5和9号染色体各分布有1个ALMT基因;而7号染色体上无ALMT基因。位于8号染色体的15和16在基因组上的位置相近,可能发生了串联复制。
2.3 萝卜ALMT家族基因的基因结构与系统进化
萝卜ALMT家族基因外显子数量为5~7个(图2),12个成员含有6个外显子,4个成员(2、4、5和10)含有5个外显子,仅1个成员(12)含有7个外显子。为进一步研究萝卜、拟南芥和甘蓝型油菜ALMT家族成员的系统进化关系,利用其蛋白质全长构建系统进化树(图3),并结合前人报道,可将17个分成5类:第Ⅰ类包含5个基因,即1、3、11、12和14;第Ⅱ类包含5、6和17共3个基因;第Ⅲ类包含2、7和8共3个基因;第Ⅳ类包含4和10共2个基因;第Ⅴ类包含9、13、15和16共4个基因。
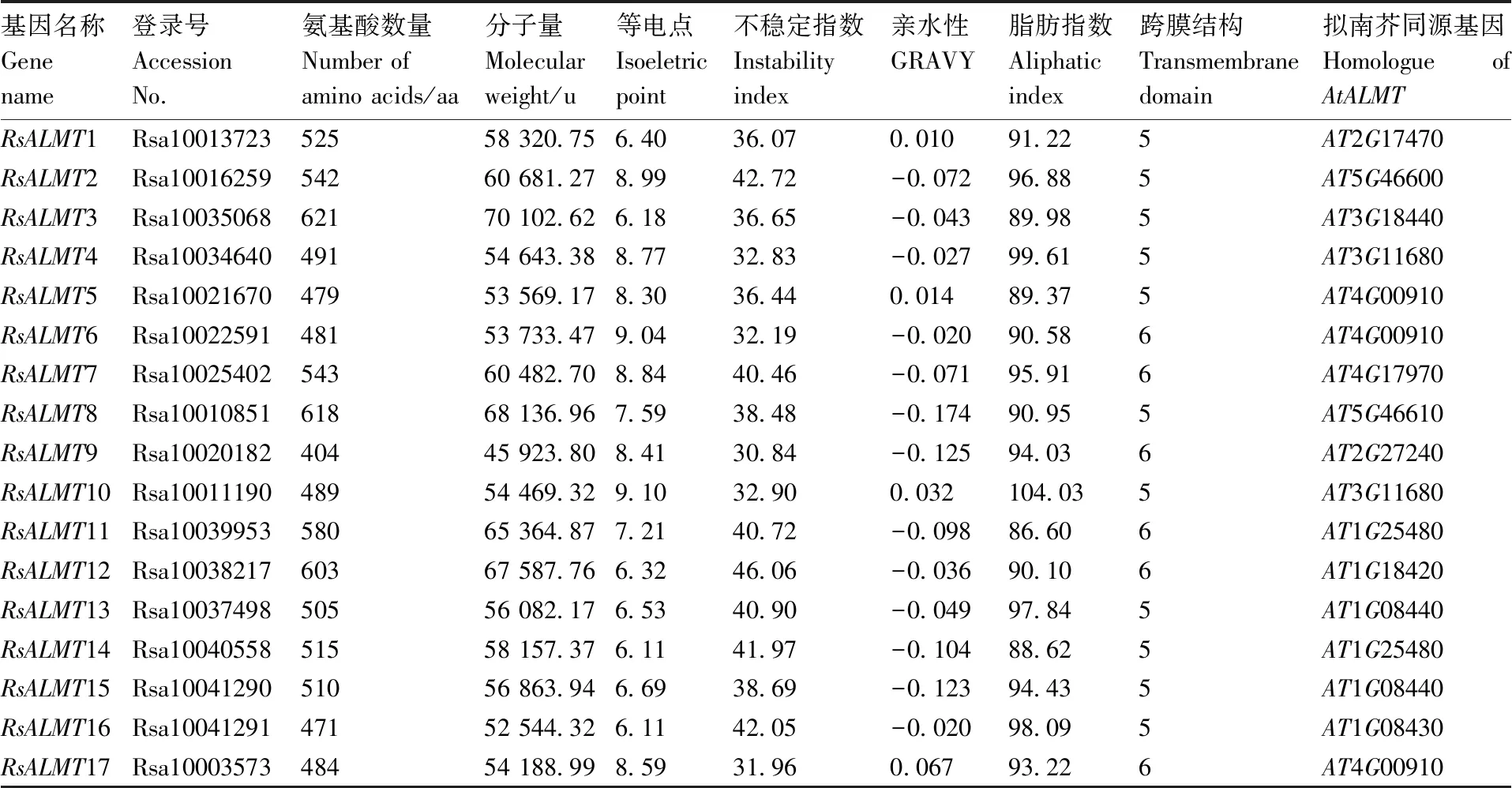
表1 萝卜ALMT家族成员基本信息
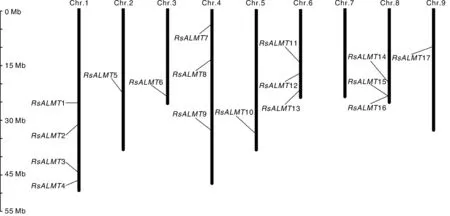
图1 萝卜ALMT基因家族成员的染色体定位Fig.1 Chromosomal position of the ALMT gene family members in radish
2.4 萝卜ALMT家族基因启动子顺式作用元件分析
对萝卜ALMT基因家族成员的启动子序列进行顺式作用元件预测,共发现28类主要的顺式作用元件(图4)。包括多种参与激素响应的顺式作用元件,如参与生长素响应的AuxRR-core和TGA-elemene,参与脱落酸响应的ABRE,参与赤霉素响应的GARE-motif、P-box和TATC-box,参与水杨酸响应的TCA-element,参与茉莉酸甲酯响应的TGACG-motif和CGTCA-motif;也包含较多参与胁迫响应的顺式作用元件,如脱水、低温和盐胁迫响应元件DRE,抗性和胁迫响应元件TC-rich repeats,干旱诱导响应元件MBS,低温响应元件LTR,损伤响应元件WUN-motif,厌氧诱导元件ARE,参与缺氧型特异性诱导的增强子GC-motif;此外,还包括一些参与组织和器官生长发育、环境响应的顺式作用元件(图4)。厌氧诱导元件ARE在萝卜ALMT家族所有成员的启动子中均存在;7启动子中含有的顺式作用元件种类最少,共6类,而9启动子中含有的顺式作用元件种类最多,达22类(图4)。
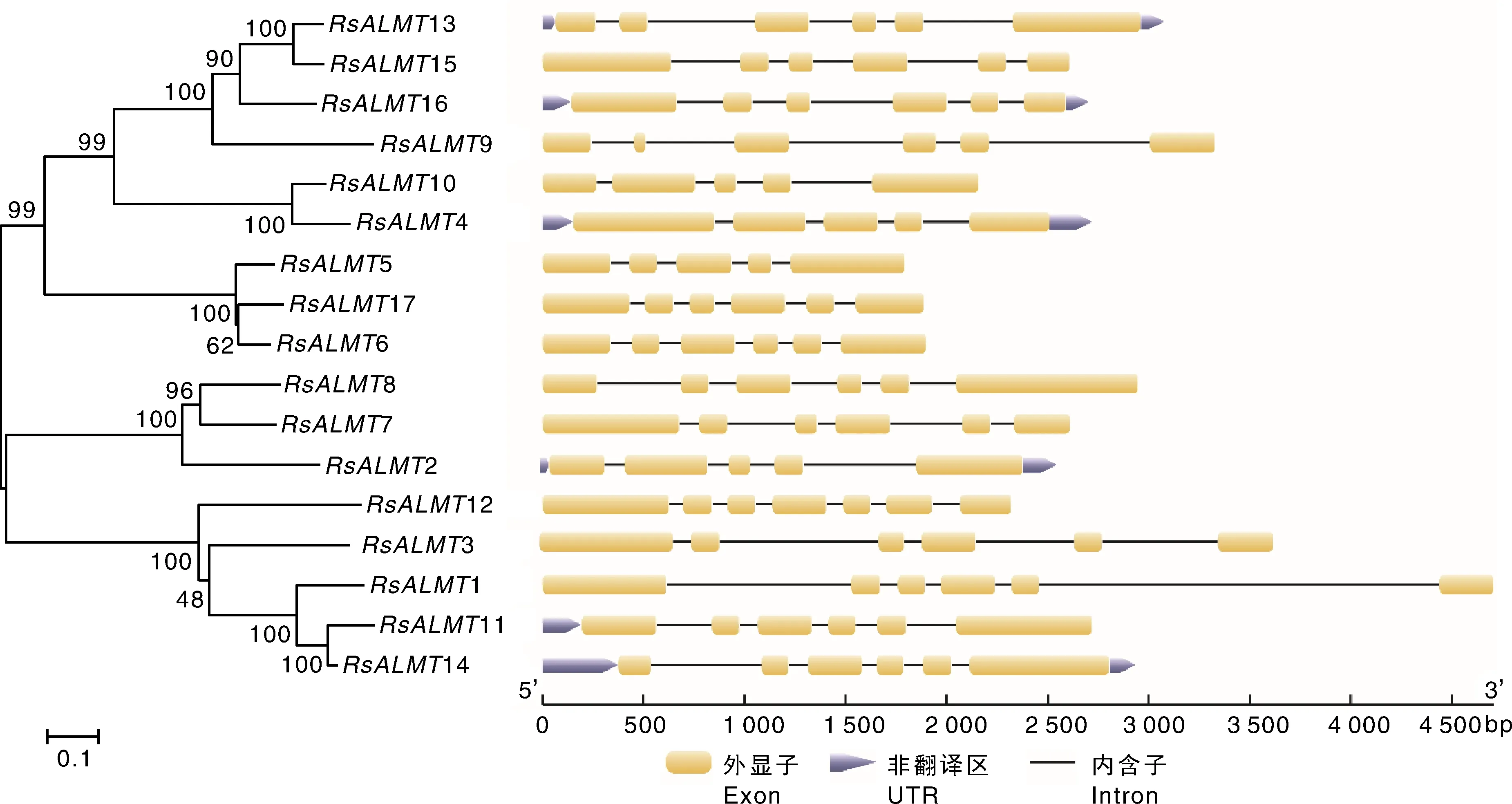
图2 萝卜ALMT基因家族成员进化树与基因结构Fig.2 Phylogenetic tree and exon distribution of ALMT family members in radish
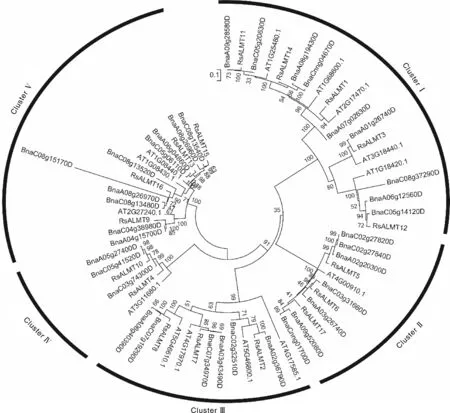
图3 萝卜(Rs)、拟南芥(AT)与甘蓝型油菜(Bna)ALMT基因家族成员编码的蛋白质进化树Fig.3 Phylogenetic tree of proteins coded by ALMT gene family members in Raphanus sativus(Rs), Arabidopsis(AT) and Brassica napus(Bna)
2.5 萝卜ALMT家族基因表达分析
为了明确基因的组织和时期表达模式,利用转录组数据分析其在肉质根5个不同发育时期(芽期、破肚期、膨大前期、膨大盛期和成熟期)、叶片、薹、花、角果和愈伤组织的表达模式(图5)。结果显示,不同组织中的表达量有显著差异。5、6、10和17在所有组织中均未检测到表达;2、3、7、11、12和14在所检测的组织中均表达;2主要在膨大盛期和成熟期的肉质根、叶片和薹中表达,且在叶片中的表达量最高;7在萝卜叶片中的表达量最高;4主要在萝卜薹和角果中表达;8和9仅在花中有较低的表达量,其他组织中不表达;1仅在萝卜破肚期的肉质根中有较低的表达量;16在萝卜愈伤组织中的表达量最高,而在叶片、薹和花中不表达。
分析绿皮绿肉和白皮白肉萝卜5个发育时期根肉中的表达发现,在同一品种萝卜肉质根不同发育时期的表达水平有显著差异(图6)。1、4、5、6、10和17在2种萝卜根肉中均不表达;3、9、12和14在绿肉和白肉萝卜5个不同发育时期的根肉中均有较高的表达量;15在绿萝卜根肉S1~S4时期的表达水平显著高于S5时期和白萝卜5个时期的表达。
2.6 生物和非生物胁迫对萝卜ALMT家族基因表达的影响

图4 萝卜ALMT基因家族成员启动子顺式作用元件预测Fig.4 Predicted cis-elements in RsALMT promoters

ESS、SS、EES、RES和MS分别为芽期、破肚期、膨大前期、膨大盛期和成熟期。ESS, seedling stage; SS, splitting stage; EES, early expanding stage; RES, rapid expanding stage; MS, mature stage.图5 萝卜ALMT基因家族成员的组织表达模式Fig.5 Expression profiles of RsALMT genes in various tissues

S1,9月25日,S2,10月2日,S3,10月9日,S4,10月16日,S5,10月23日。S1, September 25th; S2, October 2nd; S3, October 9th; S4, October 16th; S5, October 23th.图6 绿肉萝卜与白肉萝卜不同发育时期肉质根ALMT基因家族成员的表达Fig.6 Expression profiles of RsALMT genes in different growing stage of taproot of white and green flesh
为了解对生物胁迫的响应,本研究利用前人发表的转录组数据比较了其在抗、感根癌病萝卜高代自交系接种7 d后下胚轴中的表达(图7)。2、8、9和10在所有样本中均不表达;3、7和15在所有样本中的表达量均较低;4、11、12和14在所有样本中表达量均较高,但侵染对其表达无显著影响。接种7 d后抗、感株系1和16均显著上调表达,其中,1在抗性材料中的表达量是感病材料的29倍;接种7 d后抗性株系13表达量上调6.5倍,而感病材料该基因表达量显著下调。侵染显著抑制了5和6的表达。因此,1、5、6和16响应侵染过程中的功能值得深入研究。
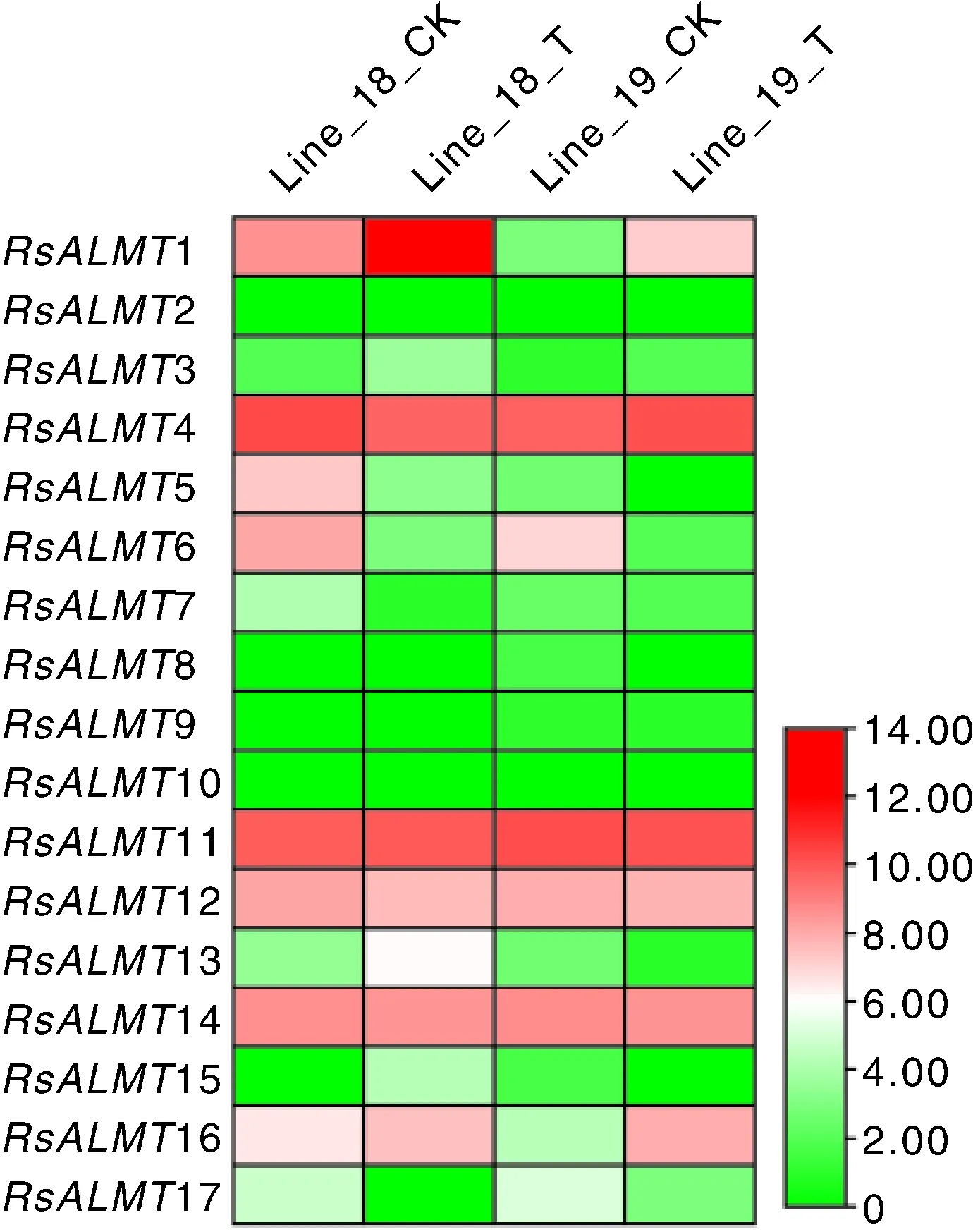
Line_18和Line_19分别为抗和感根癌病萝卜株系;CK为接种LB培养基7 d,T为接种A. tumefaciens处理7 d。Line_18 and Line_19 was resistance and susceptible radish inbred lines to A. tumefaciens, respectively. CK, 7 d after incubated with LB medium; T, 7 d after incubated with A. tumefaciens.图7 抗和感根癌病萝卜接种A. tumefaciens 7 d后下胚轴ALMT基因家族成员的表达Fig.7 Expression profiles of ALMT gene family members in 7 d after incubated with A. tumefaciens of hypocotyls
为了解对重金属胁迫的响应,对其在铅、镉和铬胁迫处理萝卜根中的表达进行分析(图8),发现其在萝卜高代自交系‘NAU-RG’根中的表达量均较低,铬胁迫抑制了3和14的表达,镉和铬处理均显著抑制11的表达,铅胁迫诱导16显著上调表达。
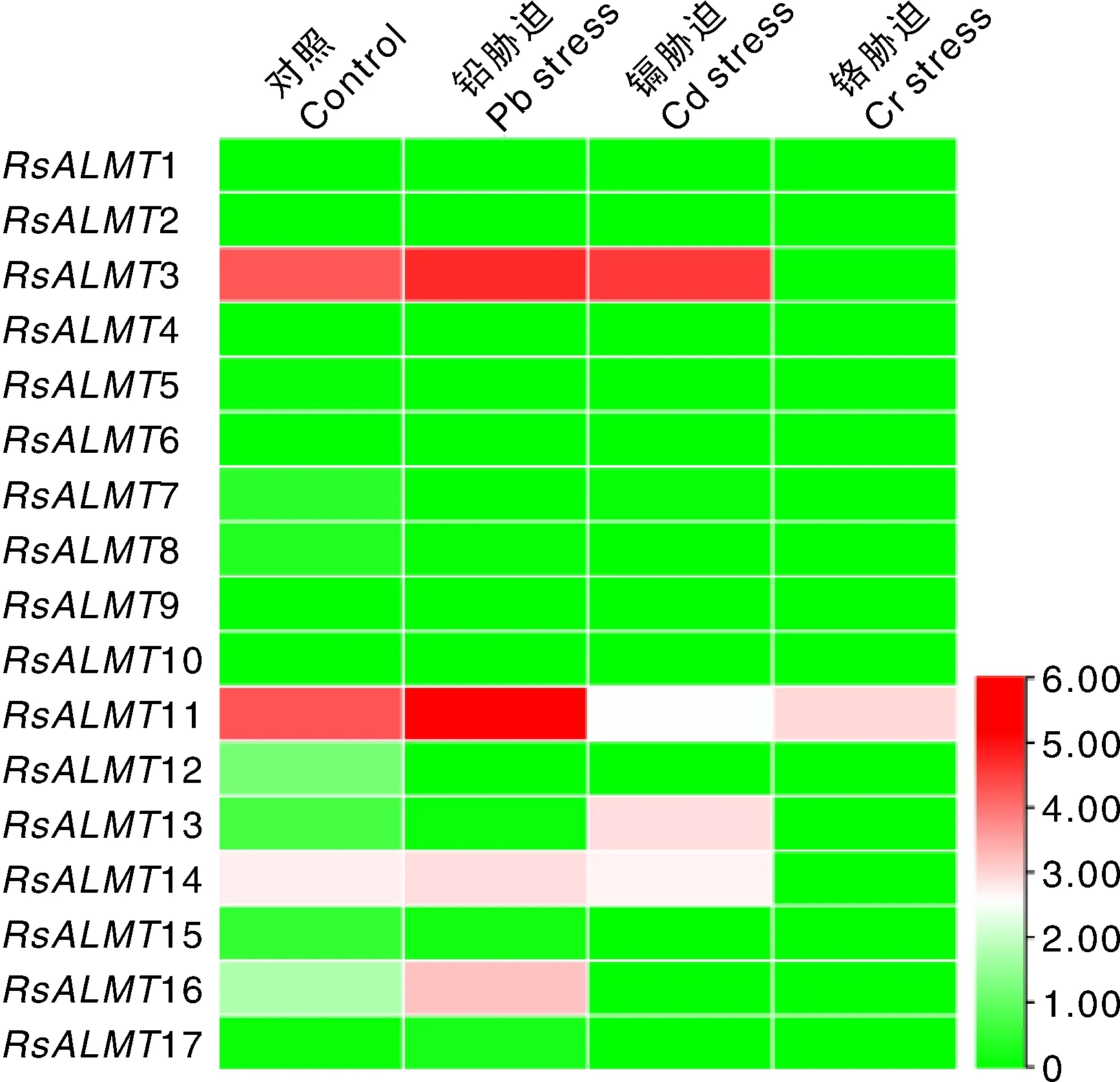
图8 重金属(铅、镉和铬)胁迫萝卜根中ALMT基因家族成员的表达Fig.8 Expression profiles of ALMT gene family members in radish root with heavy metal (lead, cadmium and chromium) stress treatment
3 结论与讨论
本研究通过萝卜ALMT基因的全基因组鉴定与表达分析,预测了部分基因的功能,为进一步研究其生物学功能奠定了基础。ALMT基因参与了植物矿质营养吸收、抵抗重金属胁迫、果实酸度调控、保卫细胞的运动等多种生理过程。自植物第一个ALMT基因(1)在耐铝小麦根尖中被克隆之后,越来越多ALMT基因的生物学功能被揭示。然而,萝卜中ALMT基因家族成员的鉴定和功能研究尚未见有研究报道。本研究基于萝卜‘XYB36-2’参考基因组数据,采用生物信息学分析方法,对萝卜ALMT基因家族成员进行鉴定,并对其理化性质、跨膜结构域数目、染色体定位、基因结构和启动子顺势作用元件进行了分析。同时,利用前人发表的转录组数据分析了萝卜不同组织ALMT的表达及其对不同非生物胁迫的响应。
萝卜基因组中共有17个基因,数量与橡胶树一致;多于桃和中国李(12)、拟南芥(14)和草莓(16);但比苹果和欧洲梨(25)、中国白梨(27)、普通烟草(30)和大豆(34)数量少。仅1个基因在萝卜中有3个同源基因,多数基因在萝卜中有1个同源基因,表明该基因家族在基因组多倍化之后出现了丢失。萝卜ALMT家族成员N端包含5~6个跨膜结构域,这一结果与前人报道的苹果(6~7个)、烟草(4~6个)和橡胶树(5~7个)的结果基本一致。萝卜中的ALMT家族基因在9条染色体上不均匀分布,这与前人报道的其他物种ALMT家族成员在染色体上的分布结果一致。外显子数量为5~7个,与橡胶树(5~8个)和烟草(6个)结果相似,但苹果中ALMT基因家族成员外显子数量变化较大,为4~12个。
萝卜ALMT基因家族成员的启动子序列包含多种响应激素、胁迫和环境信号的顺式作用元件(图3),这与前人在其他物种中的研究结果一致。Ma等发现,橡胶树ALMT基因家族成员启动子序列包含较多的响应生物与非生物胁迫的顺式作用元件,如ERE、W box、TC-rich repeats、LTR、MBS、ABRE和GARE-motif等。Xu等研究结果也表明,中国白梨ALMT基因启动子普遍存在响应植物激素(SA、ABA、GA和CK)、环境信号、生物和非生物胁迫的顺式作用元件。其他研究也发现,ALMT的表达受植物激素、重金属和环境条件的调控。上述结果表明,不同植物中ALMT基因的表达调控机制可能具有一定的相似性。
研究表明,不同物种间同源基因在进化过程中多数保留了相同或相似的功能,基因的表达模式也与其生物学功能密切相关。本研究发现,基因在萝卜不同组织和发育时期中的表达,以及对生物和非生物胁迫的响应有显著差异。1在拟南芥中的同源基因6主要在保卫细胞中表达,可能参与气孔的运动,且功能与其他成员存在冗余;本研究发现萝卜中该基因主要在下胚轴表达,不响应镉、铬和铅的胁迫,但接种7 d显著诱导其上调表达,抗性材料中的表达量是感病材料的29倍,推测该基因在萝卜中进化出了抵抗根癌病的功能,而其调控气孔运动的功能被其他基因代替。接种7 d后抗性株系13表达量上调6.5倍,而感病材料该基因表达量显著下调,推测1和13在萝卜抵抗侵染过程中发挥重要作用。除下胚轴外,3在萝卜不同组织表达量均较高,其同源基因9参与调控拟南芥叶片气孔的开放,萝卜中该基因在进化过程中可能保留了此功能,但在其他组织中高表达的原因需要深入研究。7在萝卜叶片中的表达量最高(图4),其在拟南芥中的同源基因12在叶片中的表达量是根中的10倍,调控叶片气孔的关闭,推测7进化过程中保留了相同的功能。11和14均为拟南芥4的同源基因,可能参与萝卜气孔的关闭。本研究发现,15在绿萝卜根肉的表达水平显著高于白萝卜,该基因是否参与绿肉萝卜根肉中叶绿素的积累需要进一步的研究。16在萝卜愈伤组织中的表达量最高,其在拟南芥中的同源基因1主要在根中表达,参与对生物和非生物胁迫的抵抗;萝卜和拟南芥中该基因表达的组织不一致,16的功能值得进一步研究。研究表明,1在植物抵抗重金属胁迫过程中发挥重要作用,如拟南芥1、油菜1和2、小麦1、苜蓿1和大豆1在抵御铝胁迫过程中发挥重要作用。本研究发现铅胁迫诱导16显著上调表达,该基因是否调控萝卜对铅胁迫的抗性需要进一步研究。
