枸杞子中4种类胡萝卜素成分含量测定一测多评法的建立
2022-04-27陈欢马玲苏晓娟李艳婷马霞马学琴
陈欢 马玲 苏晓娟 李艳婷 马霞 马学琴


中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2022)08-0957-05
DOI 10.6039/j.issn.1001-0408.2022.08.09
摘 要 目的 建立同时测定枸杞子中玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯含量的方法。方法 枸杞子药材经正己烷-无水乙醇-丙酮-甲苯(10 ∶ 6 ∶ 7 ∶ 7,V/V/V/V)超声提取后,采用高效液相色谱法进行测定。以YMC C30为色谱柱,以甲醇-乙腈-水(81 ∶ 14 ∶ 5,V/V/V)为流动相A、二氯甲烷为流动相B进行梯度洗脱,柱温为20 ℃,流速为1.0 mL/min,检测波长为450 nm,进样量为20 μL。以玉米黄质为参照物,计算β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的相对校正因子,再以此计算上述成分的含量,并与外标法测定结果进行比较。结果 玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯检测质量浓度的线性范围分别为0.119 4~2.983 8、0.121 7~1.521 6、0.285 9~5.718 8、8.460 5~211.513 3 μg/mL(R2均大于0.999);精密度、重复性、稳定性(16 h)试验的RSD均小于4%;平均加样回收率分别为103.34%、107.37%、105.64%、96.16%(RSD<5%,n=9)。β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的平均相对校正因子分别为1.109、1.390、1.158;一测多评法与外标法所测上述成分含量的相对误差均在±1%之内。结论 本研究所建立的高效液相色谱法联合一测多评法准确、稳定,可用于枸杞子中4种类胡萝卜素成分的含量测定及质量控制。
关键词 枸杞子;高效液相色谱法;一测多评法;玉米黄质;β-胡萝卜素;β-隐黄素棕榈酸酯;玉米黄素双棕榈酸酯
Establishment of quantitative analysis of multi-components by singer marker for content determination of 4 carotenoids in Lycium barbarum
CHEN Huan1,2,MA Ling1,SU Xiaojuan3,LI Yanting3,MA Xia1,MA Xueqin3(1. Ningxia Hui Autonomous Region Institute of Drug Control,Yinchuan 750002,China;2. Ningxia Key Laboratory of Drug Creation and Generic Drug Research, Yinchuan 750004,China;3. College of Pharmacy,Ningxia Medical University,Yinchuan 750004,China)
ABSTRACT OBJECTIVE To establish a method for simultaneous determination of zeaxanthin, β-carotene, β-cryptoxanthin palmitate and zeaxanthin dipalmitate in Lycium barbarum. METHODS L. barbarum was extracted with n-hexane-anhydrous ethanol-acetone-toluene (10 ∶ 6 ∶ 7 ∶ 7, V/V/V/V) by ultrasonic method. High performance liquid chromatography (HPLC) method was adopted. The determination was performed on YMC C30 column with mobile phase A consisted of methanol-acetonitrile-water (81 ∶ 14 ∶ 5, V/V/V) and mobile phase B consisted of dichloromethane (gradient elution) at the flow rate of 1.0 mL/min. The column temperature was set at 20 ℃. The detection wavelength was set at 450 nm, and sample size was 20 μL. Using zeaxanthin as control, the relative correction factors (RCFs) of β-carotene, β-cryptoxanthin palmitate and zeaxanthin dipalmitate were calculated, and then the content of each component was calculated according to RCFs and compared with the results of external standard method(ESM). RESULTS The linear range of zeaxanthin, β-carotene, β-cryptoxanthin palmitate and zeaxanthin dipalmitate were 0.119 4-2.983 8, 0.121 7-1.521 6, 0.285 9-5.718 8, 8.460 5-211.513 3 μg/mL(all R2>0.999). RSDs of precision, repeatability and stability(16 h) tests were all less than 4%. The average recoveries were 103.34%, 107.37%, 105.64%, 96.16%(RSD<5%, n=9). The average RCFs of β-carotene, β-cryptoxanthin palmitate and zeaxanthin dipalmitate were 1.109, 1.390, 1.158. The relative errors of the content determination results by quantitative analysis of multi-components by singer marker (QAMS) and ESM were within ±1%. CONCLUSIONS The established HPLC-QAMS method is accurate and stable, which can be used for the content determination and quality control of 4 carotenoids in L. barbarum.
KEYWORDS Lycium barbarum; HPLC; QAMS; zeaxanthin; β-carotene; β-cryptoxanthin palmitate; zeaxanthin dipalmitate
类胡萝卜素是中药枸杞子所含的主要色素,也是其重要的活性成分之一,具有提高人体免疫功能、抗肿瘤、抗氧化、护肝、保护视力等作用[1-5]。枸杞子中含有β-胡萝卜素、玉米黄质等游离类胡萝卜素和玉米黄素双棕榈酸酯、β-隐黄素棕榈酸酯等类胡萝卜素酯成分,其中玉米黄素双棕榈酸酯的含量最高[6-8]。枸杞子中类胡萝卜素的质量控制以多指标含量测定为主,采用外标法需要多个对照品,而该类对照品价格昂贵且其溶液稳定性不佳,使得实验成本较高。一测多评法是借助单一对照品(参照物)测定样品中多个成分(待测成分)含量的分析方法,能够较好地解决中药质量控制中对照品缺乏这一问题[9-10]。基于此,本研究采用高效液相色谱法联合一测多评法,建立同时测定枸杞子中玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯含量的方法,并与外标法测定结果进行比较,旨在为枸杞子中类胡萝卜素的质量控制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260型高效液相色谱仪(美国Agilent公司),e2695型高效液相色谱仪(美国Waters公司),UltiMate 3000型高效液相色谱仪(美国Thermo Fisher Scientific公司),XPE26型百万分之一电子天平(瑞士Mettler Toledo公司),CQ-200B-DST型超声波清洗仪(上海跃进医用光学器械厂)等。
1.2 主要药品与试剂
β-胡萝卜素对照品[批号100445-201802,纯度29.8%(以C40H56计,供高效液相色谱法测定)]购自中国食品药品检定研究院;玉米黄质对照品(批号AF8062716,纯度98.80%)购自成都埃法生物科技有限公司;玉米黄素双棕榈酸酯对照品(批号0309S,纯度72.76%)购自法国Extrasynthese公司;β-隐黄素棕榈酸酯对照品(批号2017.06.12,纯度98.6%)购自瑞士Carote Nature公司;正己烷、甲醇、乙腈、二氯甲烷均为色谱纯,无水乙醇、丙酮、甲苯、二丁基羟基甲苯(butylated hydroxy toluene,BHT)均为分析纯,水为超纯水。
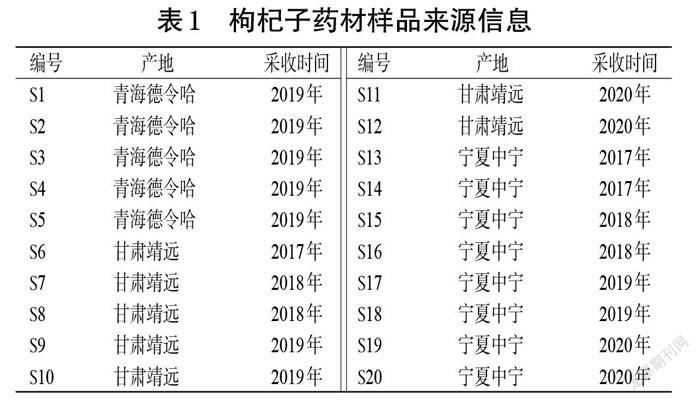
20批次枸杞子药材样品来源信息见表1。各样品经宁夏医科大学马学琴教授鉴定,均为茄科植物枸杞Lycium barbarum L.的干燥果实。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品储备液 于避光条件下,精密称取玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯对照品各适量,加二氯甲烷溶解,制成上述4种成分质量浓度分别为5.967 5、3.043 2、28.594 0、846.053 3 μg/mL的单一对照品储备液。
2.1.2 混合对照品溶液 于避光条件下,精密量取“2.1.1”项下各单一对照品储备液1 mL,置于同一10 mL量瓶中,用含0.1%BHT的无水乙醇稀释至刻度,摇匀,即得玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯质量浓度分别为0.596 8、0.304 3、2.859 4、84.605 3 μg/mL的混合對照品溶液。
2.1.3 供试品溶液 于避光条件下,取枸杞子药材,粉碎,取粉末约1 g,精密称定,置于具塞锥形瓶中,精密加入混合溶剂[正己烷-无水乙醇-丙酮-甲苯(10 ∶ 6 ∶ 7 ∶ 7, V/V/V/V),下同]20 mL,密塞,称定质量,超声(频率28 kHz,功率200 W)处理30 min,放冷,再次称定质量,用混合溶剂补足减失的质量,摇匀,滤过,取续滤液2 mL,置于5 mL量瓶中,用含0.1%BHT的无水乙醇稀释至刻度,摇匀,即得供试品溶液。
2.2 色谱条件
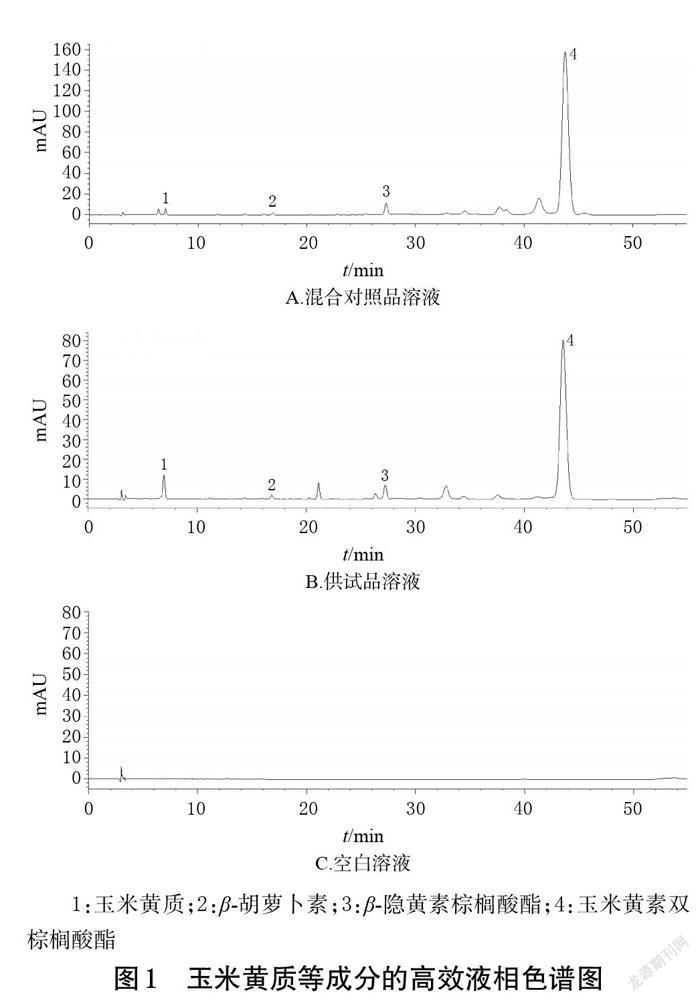
以YMC C30(4.6 mm×250 mm,5 μm)为色谱柱,以甲醇-乙腈-水(81 ∶ 14 ∶ 5,V/V/V)为流动相A、二氯甲烷为流动相B进行梯度洗脱(0~20 min,70%A→50%A;20~48 min,50%A;48~50 min,50%A→70%A;50~55 min,70%A);柱温为20 ℃;流速为1.0 mL/min;检测波长为450 nm;进样量为20 μL。在该色谱条件下,混合对照品溶液、供试品溶液(编号S20)和空白溶液(混合溶剂)的高效液相色谱图见图1。
2.3 方法学考察
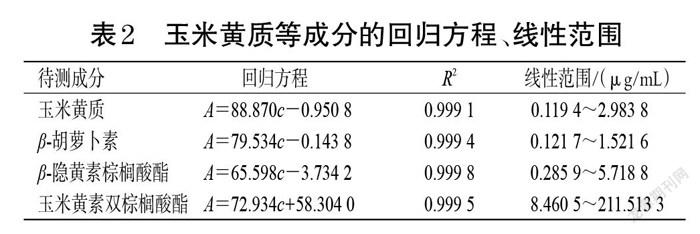
2.3.1 线性关系考察 精密量取玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯对照品储备液1、2、0.5、0.5 mL,各4份,置于同一50、25、10、5 mL量瓶中,用含0.1%BHT的无水乙醇稀释至刻度,作为线性1、2、3、4溶液;精密量取上述对照品储备液5、5、2、2.5 mL,置于10 mL量瓶中,用含0.1%BHT的无水乙醇稀释至刻度,作为线性5溶液。取各线性溶液,按“2.2”项下色谱条件进样测定,记录峰面积。以峰面积为纵坐标(A)、质量浓度为横坐标(c)绘制标准曲线,结果见表2。
2.3.2 检测限和定量限试验 精密量取“2.1.2”项下混合对照品溶液,用含0.1%BHT的无水乙醇定量稀释成适宜浓度的溶液,按“2.2”项下色谱条件进样测定,分别以信噪比3 ∶ 1和10 ∶ 1计算检测限和定量限。结果显示,玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的检测限分别为0.017 9、0.036 5、0.085 8、0.112 8 μg/mL,定量限分别为0.059 7、0.121 7、0.285 9、0.282 0 μg/mL。
2.3.3 精密度试验 精密吸取“2.1.3”项下供试品溶液,按“2.2”项下色谱条件连续进样测定6次,记录峰面积。结果显示,玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯峰面积的RSD分别为1.57%、1.41%、0.82%、0.94%(n=6),表明方法精密度良好。
2.3.4 重复性试验 精密称取同一批次枸杞子样品(编号S20)6份,按“2.1.3”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并代入回归方程计算各成分含量。结果显示,玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的含量分别为28.834、10.944、85.390、4 046.932 μg/g,RSD分别为1.35%、3.84%、3.81%、1.17%(n=6),表明方法重复性良好。
2.3.5 稳定性试验 取同一供试品溶液(编号S20),分别在室温下放置0、2、4、8、12、16 h时按“2.2”项下色谱条件进样测定,记录峰面积。结果显示,玉米黄质、β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯峰面积的RSD分别为2.43%、0.72%、1.68%、0.45%(n=6),表明供试品溶液在室温下放置16 h内稳定性良好。
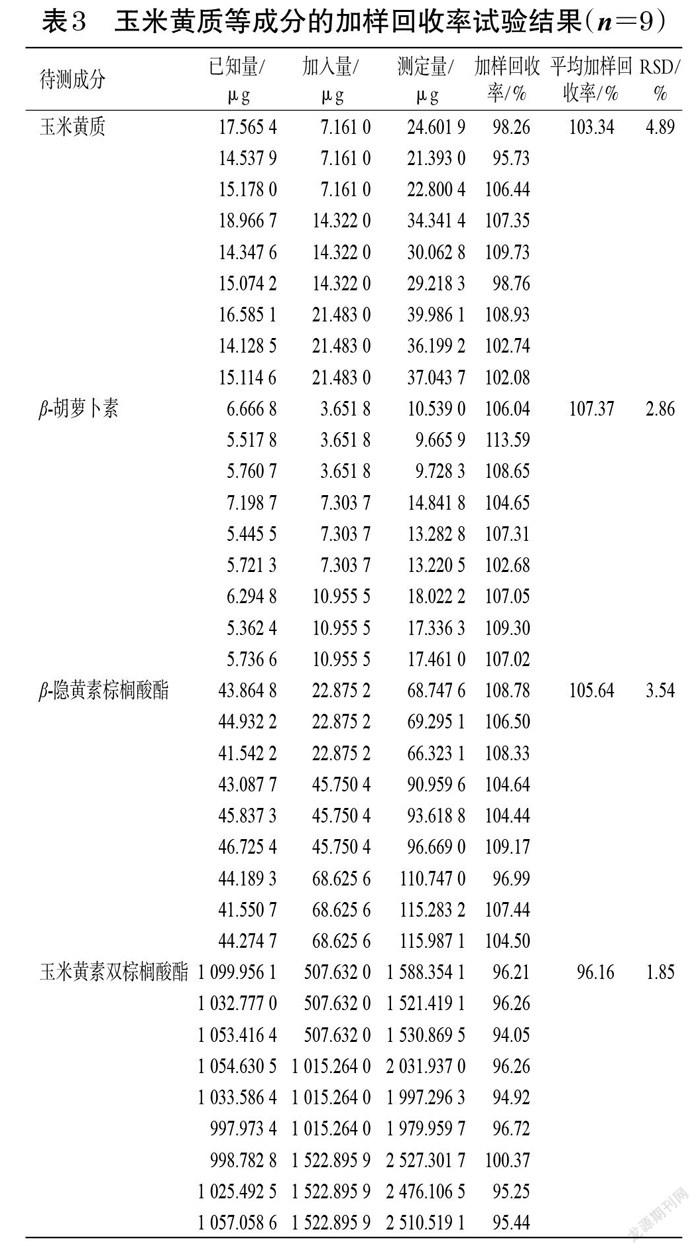
2.3.6 加样回收率试验 取已知含量的枸杞子样品(编号S20)9份,精密称定,分别按低、中、高质量浓度加入“2.1.1”项下对照品储备液适量,按“2.1.3”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
2.4 相对校正因子的确定
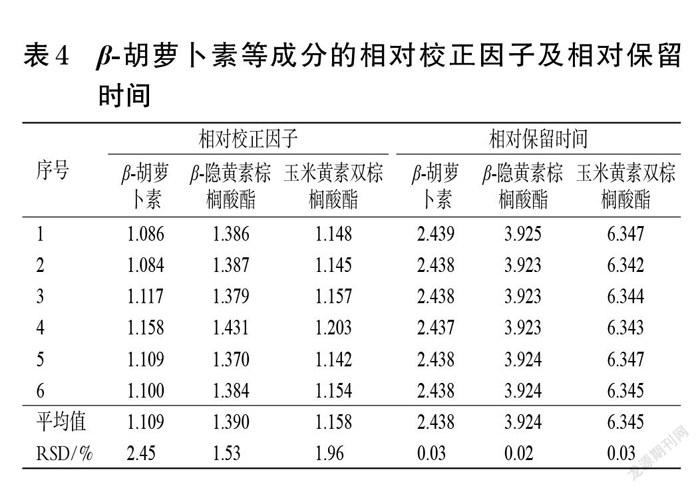
2.4.1 相对校正因子的计算 取“2.1.2”项下混合对照品溶液,按“2.2”项下色谱条件进样测定6次,以玉米黄质(对照品易获得且价格相对便宜)为参照物,计算β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的相对校正因子(fsi):fsi=fs/fi=(As/cs)/(Ai/ci)(式中,As为参照物的峰面积,cs为参照物的质量浓度,Ai为待测成分的峰面积,ci为待测成分的质量浓度)[11]。结果见表4。
2.4.2 色谱峰的定位 采用相对保留时间法对待测成分进行色谱峰定位。取“2.1.2”项下混合对照品溶液,按“2.2”项下色谱条件进样测定6次,以玉米黄质为参照物,计算β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的相对保留时间(ris):ris=tRi/tRs(式中,tRs为参照物的保留时间,tRi为待测成分的保留时间)。结果见表4。
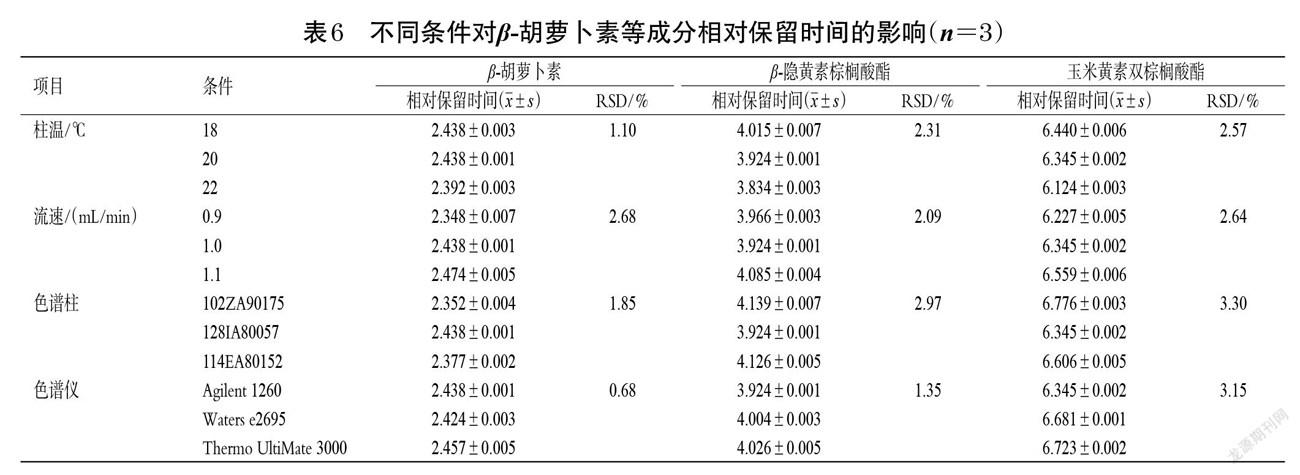
2.4.3 耐用性考察 分别对柱温(18、20、22 ℃)、流速(0.9、1.0、1.1 mL/min)、YMC C30色谱柱(序列号102ZA90175、128IA80057、114EA80152)、色谱仪(Agilent 1260、Waters e2695、Thermo UltiMate 3000)进行耐用性考察,取“2.1.2”项下混合对照品溶液,按“2.2”项下色谱条件进样测定3次,计算β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的相对校正因子和相对保留时间,结果见表5、表6。
2.5 样品测定
取20批枸杞子样品,按“2.1.3”项下方法制备供试品溶液,平行制备3份,按“2.2”项下方法进样测定,記录峰面积。以玉米黄质为参照物,按一测多评法计算β-胡萝卜素、β-隐黄素棕榈酸酯、玉米黄素双棕榈酸酯的含量,并与外标法测定结果(玉米黄质除外)进行比较,计算相对误差(relative error, RE):RE=(WQAMS-WESM)/WESM×100%(式中,WESM为外标法测得的成分含量,WQAMS为一测多评法测得的成分含量)[12]。结果显示,20批样品两种方法测定结果的RE均在±1%范围内,表明两者无明显差异,结果见表7。
3 讨论
3.1 参照物的选择
类胡萝卜素酯成分的对照品不易获得且价格昂贵,故未选择;玉米黄质和β-胡萝卜素的对照品较易获得,但β-胡萝卜素的峰面积较小,且在部分样品中未被检出,而玉米黄质在所有样品中均被检出且峰面积适中,故选择玉米黄质作为参照物。
3.2 流动相的考察
枸杞子中类胡萝卜素成分较多,等度洗脱无法实现基线分离,故考虑采用梯度洗脱。在前期预实验中,本课题组以甲醇、乙腈、水为流动相,对其分离效果进行了考察,结果发现,上述流动相无法洗脱出类胡萝卜素酯等成分,因类胡萝卜素酯极性较小,故考虑在流动相中加入弱极性溶剂,遂进一步对甲基叔丁基醚、四氢呋喃、异丙醇、乙酸乙酯及二氯甲烷的分离效果进行了考察,结果发现,当流动相中加入二氯甲烷时,各待测成分色谱峰的峰形及分离度均较好。
3.3 提取方法的考察
本课题组借助单因素实验系统考察了提取溶剂、提取方法及时间、料液比对提取效率的影响。结果显示,当溶剂为正己烷-无水乙醇-丙酮-甲苯(10 ∶ 6 ∶ 7 ∶ 7,V/V/V/V)、料液比为1 ∶ 20(g/mL)、超声提取时间为30 min时,提取效率最高,故以上述方法作为供试品溶液的提取方法。
3.4 样品二步稀释溶剂的考察
本课题组在前期实验中发现,样品提取后直接进样,玉米黄质的色谱峰峰形较差,且样品提取溶剂与对照品提取溶剂不一致,使得玉米黄质回收率较低,故考虑对样品进行二步稀释。本课题组在预实验中考察了含0.1%BHT的无水乙醇、正己烷、丙酮、甲苯、甲醇、乙腈等稀释溶剂对待测成分色谱峰的影响。结果显示,当使用不同的稀释溶剂时,所得色谱图中各色谱峰的响应值不同;当以含0.1%BHT的无水乙醇和丙酮为二步稀释溶剂时,所得色谱图中各色谱峰的响应值均较高且峰形良好,考虑到前者的毒性较小,因此选择含0.1%BHT的无水乙醇作为稀释溶剂。
综上所述,本研究建立了同时测定枸杞子中4种类胡萝卜素成分含量的高效液相色谱法联合一测多评法,该方法准确、稳定,可用于枸杞子中4种类胡萝卜素成分的含量测定及质量控制。
参考文献
[ 1 ] 羌宇.类胡萝卜素体外抗氧化、抗肿瘤活性及其构效关系初步研究[D].南昌:南昌大学,2020.
[ 2 ] 罗青,米佳,冉林武,等.枸杞类胡萝卜素研究进展[J].食品工业科技,2018,39(24):331-335,339.
[ 3 ] SUN Y J,RUKEYA J,TAO W Y,et al. Bioactive compounds and antioxidant activity of wolfberry infusion[J]. Sci Rep,2017,7:40605.
[ 4 ] 任丹丹,张海丽,王惜童,等.叶黄素与玉米黄质协同抗氧化活性的研究[J].食品工业科技,2017,38(17):296-299,304.
[ 5 ] 孙宇杰,赵琳,王岁楼.枸杞类胡萝卜素的分离纯化及抗氧化活性研究[J].农产品加工,2020(22):4-7.
[ 6 ] INBARAJ B S,LU H,HUNG C F,et al. Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLC-DAD-APCI-MS[J]. J Pharm Biomed Anal,2008,47(4-5):812-818.
[ 7 ] 李忠,彭光华,张声华.枸杞子中类胡萝卜素的组成及含量[J].植物资源与环境,1999(4):57-58.
[ 8 ] 白光灿,李娅琦,张泽坤,等.枸杞HPLC指纹图谱的建立及3种成分测定[J].中成药,2019,41(7):1721-1724.
[ 9 ] 刘颖新,冯传平,刘利利,等.一测多评法同时测定二至丸中8个成分[J].药物分析杂志,2021,41(2):210-218.
[10] 马昌豪,李怀伟,仝桂平,等.一测多评法同时测定咽炎片中5种指标性成分的含量[J].中国药房,2019,30(16):2232-2236.
[11] 王智民,钱忠直,张启伟,等.一测多评法建立的技术指南[J].中国中药杂志,2011,36(6):657-658.
[12] 徐硕,徐文峰,邝咏梅,等.一测多评法测定罗布麻叶中6个黄酮类成分的含量[J].药物分析杂志,2019,39(7):1217-1228.
(收稿日期:2021-12-22 修回日期:2022-04-02)
(編辑:邹丽娟)
