Smad3与乳腺癌免疫相关基因关系研究
2022-04-26童潇,周爽
童 潇,周 爽
(同济大学医学院肿瘤研究所,上海 200092)
乳腺癌是全球女性诊断率最高、死亡率最高的癌症[1],乳腺癌转移是造成病人死亡的重要原因。在肿瘤免疫微环境中,TGF-β/Smad信号通路在肿瘤发生中占主导地位,Smad3作为调控的主要蛋白之一,已经被证实能加速乳腺癌的发展[2],Smad3含量增多可以促进上皮间质转化(EMT)发生并引发转移[3],而Smad3的泛素化可以有效降低EMT程度[4],减少转移的几率。研究旨在探索乳腺癌微环境中的Smad3的表达与免疫相关基因关系,找到Smad3关联蛋白,从而为乳腺癌临床诊断和免疫治疗靶点提供新的方向和思路。
1 实验方法
1.1 肿瘤样本和临床数据获取
乳腺癌样本从癌症基因组图谱(TCGA,the cancer genome atlas)网站下载,转录组数据包含1 109例乳腺癌肿瘤样本和133例正常癌旁样本,同时获取了1 097例临床数据。
1.2 肿瘤微环境基质细胞和免疫细胞分组评估
从TCGA网站下载获得转录组数据,样本整理得到基因表达矩阵,利用Estimate系统对乳腺癌样本进行评估,分别对基质细胞和免疫细胞进行打分,获得打分评估列表。
1.3 临床生存曲线绘制
所有样本依据基质细胞和免疫细胞打分列表求取平均值,根据平均值将样本划分为2组:高分组和低分组。整理TCGA获得的临床样本数据得到生存时间列表,免疫细胞和基质细胞打分数据分别与生存数据联合分析,Survival包绘制Kaplan-Meier 生存曲线。
1.4 筛选差异基因并绘制热图和韦恩图
差异基因分析主要采用R语言Limma 包实现。免疫细胞与基质细胞高低分组基因表达值分别进行比较分析,选择差异倍数大于1.0,显著性小于0.05为差异基因,绘制基因热图。另外,对免疫细胞上调与基质细胞上调取交集基因,免疫基因下调与基质细胞下调取交集基因,R语言Ven包绘制韦恩图,即获得一个上调及下调的交集差异基因列表。
1.5 Smad3基因高低组差异基因
1 109例肿瘤样本转录组数据,按照Smad3基因表达的中位数,将样本分为高表达组和低表达组,以低表达组为对照组进行分析,低表达组555例,高表达组554例。R语言Limma 包分析获得2组间的差异基因(对数差异倍数>1.0,调整P值<0.05)。
1.6 Smad3差异基因联合免疫基因分析
Immport 网站下载免疫细胞表达基因列表,将Smad3高低组差异基因联合免疫基因分析,获得Smad3相关的免疫差异基因及其表达量。用R语言pHeatmap包和Volcano包绘制差异免疫基因热图和火山图。
1.7 基因本体(GO)富集分析及KEGG通路分析
富集分析采用R语言org.Hs.eg.db包实现,主要包括基因本体(GO,gene ontology)富集分析:生物过程、分子功能和细胞成分KEGG(kyoto encyclopedia of genes and genomes)通路分析,选取FDR (false discovery rate)<0.05 作为节点,可视化为柱状图和圈图。
1.8 蛋白互作(PPI)网络图构建
将Smad3相关的差异免疫基因上传至String网站,经过分析获得蛋白互作(PPI,protein protein interaction),进一步将蛋白输入到Cytoscape软件分析绘图,将所有相关蛋白统计并进行下一步分析。
1.9 Smad3免疫差异基因与肿瘤微环境差异基因交集基因
基质细胞免疫细胞差异基因与Smad3免疫差异基因取交集,并绘制韦恩图,获得Smad3肿瘤微环境免疫相关交互基因。利用CIBERSORT网站分析交集基因在免疫细胞中的含量、差异性及相关性。
1.10 细胞系及肿瘤模型构建
收集培养的对数生长期4T1细胞,0.25%的胰酶-EDTA消化,将细胞浓缩制成2×107mL细胞悬液。接种于正常饲养的BABL/c雌性小白鼠,在左侧第4对乳腺的脂肪垫注射200 μL细胞悬液约含4×106细胞。接种后第6天可见5 mm左右的可触摸的肿瘤。
1.11 Smad3抑制剂治疗BABL/c小鼠乳腺肿瘤
接种后的第7天,肿瘤大小6~7 mm,进行分组,随机分成4组,每组设3只重复平行对照。采用腹腔注射,每组小鼠给予不同剂量的Smad3特异性抑制剂SIS3(0、1 μg/g、2 μg/g、4 μg/g),200 μL每只,对照组注射0.9%生理盐水含等体积DMSO(dimethyl sulfoxide)。每隔一天腹腔注射SIS3,并连续治疗15 d。分别在治疗后第1、3、5、7、9、11、13、15天记录各组肿瘤的生长情况,绘制肿瘤生长曲线。治疗结束后,小鼠二氧化碳窒息处死,小心取下各组肿瘤,进行肿瘤大小的比较拍照,并精确称量瘤重。
1.12 Western印迹检测Smad3、p-Smad3和MMP9的表达
取等体积等含量的肿瘤蛋白样品上样,经过SDS-PAGE凝胶电泳后,将蛋白转移至PVDF膜,3%BSA封闭后将PVDF膜置于一抗抗体孵育盒中(Smad3、p-Smad3 phosphorylation Smad3、MMP9(matrix metallopeptidase 9)),4 ℃冰箱内过夜孵育,时间为12~16 h。次日,孵育结束后,取出PVDF膜,并用吸水纸将多余抗体稍稍蘸干,在1×TBST中充分洗涤,洗3次,每次10 min。PVDF膜浸没于HRP标记的二抗中,室温孵育2 h,以β-actin为内参。孵育结束后用1×TBST充分清洗PVDF膜。取ECL化学发光液A液和B液各1 mL充分混匀,PVDF膜在室温下与混合液孵育,孵育过后在化学发光仪上进行扫描,预先设定为自动曝光,查看发光情况,然后手动调整曝光时间,找到最佳曝光时间。
2 结果
2.1 乳腺癌肿瘤微环境与生存关系
TCGA乳腺癌样本经Estimate评估后得到免疫打分(immune score)和基质打分(strom score)。根据分值的平均值将样本分为高低2组,分别对比高打分组与低打分组之间基质细胞与免疫细胞的差异,临床样本信息提取后结合肿瘤微环境打分情况,绘制Kaplan-Meier生存曲线,高低2组在基质和免疫细胞中的对比情况见图1。临床样本信息提取后结合肿瘤微环境打分情况,绘制Kaplan-Meier生存曲线。免疫打分和基质打分结果分别如图1(a)和图1(b)所示。从图1(a)可以看出,基质打分P=0.522,大于0.05,无显著性差别;从图1(b)可以看出,免疫打分P=0.008,小于0.01,具有极显著差异。此结果表明,乳腺癌肿瘤微环境中,免疫细胞含量对病人生存率具有显著的影响。
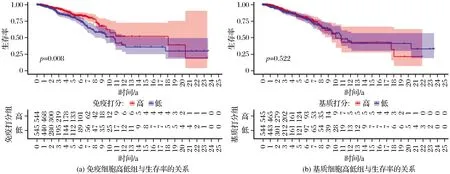
图1 乳腺癌肿瘤微环境中基质和免疫与生存率的关系Fig.1 Relationshipin between stroma and immunity and survival rate in breast cancer tumor microenvironment separately
2.2 肿瘤微环境基质细胞和免疫细胞差异基因分析
利用R语言limma包对各转录组数据进行分析,获得免疫细胞和基质细胞的基因热图,如图2(a)和图2(b)所示。从差异基因分析中分别获得免疫与基质细胞上调、下调差异基因,进一步将免疫细胞和基质细胞上调、下调基因分别取交集,通过R语言Venn图绘制所得结果如图2(c)和图2(d)所示。从图2(c)和图2(d)可以得到上调交集差异基因437个和下调交集差异基因49个。

图2 肿瘤微环境中基质细胞和免疫细胞差异基因表达Fig.2 Differential gene expression in stromal cells and immune cells in tumor microenvironment
2.3 Smad3相关免疫差异基因筛选
以Smad3基因中位值为中心点,将样本分成高表达组和低表达组,R语言limma包比较高低表达组获得差异基因,将差异基因与Immport免疫基因综合分析,获得Smad3基因高低表达相关免疫差异基因,绘制差异热图见图3(a)。进一步将差异基因分类,以差异倍数logFC(fold change)为横坐标,错误发现率log10(FDR)(false discovery rate)为纵坐标绘制差异基因火山图,见图3(b)。
2.4 Smad3差异基因GO富集分析
将免疫差异基因进行GO分析。GO-BP生物过程分析发现差异基因主要跟体液免疫有关,粒细胞与中性粒细胞液参与其中。GO-CC细胞成分主要为分泌颗粒腔、胞质小腔泡、囊腔、含胶原蛋白细胞外基质、特殊颗粒腔、血液微粒、三级颗粒腔、免疫球蛋白复合物。GO-MF分子功能为受体配体活性、细胞因子活性、G蛋白偶联受体结合、细胞因子受体结合、趋化因子受体结合、G蛋白偶联受体、趋化因子活化(见图4)。
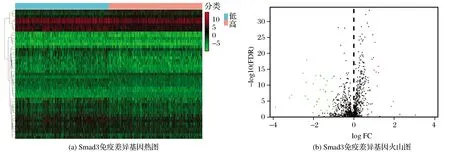
图3 Smad3相关免疫差异基因筛选Fig.3 Smad3-related immune differential gene
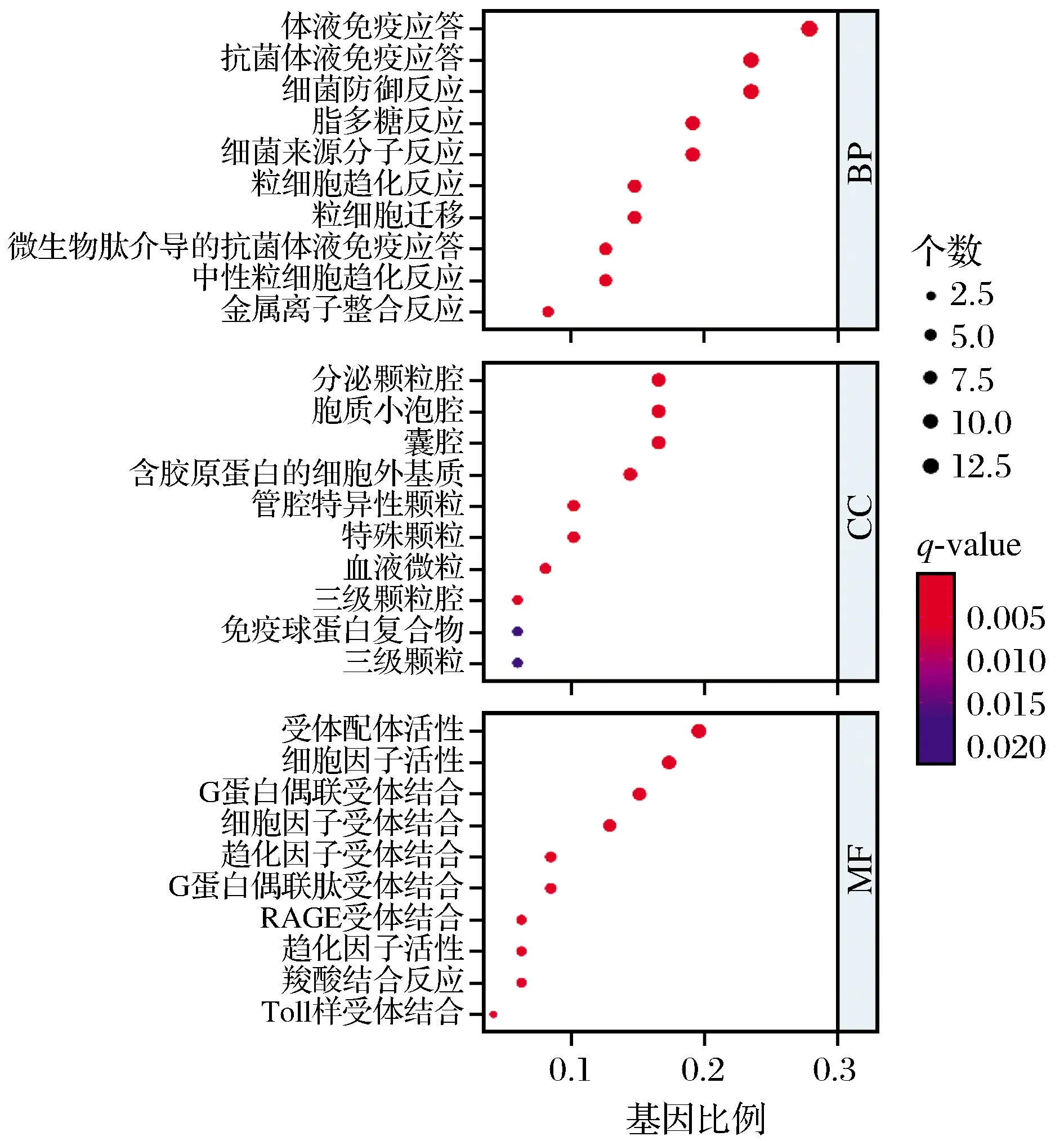
图4 Smad3相关免疫差异基因GO富集分析Fig.4 GO enrichment analysis of Smad3-related immune differential gene
2.5 PPI蛋白网络互作分析
通过String 网站进行PPI分析,选取自信度大于0.9的相关蛋白基因,进一步通过节点数分析,找到与Smad3差异基因中节点最多的蛋白。结果发现MMP9具有最多的节点数,共计14个,如图5所示。
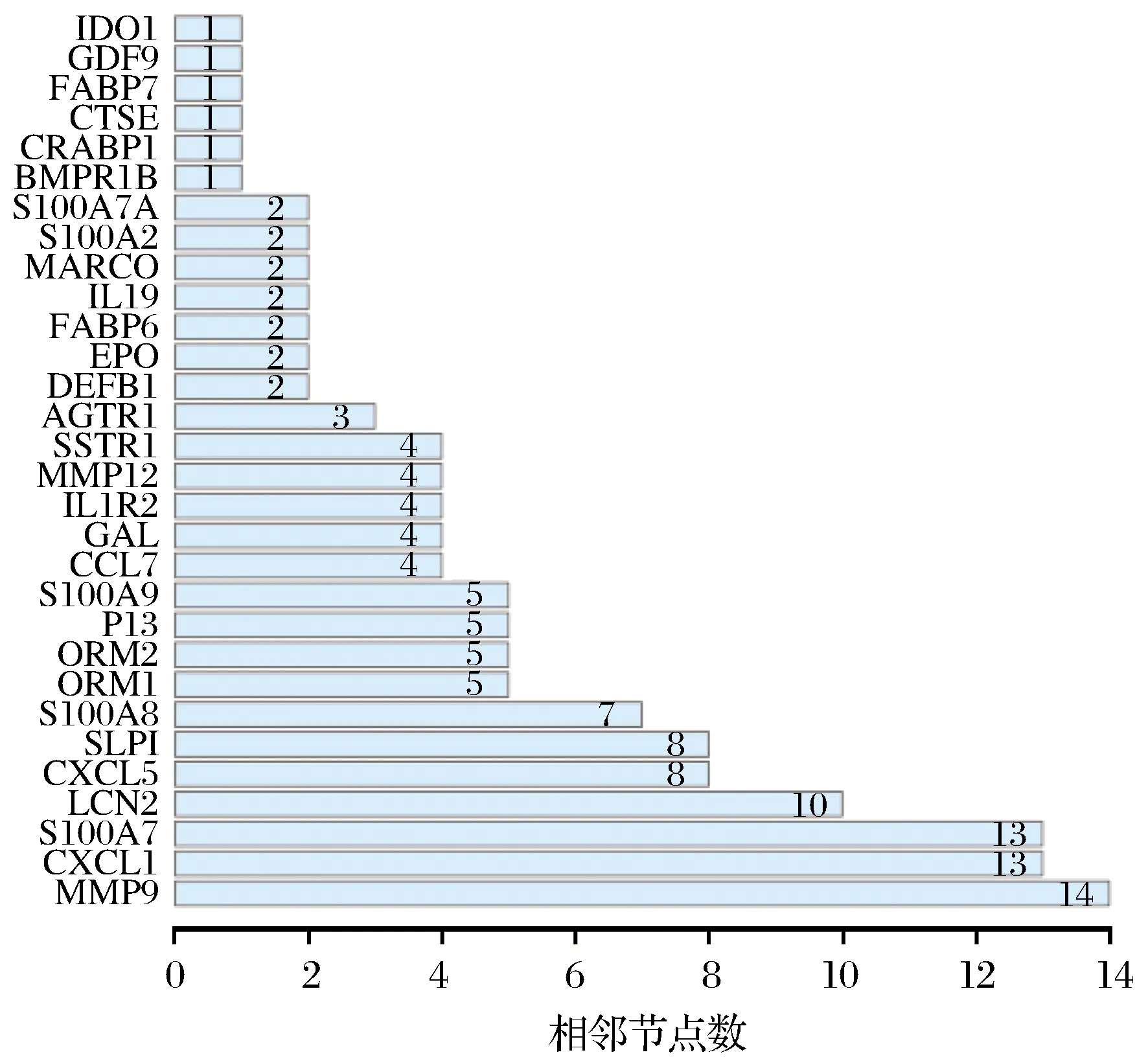
图5 Smad3差异基因蛋白节点数统计Fig.5 Number of adjacent nodes of Smad3 differential gene
2.6 肿瘤微环境与Smad3免疫相关差异基因
将肿瘤微环境得到的上调和下调共计487个差异基因与PPI蛋白互作的15个节点基因联合作Venn交集图,得到了唯一的交集基因MMP9,见图6(a)。另外,利用CIBERSORT网站对MMP9进行分析,具体分析结果见图6(c)。结果显示MMP9在大部分的免疫细胞中都有不同程度的改变,其中M0型巨噬细胞显示出较高的相关性(R=0.74,P<2.2e-16),见图6(b)。
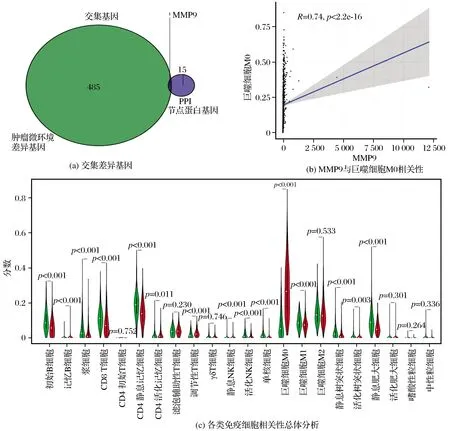
图6 MMP9与肿瘤微环境中免疫细胞相关性分析Fig.6 The correlation analysis between MMP9 and immune cells in tumor microenvironment
2.7 Smad3抑制剂对4T1小鼠肿瘤的影响
对4T1乳腺癌小鼠模型进行为期15 d的SIS3干预实验,抑制Smad3的磷酸化从而抑制Smad3的正常功能,研究发现在治疗结束时,各干预组的肿瘤均小于未干预组,其中浓度越高肿瘤越小。图7(a)显示了在治疗15 d处死小鼠剥离肿瘤后的各组肿瘤大小。对3个平行组的小鼠肿瘤进行称重,绘制了的直方图,提示SIS3浓度越高肿瘤质量越小(见图7(b))。在整个15 d的治疗干预过程中,肿瘤体积的大小呈现出了与剂量的相关性,其中4 μg/g的干预剂量肿瘤生长最缓慢,体积最小(见图7(c))。通过Westen blot 蛋白免疫印迹对肿瘤组织内的Smad3和磷酸化的Samd3(p-Samd3)以及MMP9的含量进行对比分析,可以看到在Smad3相同的水平下,高剂量(4 μg/g)干预组的Smad3磷酸化显著被抑制,p-Smad3表达减少,同时MMP9的含量也有所下降,整体表现出剂量的相关性(见图7(d))。
3 讨论
在肿瘤微环境中TGF-β/Smad3通路占有主导地位,Smad3/Smad2磷酸化后能够联合Smad4进入细胞核,启动相应的转录因子,调控肿瘤细胞的进程。其中Smad3作为主要的效应蛋白在肿瘤发展中具有促进作用。Smad3对细胞外基质蛋白起到关键作用,抑制Smad3磷酸化能降低肿瘤细胞的运动能力,减小转移的几率[5]。研究指出降低Smad3磷酸化程度,能够显著减少肿瘤细胞的增殖[6],这一结果与我们的结果相同,SIS3抑制Smad3的磷酸化,从而减少了肿瘤细胞的生长。以上均表明,TGF-β/Smad3在肿瘤微环境中能够帮助EMT的形成,帮助肿瘤细胞逃避免疫监视,改变细胞外基质,利于肿瘤自身的生长、增殖和转移。另外,Smad3通过调控例如NK细胞[7]、巨噬细胞[8]、Treg[9]等免疫细胞,帮助肿瘤细胞逃避免疫监视,促进肿瘤细胞生长。Smad3可作为治疗肿瘤的一个潜在靶点[10],同时也被作为肿瘤的检测标志[11]。
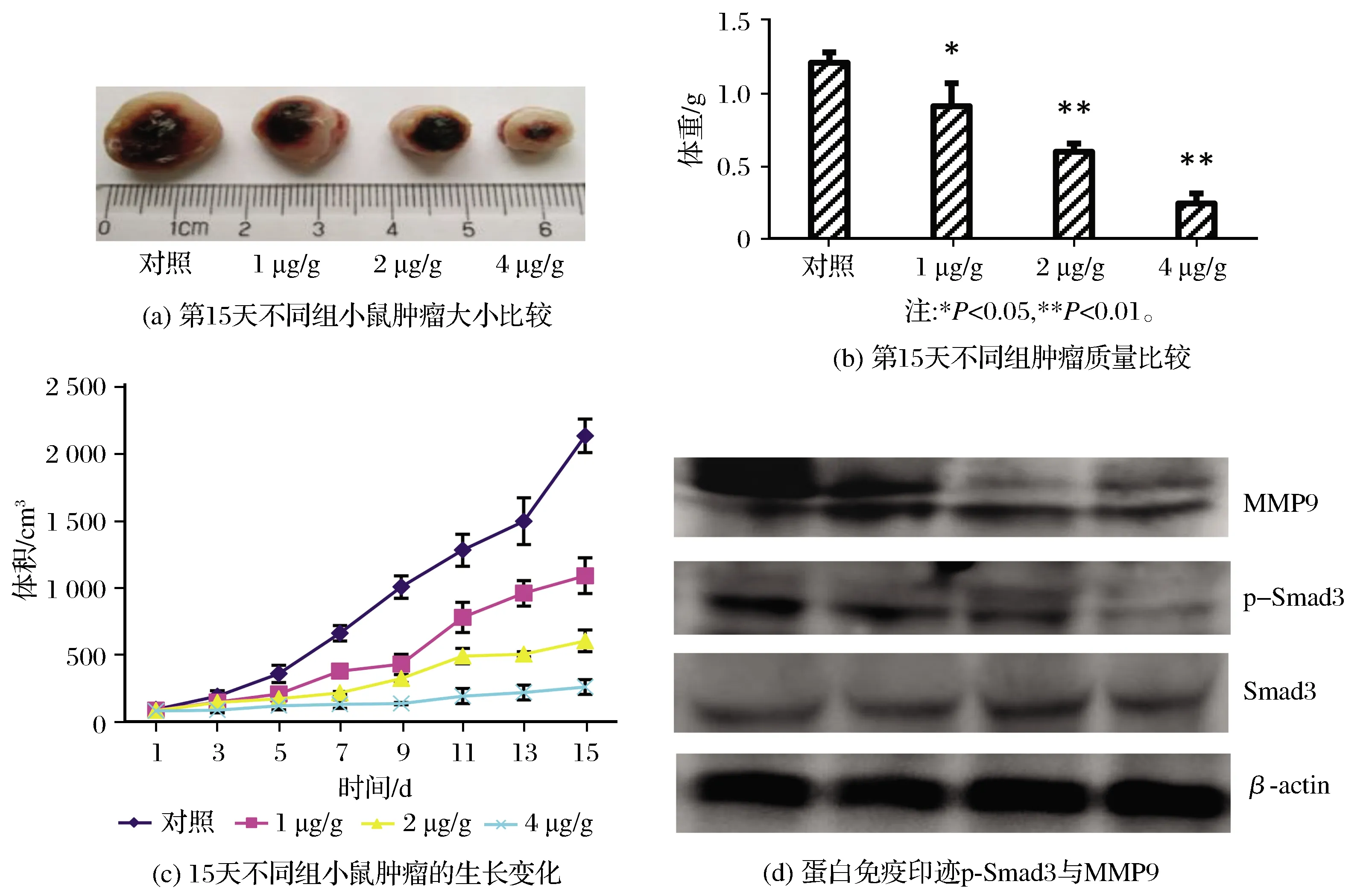
图7 Smad3磷酸化抑制能减缓小鼠肿瘤生长Fig.7 Smad3 phosphorylation inhibition on tumor growth mitigation in mice
研究通过对乳腺癌肿瘤细胞微环境进行分析,发现在微环境中免疫细胞与乳腺癌病人的生存具有极大的关联性。进一步以Smad3分组,将病人进行分组与免疫基因关联,得到了唯一的相关蛋白MMP9。MMP是细胞外基质内的重要成分,能够降解ECM的各种成分,反应肿瘤侵袭转移的重要指标SIS3[12]作为Smad3的抑制剂,它能够减缓肿瘤的生长并且降低肿瘤内金属蛋白酶的含量[13-14]。研究也证实Smad3磷酸化抑制后能够降低MMP9的表达,抑制肿瘤的生长。也有相关报道指出,Smad3与MMP9之间存在相互关联[15-16],但不是肿瘤细胞。研究也证明了Smad3与MMP9在肿瘤细胞中有相关性,Smad3磷酸化程度越高,MMP9的表达越高。
总之,研究通过TCGA数据库筛选出Smad3肿瘤微环境中免疫相关的基因MMP9,MMP9的表达与Smad3磷酸化程度呈现出正相关,Smad3磷酸化抑制后MMP9表达降低,肿瘤生长也缓慢,Smad3可以作为一个潜在的治疗靶点用于乳腺癌的治疗,另外p-Smad3/MMP9也可以作为检验乳腺癌转移的一个检测标志。
