短程硝化的影响因素及其耦合工艺的研究进展
2022-04-26郭凯成刘文如宋家俊沈耀良
郭凯成,刘文如,2,3,宋家俊,汪 倩,沈耀良,2,3
(1.苏州科技大学环境科学与工程学院,江苏苏州 215009;2.城市生活污水资源化利用技术国家地方联合工程实验室,江苏苏州 215009;3.江苏省水处理技术与材料协同创新中心,江苏苏州 215009)
传统的脱氮过程依赖于好氧与缺氧条件下分别进行的硝化和反硝化。硝化过程中,氨氧化微生物将氨氮氧化为亚硝酸盐,随后亚硝酸盐被微生物氧化为硝酸盐。反硝化过程中,异养反硝化微生物以有机物为电子受体将硝酸盐还原为氮气,亚硝酸盐、一氧化氮和一氧化二氮则以中间产物形式存在〔1〕。新型脱氮技术依赖于氨氧化为亚硝酸盐(短程硝化),亚硝酸盐通过反硝化或厌氧氨氧化进一步还原为氮气。此过程与传统脱氮过程相比可降低40%的COD消耗,耗氧量降低25%,生物质产量减少300%,后续反硝化阶段的亚硝酸盐的还原速率可提高1.5~2倍,CO2排放量减少20%〔2〕。因此,新型脱氮技术日益受到研究者的青睐。
笔者对近年来短程硝化的相关文献进行统计分析,得出维持短程硝化稳定运行的各种影响因素,如pH、游离氮(FA)与游离亚硝酸盐(FNA)、温度、溶解氧浓度和化学抑制剂等,并总结了可与短程硝化耦合的新型脱氮工艺:短程硝化耦合反硝化、短程反硝化耦合厌氧氨氧化、短程硝化耦合反硝化除磷等,为类似研究提供理论借鉴。
1 短程硝化原理及菌种分类
短程硝化并非简单的氨氧化菌(AOB)将氨氮转化为亚硝酸盐的过程,而是伴有多种中间产物和酶促反应的复杂电子传递与能量转化过程。目前国内外学者将氨为最主要基质、羟氨为真正能源的假设作为生化反应基础,对短程硝化过程进行研究,发现其反应过程主要分为2步:(1)基质NH3(非NH4+)透过AOB细胞膜,与细胞质膜中的氨单加氧酶(AMO)发生反应形成羟胺NH2OH,放出120 kJ∕moL能量,反 应 式 为NH2OH在羟胺氧化还原酶(HAO)的作用下氧化形成 亚 硝 态 氮,吸 收23 k J∕moL能 量〔3〕,反 应 式 为
第1步反应中NH3氧化所需的1个氧原子来自分子氧,第2步反应中羟胺氧化所需的氧来自细胞质内的水分子,同时转移出4个电子和4个H+,为第1步反应另一氧原子还原为水分子提供条件。也有研究提出羟胺的氧化也可分为两步进行〔4〕,反应中间产物也不止一种,因此对氨与羟胺耦合的机理还需深入探索。
目前已知的能将氨氮氧化为亚硝酸盐的微生物主要有两大类:氨氧化细菌(AOB)和氨氧化古生菌(AOA)。基于AOB与AOA基因的系统发育树由图1所示〔5〕。
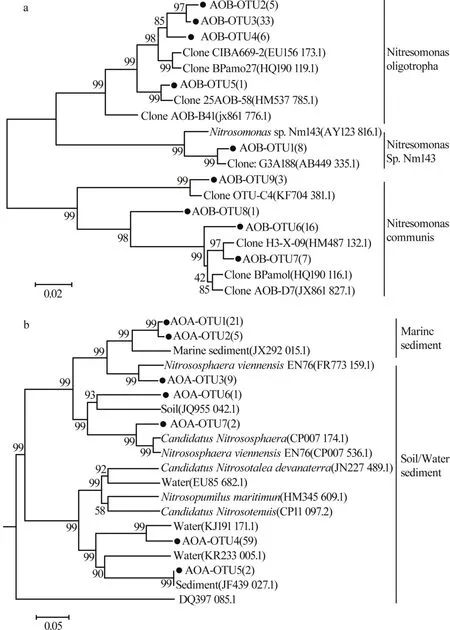
图1 基于AOB amo A(a)和AOA amo A(b)基因的系统发育树Fig.1 Phylogenetic tree based on AOB amo A(a)and AOA amo A(b)genes
AOB被归于γ-变形杆菌亚门(γ-Proteobacteria)和β-变形杆菌亚门(β-Proteobacteria)。γ-AOB包括Nitrosococcusoceani等菌种,β-AOB门下的菌属有Nitrosospira、Nitrosomonas等,Nitrosomonas菌 属 包 括Nitrosomonas europaea-Nitrosococcusmobilis菌种、Ni-trosomonas communis菌种、Nitrosomonas oligotropha菌种、Nitrosomonasmarina菌种、Nitrosomonascryotolerans菌种和NitrosomonasNm143菌种〔6〕。其中,Nitrosospira菌属、Nitrosomonas europaea-Nitrosococcusmobilis菌种和Nitrosomonas oligotropha菌种在污水处理系统中较为常见〔6〕。有研究证实AOA在全球氮素循环中有氨氧化的潜在作用〔7〕,其也被归入近期发现的Thaumarchaeota门〔8〕。该门下具有氨氧化功能的菌属主要有Nitrosopumilus、Nitrososphaera、Nitrosocaldus、Nitrosotalea和Nitrososphaera姊妹菌属〔9〕,其氨氧化原理现阶段还不明确。在一些大型污水处理厂中,AOA被认为是氨氧化的主要作用菌群〔10〕,但在大部分脱氮系统中AOB仍是主要氨氧化菌群〔11〕。
2 影响因素
AOB和亚硝酸盐氧化菌(NOB)的生理特性不同,通过控制某些环境参数如温度、p H、DO、FA和FNA等可促进AOB的生长并抑制NOB活性,达到短程硝化的目的〔12〕。但在主流条件下NOB相比于AOB有更强的适应性,在系统运行一段时间后NOB活性得到恢复,使亚硝酸盐的积累不稳定,运行中一旦条件发生变化硝酸盐便会大量积累〔13〕。因此需寻找合适的操作条件抑制NOB的活性,最大限度地提高脱氮效能〔14〕。
2.1 温度
在短程硝化系统中,温度对氨的氧化有显著影响。C.HELLINGA等〔15〕发现AOB的生长速率随温度升高而增大,在35℃左右达到峰值,且高温时NOB的生长速率低于AOB。在氨氮负荷与DO浓度恒定的条件下,S.LÓPEZ-PALAU等〔16〕观察到短程硝化反应器在33~37℃范围内的氨氧化速率达到最大。Yongzhen PENG等〔12〕认为温度>25℃时NOB的停留时间低于AOB,系统可实现稳定的短程硝化,而低温会导致NOB在系统中占主导地位。巩有奎等〔17〕研究了温度变化对短程硝化的影响,发现温度≥20℃时NH4+去除率均>95%,温度降至15、10℃时,亚硝态氮积累率低至21.3%、26.7%。王丽媛等〔18〕在SBR反应器中(25℃)成功实现了短程硝化,逐步降低反应温度至20、15℃后,MLSS总量大幅减少,污泥活性明显降低,AOB与NOB的生长均受到抑制,体现出低温条件下寻求稳定短程硝化策略的重要性。通过p H在线监测〔19〕或根据出水亚硝氮积累率〔18〕等控制SBR反应器的曝气时间,可强化AOB的硝化性能,防止NOB硝化过程产生,再通过不断淘洗排泥使AOB逐步成为优势菌种,最终在低温下实现稳定的短程硝化过程。M.PICULELL等〔20〕通过保持生物膜反应器的生物膜厚度及交替使用合成废水进水,在15℃下实现了稳定的短程硝化。低温时不同运行方式下的短程硝化效果见表1。

表1 低温下不同运行方式的短程硝化效果Table 1 Partial nitrification effects of different operation modes at low temperature
2.2 p H、FA与FNA
pH可改变酶反应机制,直接影响AOB和NOB的活性〔24〕,或通过改变FA和FNA的浓度间接影响AOB、NOB的 活 性〔25〕。Yuling HE等〔26〕认 为p H在7.5~8.5条件下NOB活性会被抑制,pH在7.5~7.8有利于短程硝化作用。S.PARK等〔24〕报道AOB、NOB的最适pH分别为(8.2±0.3)、(7.9±0.4)。B.SINHA等〔27〕研究了pH对硝化作用的影响,发现pH较高时亚硝酸盐的积累量增加。
高浓度的FA和FNA均能抑制AOB与NOB的活性,但与NOB相比,AOB对FA和FNA浓度的耐受性更强〔28〕。在悬浮污泥系统中,0.1~0.4 mg∕L FA和0.24 mg∕L FNA对亚硝酸盐的氧化有抑制作用〔29〕,而氨氧化直至较高浓度时(10~150 mg∕L FA、1.35 mg∕L FNA)才被抑制〔30〕。因此,在适当的FA或FNA浓度下,AOB活性不受影响而NOB活性会被抑制。处理含高浓度氨氮废水如侧流废水、垃圾渗滤液、畜禽粪便发酵出水时,FA浓度可保持在较高水平以抑制NOB的活性。城市污水的游离氨浓度较低,一般采用FNA浓缩液即部分硝化侧流处理单元的出水进行在线污水处理,可有效提高FNA从而抑制NOB活性〔30〕。
2.3 DO
DO是AOB和NOB氧化还原链中的底物及末端电子受体。在低DO浓度下,AOB和NOB的生长速率均会降低〔31〕。NOB的氧半饱和系数(Ko)一般高于AOB〔32〕,因此AOB对氧的亲和力高于NOB,竞争DO时NOB往往处于劣势。有研究表明,DO<1.0 mg∕L情况下,AOB的生长速率是NOB的2.6倍〔33〕。K.HANAKI等〔34〕研究表明DO为0.5 mg∕L(25℃)时,实验室规模的混流反应器可抑制亚硝酸盐氧化而不会抑制氨氧化。维持限氧状态无需额外的能量或化学物质,被广泛用于高、低氨氮含量废水的处理〔35〕。
然而,以限氧为唯一控制策略往往不足以维持长期稳定的短程硝化过程。Guoqiang LIU等〔36〕发现DO为0.16 mg∕L时,经过长时间运行亚硝态氮仍会被全部硝化,类Nitrobacter硝化菌群被类Nitrospira硝化菌群替代,进行亚硝氮的氧化过程。同样地,C.M.FITZGERALD等〔37〕研究发现DO<0.3 mg∕L时2个短程硝化反应器均实现完全硝化,分离出的微生物与任何已知的氨氧化原核微生物都无关联。导致这一现象的原因可能为:(1)存在其他有利于NOB增殖的条件,如低FA、低温等;(2)NOB具有适应性,可在微氧环境下存活并生长;(3)NOB不同谱系中的微生物种群对氧的亲和力不同,生长特性也不同。
硝化杆菌和硝酸螺旋菌是废水处理中常见的2种亚硝氧化细菌。其氧亲和力趋于不同,硝化杆菌的亲和力较低,硝化螺旋菌的亲和力较高〔38〕。Zhonghua HUANG等〔39〕发现低DO条件下(<1.0 mg∕L)大型污水处理厂中的硝化螺旋菌数量高于硝化杆菌。硝化螺旋菌可被分为Ⅰ系与Ⅱ系。H.D.PARK等〔40〕报道硝化螺旋菌Ⅰ系在低DO条件下(0.12~0.24 mg∕L)存在,而硝化螺旋菌Ⅱ系在高DO条件下(8.5 mg∕L)被发现。表明一些NOB菌种可在限氧环境下存活并具有活性,可能导致短程硝化失败,尤其是长期运行时。但也有研究指出AOB与NOB对底物的亲和力取决于其菌落大小或生物量,并非细胞自身的特性〔41〕。在给定环境基质中,NOB的氧亲和力会随时间推移而发生较大变化,这取决于细胞环境和NOB在基质中的适应性。因此,仅以限氧作为短程硝化长期运行的策略可能不适宜,应考虑与其他控制条件联合应用以抑制NOB活性。
2.4 碳氮比
碳氮比是影响短程硝化性能的另一关键因素〔42〕。在高COD负荷下,具有较高生长速率和生物量的异养微生物会在营养底物和溶解氧的竞争中胜过AOB,可利用的氧电子受体下降将导致氨氧化细菌种群多样性和生物量的减少〔42〕。F.IANNACONE等〔43〕发现过量有机碳会抑制氨氧化过程,因此有必要严格控制并选择合适的进水碳氮比。Jialin LI等〔44〕考察了碳氮比对单级短程硝化-厌氧氨氧化耦合工艺处理高氨氮废水的影响,结果表明,碳氮比为0.4时脱氮效果稳定,但COD去除不完全,导致脱氮效率不高。
也有研究发现,低温下有机碳源的存在可改善硝化过程,异养菌可对氨氧化细菌起到保护作用〔45〕。孙艺齐等〔46〕考察了SBR反应器中(15℃)碳氮比对短程硝化启动和稳定性的影响,发现60个周期(每周期12 h)内,碳氮比为1.5时短程硝化的启动十分迅速且成功,碳氮比为0或3时短程硝化启动失败。Fan DING等〔47〕也认为碳氮比为1、2时对低温下的短程硝化直接启动有很大促进作用。Li JIA等〔48〕以葡萄糖为碳源启动短程硝化,当进水碳氮比为1.2时,脱氮效率可达84%~95%;当碳氮比为2.7~2.9时AOB活性明显下降〔49〕。
2.5 抑制性化合物
NOB抑制剂有硫化物、羟胺、盐类等〔2〕。T.H.ERGUDER等〔50〕在初始硫化物质量浓度为45 mg∕L、p H为7.5的条件下获得75%的亚硝酸盐积累率,而添加硫化物之前亚硝酸盐积累率不到13%。D.I.B.ORTIZ等〔51〕观察到硫化物对AOB和NOB均有抑制作用,其对亚硝酸盐氧化的影响更大。常赜等〔52〕以硫化物为电子供体,在DO为(1.5±0.5)mg∕L、硫化物为50 mg∕L、温度为25℃、水力停留时间为12 h的条件下启动部分硝化-自养反硝化工艺,总氮去除率达到90%。
羟胺作为硝化的中间产物,对NOB的生长较AOB和厌氧氨氧化细菌有更明显的不可逆抑制作用〔53〕。在好氧颗粒污泥反应器、生物膜反应器、一体式生物滤池系统中分别投加10、8.25、2.5~5 mg∕L羟胺,均能成功实现部分硝化。考虑到羟胺是AOB氨氧化的第一个产物,且并非亚硝化的限速步骤,上述抑制浓度不应视作硝化系统中的一般积累水平,而应解释为抑制NOB的外部因素。
盐度对硝化作用影响的研究结果并不一致〔54〕。有研究称,与NOB相比,AOB对NaCl(10 g∕L)的短期和长期抑制更敏感〔55〕,但Y.W.CUI等〔56〕认为在SBR反应器中投加10 g∕L NaCl时短程硝化效果最好,NOB活性因NaCl的加入而受到抑制并被冲刷去除。
重金属对硝化作用的抑制因素为:(1)污泥类型,即活性污泥或硝化富集污泥;(2)暴露方式、时间长短、剂量;(3)温度。镍抑制硝化作用的浓度范围尚未明确。C.W.RANDALL等〔57〕研究发现,14℃时长期且大剂量加入镍对NOB的毒性大于对AOB的毒性,而在17、30℃时对AOB和NOB的毒性相当。Zhiqiang HU等〔58〕报道镍达到58.5 mg∕L时对AOB有抑制作用,对NOB无抑制作用。Xiaoguang LIU等〔59〕研究了10、23、35℃下低氨合成废水硝化过程中镍的毒性抑制作用,结果表明:(1)镍∕MLSS更能代表镍的毒性范围;(2)镍对硝化菌的毒性受温度影响较大。10℃时,镍的毒性主要针对AOB,对NOB的抑制作用相当或更小。23、35℃时,NOB受镍毒性的抑制作用更强。在活性污泥中,铜对AOB的抑制作用比对NOB的更强〔60〕。
3 耦合工艺
相比于物理化学工艺,硝化反硝化生物脱氮技术具有更高的经济效益,但也存在硝化反应缓慢、高氨氮和有机物负荷下硝化反应活性下降、氧气控制等缺点。由于硝化速率低,需要大型反应器或更长的水力停留时间(HRT)以完成氨氮的去除〔61〕。将短程硝化与反硝化、厌氧氨氧化和反硝化除磷进行耦合,不仅能进一步提高效能与经济效益,还能为不同种类的含氮废水提供更合适的处理方法。比较了各新型脱氮工艺处理废水的控制参数与效能,如表2所示。

表2 各新型脱氮工艺处理不同种类废水的控制参数与效果Table 2 Control parameters and treatment effects of new denitrification technologies for different types of wastewater
3.1 PND工艺
PND工艺是反硝化菌利用短程硝化产生的亚硝酸盐作为电子受体进行脱氮的耦合工艺,其流程如图2所示。

图2 PND工艺流程Fig.2 Technological process of PND
完全硝化需氧量为4.57 g∕g,而亚硝化只需3.43 g∕g,抑制硝化可节省约25%的曝气成本。此外,短程反硝化速率比全程反硝化速率高出1.5~2倍,有机碳源需求量最高可降低40%,理论上短程硝化与短程反硝化的污泥产量分别减少33%、55%〔12〕。因此,该工艺被认为是提高生活污水脱氮效果的有效解决方案之一。Cancan JIANG等〔62〕通过联合控制DO与FNA成功建立了短程硝化反硝化工艺以处理低碳氮比生活污水,在连续流系统中,当DO为1.5 mg∕L时实际污水的平均亚硝氮积累率为78%,平均总氮去除率为76%。Yuanyuan GUO等〔63〕通过pH与DO的联合控制(即在p H铵谷点时停止曝气)强化短程硝化,并在SBR反应器中增加厌氧发酵过程,为反硝化提供优质碳源及减少剩余污泥产生,总氮去除率可达93.5%。
PND工艺在高氨氮、高盐度的工业废水处理方面具有广阔的应用前景。Jiayi LI等〔64〕采用PND工艺对垃圾渗滤液进行处理,发现随着进水m(BOD)∶m(TN)的升高,污泥沉降性变好,原因可能在于类腐殖酸物质在胞外聚合物(EPS)中的比例增加,从而提高系统性能;m(BOD)∶m(TN)为1.44时,总氮去除速率稳定在226 mg∕(L‧d)。Binbin SHENG等〔65〕对DO和外部碳源进行优化,促进了系统内亚硝化单胞菌的富集,优势反硝化菌Thauera的丰度也由0.60%显著富集到5.52%,成功将大型垃圾渗滤液处理厂原有硝化反硝化工艺升级为PND工艺。Zonglian SHE等〔66〕在SBR反应器内启动PND工艺,当进水盐度为5~37.9 g∕L时,亚硝氮积累率>92.6%,氨氮与总氮的去除率保持在98.5%以上;盐度为9.0 g∕L时,活性污泥的氨氧化速率可达接种时的2倍。
3.2 PNA工艺
PNA工艺对短程硝化与厌氧氨氧化进行耦合,是对PND工艺的进一步改进,其工艺流程如图3所示。
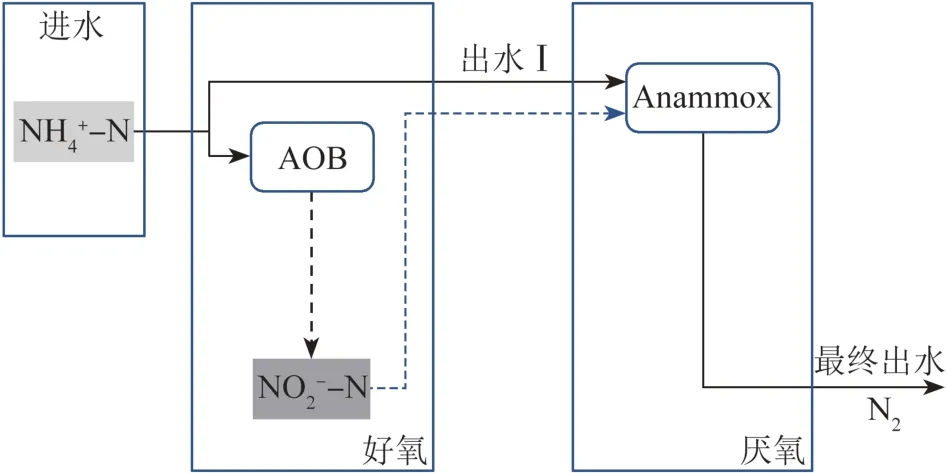
图3 PNA工艺流程Fig.3 Technological process of PNA
在PNA工艺中,进水氨氮一半被AOB氧化产生亚硝酸盐,一半被厌氧氨氧化菌(Anammox)以亚硝酸盐为电子受体直接氧化为氮气,达到高效脱氮的目的。与传统脱氮工艺相比,PNA主要优势在于:(1)无需有机碳源;(2)曝气能量减少约60%;(3)污泥产量减少约75%;(4)CO2和N2O排放量更低〔31〕。PNA工艺可设计为单级或二级反应过程。单级反应一般在移动床生物膜反应器、颗粒污泥和旋转生物接触反应器中运行,通过曝气在生物膜或颗粒污泥外层富集AOB将废水中的氨氮转化为亚硝酸盐,内层因传质效应溶解氧较少,为厌氧氨氧化细菌的富集提供条件,利用亚硝酸盐转化氨氮。二级反应即设置2个反应器,通过参数控制设立短程硝化和厌氧氨氧化的适宜运行条件,达到耦合脱氮目的〔15〕。
PNA工艺具有高效的脱氮性能,成功应用于世界上200多家规模化污水处理厂,对低碳氮比消化出水进行处理〔79〕。因此,PNA工艺用于主流处理受到极大关注。PNA工艺的理论最大脱氮效率为89%〔80〕,但存在异养反硝化菌(HDB)与外部有机碳源时,系统的最大脱氮效率可达90%以上〔81〕。一方面,Anammox和HDB会竞争亚硝酸盐,降低系统的脱氮性能;另一方面,HDB可利用厌氧氨氧化产生的硝酸盐,在某些情况下积累亚硝氮,表明2种菌群的相互作用能增强脱氮效果〔82〕。有研究发现,低碳氮比时PNA工艺的性能提高,而高碳氮比会增加HDB的活性,使厌氧氨氧化性能降低〔82〕。有机物浓度低时HDB出现在悬浮相,高浓度时主要存在于生物膜中〔83〕。因此可通过膜生物反应器、颗粒污泥及生物膜系统保留生物量,以恢复与稳定Anammox的活性〔22〕。
奥地利Strass污水厂和新加坡Changi污水厂成功应用PNA工艺处理主流生活污水。Strass污水厂通过间歇曝气及添加Anammox颗粒污泥以维持较高的生物量,但厌氧氨氧化对脱氮的贡献率并未报道〔84〕。Changi污水厂采用分段式进水及交替好氧、缺氧条件来抑制NOB,且由于工厂位于热带地区,进水温度基本保持30℃,厌氧氨氧化效果较稳定,但只占总氮去除的37.5%〔85〕。这些案例都证明了主流PNA工艺的潜力,但均存在特殊情况,因此PNA工艺在广泛应用前还需进一步研究。
3.3 PN-DPR
反硝化除磷工艺(DPR)是强化生物除磷(EBPR)的新型工艺。在缺氧状态下,反硝化聚磷菌(DPAOs)利用细胞内的PHA以NOx--N为电子受体超量吸收水中的磷,达到一碳两用的效果〔86〕。对于短程硝化与反硝化除磷工艺耦合的可行性,有研究者认为高硝态氮浓度下反硝化除磷性能会受到抑制〔87〕,或厌氧状态下反硝化聚糖菌会与DPAOs竞争优质碳源(VFA)从而降低除磷性能〔88〕。但最近研究证明〔89〕,通过合理驯化反硝化聚磷菌在高浓度NO2--N下也能稳定吸磷,且部分聚糖菌能利用VFA将硝态氮转化为亚硝氮,为反硝化除磷提供电子受体,进一步说明PN-DPR工艺具有稳定脱氮除磷的能力。PN-DPR工艺流程如图4所示。
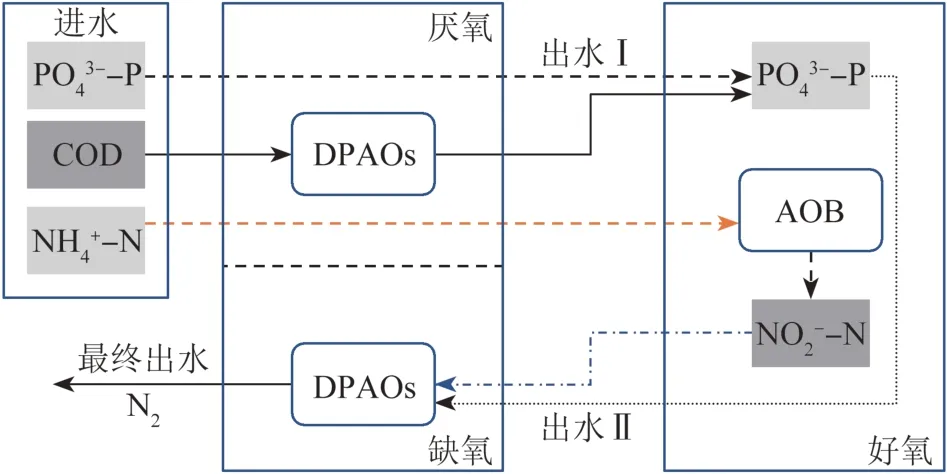
图4 PN-DPR工艺流程Fig.4 Technological process of PN-DPR
PN-DPR工艺可在单污泥系统和双污泥系统中进行。单污泥系统的特点在于不同时间与空间的微生物具有协同作用,达到脱氮除磷效果。该系统有利于颗粒污泥的形成,使微生物量得到保留。Jianhua ZHANG等〔73〕在SBR反应器中接种富含聚磷菌的絮体污泥,采用较短的SRT、合理搅拌与曝气等条件成功洗脱NOB,达到短程硝化耦合反硝化除磷的目的,并在第63天成功富集形成功能颗粒污泥。Chuansheng YUAN等〔74〕建立了PN-DPR单污泥系统对低碳氮比(3.4)的实际生活污水进行研究,在266 d的稳定运行过程中总氮、磷的去除率分别达到81.4%、91%,颗粒污泥也在长期低DO和低负荷条件下逐渐形成,避免了污泥膨胀,证实了该工艺处理实际污水的可行性。
单污泥系统存在微生物间生境的矛盾〔90〕,而双污泥系统在独立格室中分别进行短程硝化和反硝化除磷,提供适宜生长的条件,促进微生物生长,形成高效稳定的脱氮除磷系统〔91〕。常见的采用双污泥系统运行的PN-DPR装置有A2N-SBR工艺、AAO工艺、A2O-MBBR工艺、MUCT工艺及ABR-MBR工艺等。Miao ZHANG等〔76〕研究了浓度与回流液NOx--N比例对反硝化除磷的影响,发现NO3--N、NO2--N溶液浓度较高时反硝化除磷菌会受到不同程度的抑制,但PN-DPR系统去除1 mg PO43--P消耗的碳源仍远低于常规EBPR系统,并节省16%碳源和15%氧耗。ABR-MBR工艺利用厌氧折流板反应器结构简单、整体推流单格完全混合的特点〔92〕,在前端格室对大分子有机物进行降解,为后端反硝化除磷提供优质碳源;利用膜生物反应器高效截留微生物〔93〕,为氨氧化细菌富集提供有利条件,形成高效稳定的PN-DPR工艺。为避免污泥回流破坏ABR的相分离特点,缪新年等〔78〕探索了无污泥回流情况下ABRMBR工艺实现短程硝化耦合反硝化除磷的可能性,通过缩短HRT提升水力负荷〔0.48~1.2 kg∕(m3‧d)〕,MBR回流液中ρ(NO2--N)∶ρ(NO3--N)逐渐升 高(0.029~1.68),ABR回流格室内逐渐形成以亚硝氮为电子受体进行缺氧吸磷的聚磷菌;回流比达到150%时,回流格室的PO43--P去除率可达64.94%,证明了该工艺的可行性。其反硝化除磷机理可能与回流格室内的氧化还原电位分布及污泥颗粒化形成的厌氧缺氧交替环境有关〔94〕,该机理的准确性有待进一步研究。
4 结语与展望
(1)大部分短程硝化工艺的优势种群为AOB,但AOA在极端环境下(低温低氧)的适应性更强,使得短程硝化具有多环境适用的可能性。AOA对底物的反应机理,AOA与环境微生物之间的竞争合作关系有待进一步探索。
(2)抑制NOB活性的手段并不单一,单因素控制不一定会对NOB产生抑制作用,甚至会影响AOB的活性,需联合其他因素控制达到长期稳定运行。化学抑制剂的投加量需根据实际条件考量,并考虑其降解性以减少对环境的二次污染。
(3)短程硝化与各后端脱氮工艺耦合形成的新型生物脱氮工艺具有更高效、低耗的性能。其不同反应机理增加了处理废水种类的多样性。通过分子生物学技术研究微生物内部聚合物丰度变化以及种群间协同竞争机制,将成为新型脱氮技术处理实际污水的新方向。
