阳离子脂质体载药系统的制备及其体外成像治疗一体化应用研究
2022-04-26罗婷婷潘炜伦涂嫣红李博郑磊
罗婷婷 潘炜伦 涂嫣红 李博 郑磊
南方医科大学南方医院检验科(广州510515)
癌症是危害人类健康的重大疾病之一,纳米医药技术的发展为癌症的精准治疗提供了一个有效的方案。但纳米药物在临床转化方面仍存在挑战,如纳米颗粒的潜在生物毒性、肿瘤的耐药性、药物到达病灶效率低下等。因此,对纳米药物在人体内的去向,以及其在肿瘤灶中的治疗效果进行追踪监测势在必行。诊疗一体化是一种将疾病的诊断或监测与治疗有机结合的新型生物医学技术,对于提高癌症的治疗效果和减小副作用等方面具有显著优势。
阿霉素(doxorubicin,DOX)是一种常用的化疗药物,被广泛用于肿瘤治疗,但仍存在脱靶严重、对正常细胞毒性高等缺陷[1]。脂质体[2-4](liposomes,LPs)是两性分子在水相环境中形成的类似生物膜结构的双分子层封闭囊泡,其生物相容性好、稳定性佳、毒性低,且能够负载种类多样的治疗靶向药物,是实行癌症诊疗一体化策略的良好载体[5]。脂质体类纳米药物在到达癌症病灶后主要依靠胞吞作用与膜融合效应进入肿瘤细胞内,其中阳离子脂质体(cationic liposomes,CLPs)[3,6]由正电荷脂质构成,与阴离子脂质体相比,对细胞膜有更强的膜融合效果,进而促进脂质体入胞效率,提升药物治疗效率。此外,DOX 具有可激发荧光信号,便于观察药物与细胞间的相互作用。本研究通过对DOX 作用于肿瘤细胞的方式进行改进,以CLPs 作为载体,DOX 作为治疗剂与成像分子,通过一锅法制备CLPs-DOX 纳米载药系统[7],用作乳腺癌细胞的治疗与成像,达到诊疗一体化的目标。
1 材料与方法
1.1 实验材料 二油酰氧基丙基三乙铵(DSPC)、二硬脂酰-磷脂酰乙醇胺-聚乙二醇-羧基(DSPEPEG-COOH)购自Aladdin 公司、胆固醇、氯仿、盐酸-阿霉素、聚乙二醇辛基苯基醚(Triton X-100)、磷酸盐缓冲液(PBS,1×,pH 7.4)、DMEM 培养液、96 孔板、胎牛血清(FBS)、胰酶消化液、青霉素-链霉素溶液、CCK8 细胞增殖毒性检测试剂盒购自广州学友生物科技有限公司。
1.2 合成CLPs 和CLPs-DOX 一锅法合成CLPs-DOX 和CLPs:DSPC(80 μL,1.0 mmol/L),DSPEPEG-COOH(80 μL,1.0 mmol/L)、胆固醇(25 μL,1.0 mmol/L)和不同浓度DOX 混匀于3 mL 氯仿。减压蒸干氯仿后,底部可见一层不透明薄膜,加入2 mL 纯水或PBS 重悬,然后依次通过0.2 μm 的聚碳酯纤维膜反复挤压20 次,得到粒径均一的CLPs、CLPs-DOX 溶液,放置于4 ℃保存备用。
挤出法合成CLPs-DOX:通过将上述合成的CLPs 中加入相同浓度的DOX,超声混匀后,将上述混合物通过0.2 μm 的聚碳酯纤维膜反复挤压20 次,得到粒径均一的CLPs-DOX 溶液,放置于4 ℃保存备用。
1.3 细胞培养与成像 用培养皿培养乳腺癌MDA-MB-231 细胞,添加含有10%FBS 的DMEM 培养液和1%青霉素-链霉素,在37 ℃和5%CO2的孵箱中进行培养。当细胞增殖达到80%时,弃掉培养液,用PBS 缓冲液洗涤两次,在每一个皿分别加入PBS、1 × 1010个CLPs、CLPs-DOX 和对应浓度的DOX,置于培养箱中培养12 h。
吸出培养基,细胞用PBS 缓冲液洗涤两次进行成像实验。成像实验中使用共聚焦显微镜观察,用波长为488 nm 的激光激发,收集对应通道的荧光信号。
1.4 CCK8 细胞毒性实验 将乳腺癌细胞按照每孔约5 000 个细胞种在96 孔板中,加入含有10%FBS 的DMEM 培养液,并置于37 ℃、5% CO2的孵箱中培养24 h。每板分别加入0、0.1×108、1×108、5 × 108、1 × 109个CLPs、CLPs-DOX 和对应浓度的DOX,每个浓度设置六个子孔并置于37 ℃、5%CO2的孵箱中培养48 h。弃去各孔中的培养液,加入100 μL DMEM 不完全高糖培养基,及10 μL CCK-8试剂并在培养箱中孵育1 h,用酶标仪测量450 nm处的吸光度。
2 结果
2.1 纳米流式细胞术对比一锅法和挤出法的DOX装载效率 纳米流式细胞仪是一种能够检测纳米级别颗粒(30~200 nm)的新型检测手段,可以区分出无荧光的CLPs 和有荧光的CLPs-DOX,并有效排除游离DOX 的影响。在同样的DOX 浓度下(图1A),一锅法比挤出法的装载效率高(70.8%),后续实验选择一锅法合成具有治疗与成像效果的CLPs-DOX。
2.2 DOX 转载入CLPs 的条件优化及验证 对DOX 转载入CLPs 的浓度进行条件优化,结果表明(图1B)荧光响应值与DOX 装载量相关,随着DOX浓度的升高,荧光响应值逐渐增大,当DOX 浓度达到150 nmol/L 时,装载量达到饱和。因此后续实验均用150 nmol/L DOX 合成CLPs-DOX。且CLPs-DOX 治疗平台在荧光发射光谱上与DOX 相一致(图1C),CLPs-DOX 应用于癌细胞成像时,无需重新选取荧光发射光谱。此外,CLPs-DOX 被Triton X-100 裂解前后的荧光响应值增加(图1D),说明CLPs 装载DOX 后会减弱DOX 的荧光值,当CLPs-DOX 被Triton X-100 裂解后,DOX 从CLPs 中 释放导致荧光增强。本实验进一步说明了DOX 已成功装载入CLPs 中。

图1 CLPs-DOX 合成条件优化及性能验证Fig.1 Optimization of CLPs-DOX synthesis conditions and performance verification
2.3 CLPs-DOX与CLPs表征 图2A表示CLPs粒径集中在85 nm处,CLPs-DOX 粒径集中在81 nm 和118 nm 处,且CLPs 在装载前后表现出良好的粒径分布,大小处于200 nm 之内。且CLPs-DOX 相比CLPs 电位降低(图2B)。对CLPs-DOX 与CLPs 的粒径变化持续监测10 d,显示稳定性良好(图2C)。
2.4 CLPs-DOX 的体外治疗效果 CCK-8 检测法是用于测量活细胞数量的高灵敏度方法,能够反应CLPs-DOX 的细胞杀伤能力。图2D 表示通过对不同浓度DOX 的荧光检测得到DOX 标准曲线,换算出与CLPs-DOX 同等的DOX 浓度。图3 中CCK-8细胞毒性实验结果显示,乳腺癌MDA-MB-231 细胞的活性随DOX、CLPs-DOX 浓度的升高而降低,当CLPs-DOX 数量为1 × 108个时,细胞死亡率达80%,近似于DOX 的杀伤效率,证明了CLPs-DOX在体外对于细胞的毒性杀伤能力和DOX 可比性高,DOX 包裹进脂质体内没有减弱其细胞毒性能力。
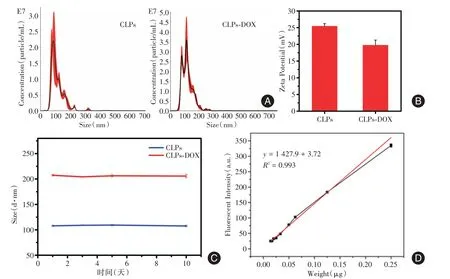
图2 CLPs 和CLPs-DOX 表征Fig.2 Characterization of CLPs and CLPs-DOX
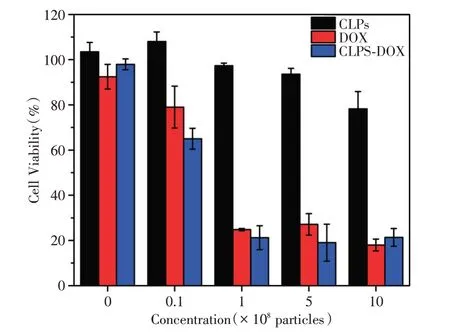
图3 MDA-MB-231 细胞与不同浓度CLPs、DOX、CLPs-DOX 孵育后的细胞活性Fig.3 Cell viability of MDA-MB-231 cells after incubation with different concentrations of CLPs,DOX and CLPs-DOX
2.5 细胞成像实验 为了验证CLPs-DOX的癌细胞成像效果,将适量的乳腺癌MDA-MB-231 细胞接种共聚焦皿中,分别加入1 × 1010个CLPs、CLPs-DOX和对应浓度的DOX,使用共聚焦显微镜进行观察。
图4 表示使用共聚焦显微镜对所处理细胞的观察结果:对照组PBS 和CLPs 皆无荧光,而实验组DOX 和CLPs-DOX 中呈现出强荧光,说明细胞内的荧光来自于DOX,CLPs-DOX 能够较好地进入细胞当中发挥细胞成像作用。

图4 不同处理组的共聚焦显微镜观察结果Fig.4 Confocal microscopy observation results of different treatment groups
图5 表示共聚焦显微镜分析软件ZEN 查看荧光图片的算数荧光强度,由图可知,DOX、CLPs-DOX 在细胞内的平均荧光强度分别为8.37 和9.62(a.u.)。DOX 装载入CLPs 后荧光信号变强,可以说明DOX 装载入CLPs 后进入细胞的能力更强,具有更优的成像效果。
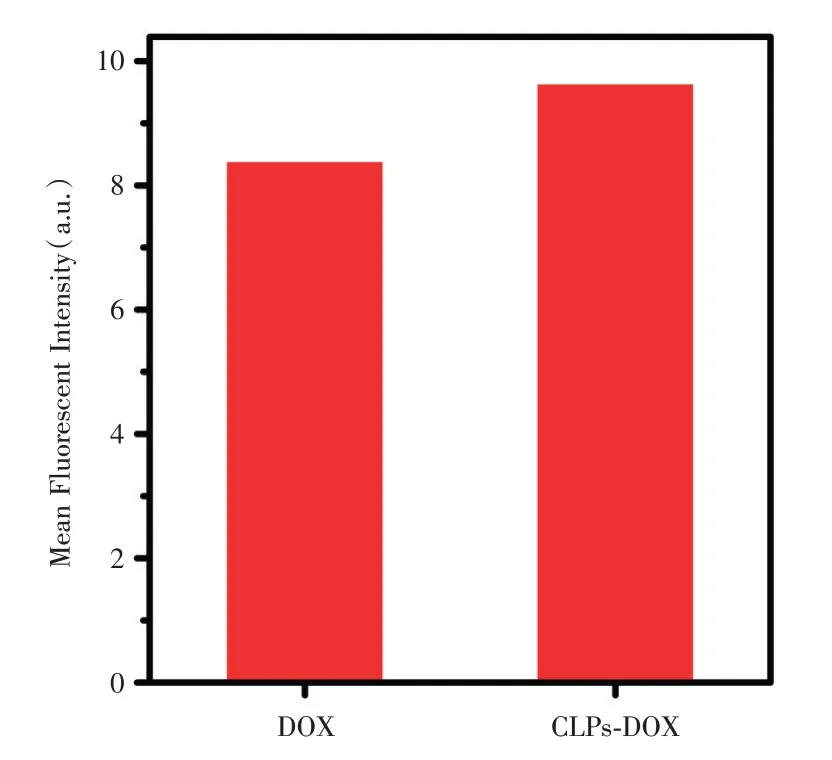
图5 MDA-MB-231 细胞内的平均荧光强度Fig.5 Average fluorescence intensity of MDA-MB-231 cells
3 结论
目前临床肿瘤药物治疗具有毒副作用较大,治疗效果难以及时评估等缺陷,其中纳米技术的诊疗一体化通过将纳米材料递送至肿瘤部位,并指示肿瘤病灶,在抗肿瘤诊疗中有较大的发展前景。本研究采用一锅法合成的CLPs-DOX,粒径均一在200 nm 以内,稳定性良好,药物装载效率高。并在体外实验中验证其负载DOX 进入肿瘤细胞并进行荧光标记的可行性。由于脂质体表面阳离子电荷使CLPs-DOX 具有更高的细胞内化效率,可有效发挥抗肿瘤效果。CLPs-DOX 作为乳腺癌细胞诊疗一体化平台其优势如下:(1)CLPs 膜融合作用效果显著,增强药物进入肿瘤细胞的效率,提高病灶药物浓度;(2)癌细胞常处于组织深部,游离化疗药物难以到达,CLPs-DOX 可通过癌细胞诱导形成的血管间隙聚集在病灶,同时减轻高浓度游离药物引起的不良反应;(3)能够通过成像技术分析载药体系与肿瘤细胞的相互作用,监测药物治疗过程和反馈药物治疗效果[8];(4)体内可被生物降解,免疫原性小。根据文献报道,在小鼠实验中,用脂质体载DOX 治疗的小鼠肿瘤在实验过程中体积递减,与对照组相比具有显著性差异[9]。此外,游离DOX 注入荷瘤小鼠中,体外成像可见其荧光强度随时间不规则地变化,然后分散到其他组织或代谢后排泄,而载DOX 纳米胶束在肿瘤中的积累大于游离DOX[10],因此CLPs-DOX 有望成为极具潜力的肿瘤诊疗一体化平台。
然而,由于本实验采用的脂质体为阳离子脂质体,作为肿瘤诊疗一体化方案缺乏肿瘤靶向性。因此可通过工程化改造的方法对CLPs-DOX进行修饰和改造,以达到更精准靶向治疗诊断的效果。例如,cRGD 环肽具有靶向恶性肿瘤细胞的作用[11],将cRGD 修饰在纳米颗粒表面可增加载药纳米颗粒的靶向性[12-13]。透明质酸与其受体CD44具有较强的结合效应[14],CD44 较多表达于肿瘤干细胞表面,有文献报道,通过在纳米载药颗粒表面修饰透明质酸具有靶向肿瘤部位的作用[14-16],因此,理论上cRGD 或透明质酸修饰的CLPs-DOX 也具有靶向肿瘤细胞的效果。除了对CLPs-DOX 的修饰,也可对脂质体进行进一步的改造。目前pH敏感载药脂质体也已有较多的研究[17-18],肿瘤细胞由于代谢旺盛,肿瘤微环境为酸性环境,pH 敏感载药脂质体在到达肿瘤细胞酸性环境中后发生相变,释放内部装载药物,也可以达到靶向肿瘤治疗的效果。此外,脂质体杂交肿瘤细胞外泌体也是改善肿瘤靶向性的策略之一[19-20]。肿瘤细胞来源外泌体作为肿瘤细胞释放的脂质纳米囊泡,继承了肿瘤细胞的部分膜表面蛋白,不仅可以发挥免疫逃避的作用,也具有携带纳米抗肿瘤药物归巢的效果,通过将CLPs-DOX 与肿瘤外泌体融合,可提高细胞传递效率。以上方案均为CLPs-DOX修饰和改造后,提高肿瘤靶向诊疗效率提供借鉴和理论基础。
综上所述,本研究构建了CLPs-DOX 诊疗一体化平台,证实其在体外乳腺癌肿瘤细胞成像,及抗乳腺癌治疗的可行性,为进一步开发应用CLPs-DOX 肿瘤诊疗一体化提供理论和实验基础,为肿瘤精准诊疗提供发展新方向。
