新型冠状病毒Delta变异株早期病毒载量与临床特征的关系
2022-04-26黄春明胡中伟黄韫詹远京
黄春明 胡中伟 黄韫 詹远京
广州医科大学附属市八医院隔离十九区(广州510060)
当机体受外来病原体入侵,病毒载量与宿主因素均可能影响病情进展及预后[1-2]。目前临床研究更多关注宿主临床表现及治疗,而病毒载量对于疾病的影响关注较少,本研究根据RT-PCR 检测鼻拭子核酸水平,探讨新型冠状病毒(SARS-Cov-2)Delta 变异株早期病毒载量与临床特征及病毒转阴时间的关系。
1 资料与方法
1.1 研究对象及分组 选取2021年5月21日至2021年6月18日广州医科大学附属市八医院隔离病区收治的广州SARS-Cov-2Delta 变异株确诊病人,共108 例成年患者纳入本研究,所有患者均符合《新型冠状病毒肺炎诊疗方案(试行第八版)》诊断标准[3],RT-PCR 检测结果表示为周期阈值(Ct),Ct 值越小,病毒复制拷贝越活跃,病毒载量越高,Ct 值>40,判定为阴性。高拷贝组定义:1 周内N 基因和(或)Orf1a/b 基因Ct 值<20,低拷贝组:1 周内N 基因和(或)Orf1a/b 基因Ct 值≥20。病毒转阴时间定义:从第一次鼻咽拭子阳性到两次连续(间隔>24 h)阴性试验中的第一次的时间。本研究所有患者签署知情同意书,获得广州市第八人民医院伦理委员会批准(202007140)。
1.2 临床资料收集 Delta 变异株感染病人资料收集均来自医院电子病历系统,包括性别、年龄、入院基线血常规、T 淋巴细胞亚群和第1 周血常规,以及住院期间核酸结果(每例患者间隔1 d 采集鼻拭子,由医院研究所采用RT-PCR 检测病毒核酸)。全部病例首次SARS-Cov-2 核酸阳性由广州市疾病预防控制中心确定,广东省疾病预防控制中心确定病毒株基因测序。
1.3 统计学方法 采用SPSS 22.0 软件,正态分布的计量资料采用()表示,两组间比较采用独立样本t检验;非正态分布的计量资料,采用M(P25,P75)表达,比较两组间差异性采用非参数检验(Mann-WhitneyU秩和检验)。两个率的比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况 全组患者Ct 值最低值发生在住院第2(0,3)d,N 基因(20.5 ± 5.7),Orf1a/b 基因(22.1±5.7)。高拷贝组纳入59例(其中男38例),平均年龄(54.5±18.2)岁,N 基因(16.6±2.1),Orf1a/b基因(18.2±2.1);低拷贝组纳入49例(其中男27例),平均年龄(59.4±16.8)岁,N基因(25.2±5.2),Orf1a/b基因(26.7±5.1),两组间性别、年龄差异无统计学意义(P>0.05)。与低拷贝组比较,高拷贝组合并糖尿病比例更高(P<0.05),但两组重症率和其他慢性基础性疾病差异均无统计学意义(P>0.05)。高拷贝组患者咽喉不适和腹泻比例更高(P<0.05),其他症状差异均无统计学意义(P>0.05,表1)。

表1 两组患者基础病和临床表现比较Tab.1 Comparison of basic diseases and clinical manifestations between the two groups 例(%)
2.2 两组患者实验室结果分析 与基线低拷贝组比较,高拷贝组基线CD4+T 淋巴细胞更低(P<0.05),CD3+和CD8+T 淋巴细胞数值更低,但差异无统计学意义(P>0.05);两组患者基线时外周血淋巴细胞(LYM)和嗜酸性粒细胞(EOS)差异无统计学意义(P>0.05)。与第1周低拷贝组比较,高拷贝组LYM 和EOS 更低(P<0.05,表2)。与高拷贝组基线纵向比较,高拷贝组第1 周LYM 和EOS 差异无统计学意义(P>0.05)。与低拷贝组基线比较,低拷贝组第1 周LYM 和EOS 更高(P<0.05,表2)。由于第1 周复查T 淋巴细胞亚群例数很少,因此未做比较。
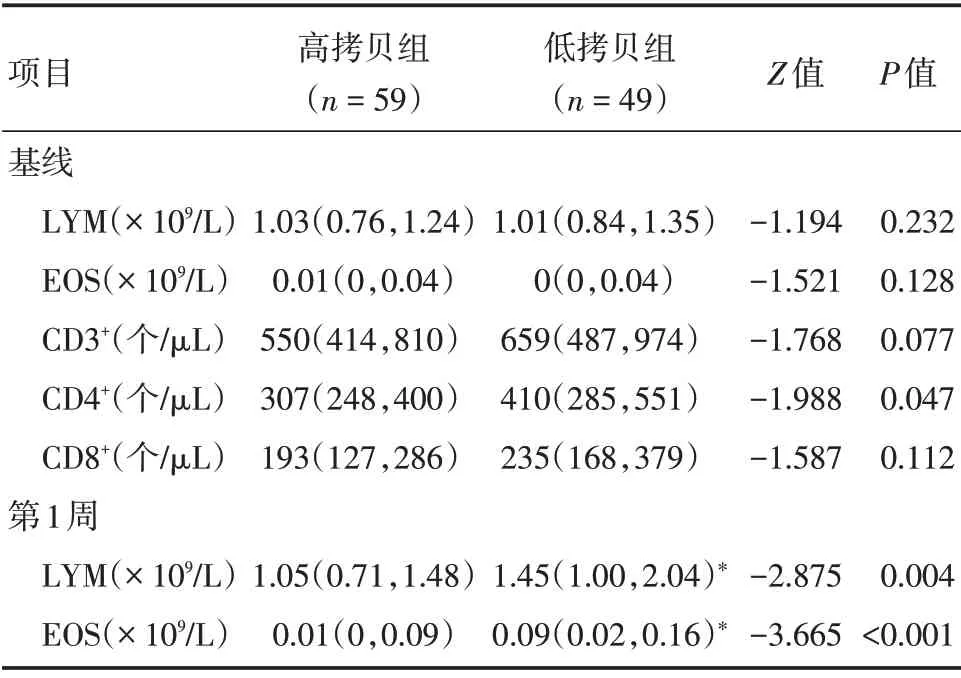
表2 两组患者纵向和横向实验室结果比较Tab.2 Comparison of longitudinal and transverse laboratory results between the two groups M(P25,P75)
2.3 两组患者实验室检验异常率比较 两组患者基线CD3+、CD4+和CD8+T 淋巴细胞减少很常见,两组患者基线外周血LYM 和EOS 减少亦很常见。与低拷贝组横向比较,高拷贝组第1 周LYM 和EOS减少更常见(P<0.05),而两组患者基线时各项指标异常率差异无统计学意义(P>0.05)。
纵向比较,低拷贝组第1 周LYM 和EOS 减少率明显降低(P<0.05),而高拷贝组基线和第1 周LYM 和EOS 减少率差异无统计学意义(P>0.05,表3)。

表3 两组患者生化异常率比较Tab.3 Comparison of biochemical abnormality rates between the two groups 例(%)
2.4 相关性分析 采用Pearson 相关分析显示,Ct 值与第1 周LYM 和EOS 呈正相关(r= 0.261、0.333,P<0.05);Ct 值与病毒转阴时间呈负相关,(r=-0.289,P<0.05)。
2.5 两组患者治疗及临床转归 两组患者均未使用任何抗病毒药,治疗上使用抗生素、激素、高流量湿化氧疗和有创通气差异均无统计学意义(P>0.05)。与低拷贝组比较,高拷贝组病毒转阴时间更长(均P<0.05,表4),两组患者无一例死亡,总体预后良好。
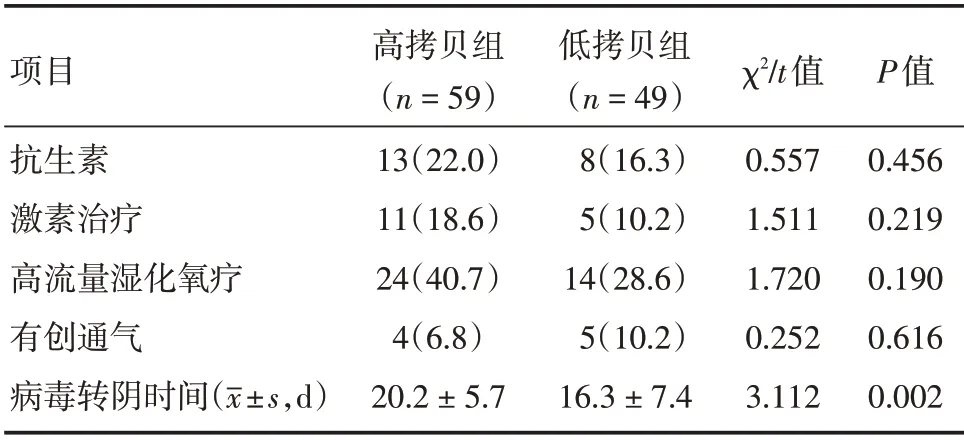
表4 两组患者治疗及临床转归比较Tab.4 Comparison of treatment and clinical outcome between the two groups 例(%)
3 讨论
SARS-CoV-2 去年席卷全球,成为全球公共卫生事件,更让人担忧的是病毒不断变异[4],今年5月广州首次报道本地SARS-CoV-2 Delta 变异株感染者,广东省疾病预防控制中心提示广州本地流行的SARS-CoV-2 Delta 变异株病毒载量是去年野生株的1 260 倍[5],引起广泛的关注。目前尚无Delta变异株上呼吸道病毒载量与临床特征及病毒转阴时间的报道,本文将本院收治的Delta 病毒株感染者情况作总结,为疫情防控提供帮助。
本研究共纳入108 例成年患者,采用RT-PCR检测鼻拭子病毒核酸,Ct 值越低,说明病毒载量越高。病人Ct 最低值中位数为住院第2(0,3)d,N 基因(20.5±5.7),Orf1a/b 基因(22.1±5.7),本次疫情所有患者均为广州市疾病预防控制中心确诊当天,立即送往我院隔离诊治,这提示大多数Delta变异株患者在检测阳性3 d 内病毒复制最活跃,此时可能传染性最强。而野生株研究资料显示上呼吸道病毒载量峰值大概为1 周,因此,Delta 变异株比野生株病毒载量峰值更早[6]。
本研究以Ct 值20 作截点分为高拷贝组和低拷贝组,结果显示高拷贝组和低拷贝组咳嗽和咳痰比例均高,其中咳嗽分别占91.5%和81.6%,两组患者均有明显呼吸道症状,这说明病毒入侵细胞途径及呼吸道损害机制具有共性,咳嗽、咳痰与早期病毒载量无关;另外,高拷贝组咽喉不适和腹泻比例更高,而咽喉和肠上皮亦有血管紧张素Ⅱ(ACE-II)表达[7],这提示高病毒载量可能导致咽部黏膜及肠上皮黏膜损伤加重。
目前糖尿病患者早期病毒载量的报道少,本研究显示,高拷贝组患者合并糖尿病的比例更高(20.3%vs.6.1%),这说明糖尿病患者早期体内病毒复制更活跃,将有无合并糖尿病作为因变量,病毒转阴时间作为变量,合并糖尿病患者病毒转阴时间更长(20 dvs.17 d,P= 0.041)。糖尿病对病毒复制及清除的影响机制尚不明确,ACE-Ⅱ是SARS-CoV-2 进入机体受体,在各种组织中均有表达,包括肺、上呼吸道、心脏、肾小管、小肠黏膜和血管等[7],糖尿病患者多个组织中ACE-Ⅱ表达的增加可能增加SARS-CoV-2 感染的风险[8],同时许多降糖药物可以增加ACE-Ⅱ的表达[9],难于控制的高血糖可促进肺、鼻气道、舌头和口咽的异常ACE-Ⅱ糖基化,可能增加SARS-CoV-2 的结合位点[10],糖尿病除了影响SARS-Cov-2 进入细胞,还对感染的炎症反应有影响,病毒清除时间更长[11],这与糖尿病患者易感染因素(中性粒细胞趋化性和吞噬功能受损)有关外,还可能与T 淋巴细胞功能受损和IL-6 等多种因子介导的炎症因子风暴有关[12]。
SARS-CoV-2 感染可激活先天性和适应性免疫反应,淋巴细胞和嗜酸性粒细胞是参与病毒免疫清除的适应性免疫细胞[2,13-14]。本研究高拷贝组基线CD3+、CD4+和CD8+T 淋巴细胞降低比例超过80%,低拷贝组三者降低比例约70%,其中高拷贝组CD4+T 淋巴细胞计数更低,CD3+和CD8+T 淋巴细胞计数更低趋势,这说明SARS-Cov-2 Delta 变异株感染早期已普遍存在免疫抑制、免疫消耗,这与去年野生株免疫损伤表现一致[15]。笔者分析基线和第1 周淋巴细胞计数和嗜酸性粒细胞计数动态变化趋势,两组患者基线时淋巴细胞和嗜酸性粒细胞减少均超过50%,随着病情迁延,1 周后高拷贝组淋巴细胞和嗜酸性粒细胞更低,恢复也更慢,Ct 值与第1 周淋巴细胞、嗜酸性粒细胞呈正相关(即病毒载量与淋巴细胞、嗜酸性粒细胞负相关),这与以往研究结论一致[16-19]。上呼吸道病毒载量与免疫细胞存在关联,这种现象已被学者认知,但如何解释这个现象,目前其病理生理机制尚未阐明,一般认为机体感染SARS-CoV-2 后,宿主细胞释放的趋化因子刺激不同免疫细胞(包括淋巴细胞、嗜酸性粒细胞等)的募集[20-21],淋巴细胞在靶器官浸润被尸检报告证实[22],高病毒载量可导致更严重的炎症及免疫反应[16,18,22],免疫清除和免疫消耗更激烈,导致外周血淋巴细胞降低;嗜酸性粒细胞由多能造血干细胞发育而来的,尸检报告未显示靶器官嗜酸性粒细胞浸润[22],但既往研究提示病毒感染可直接抑制骨髓功能减少嗜酸性粒细胞生成[23],笔者推测SARS-Cov-2 Delta 变异株可能也具有直接抑制骨髓功能,从而影响其生命周期,具体病理生理机制需要病毒动力学研究进一步论证。
病毒载量是否影响病毒转阴时间、临床诊治及预后亦备受临床关注,现有研究存在异质性。首先,高病毒载量可能延缓病毒转阴,本研究患者提示高拷贝组患者病毒转阴时间更长(20 dvs.16 d),Ct 值与病毒转阴时间呈负相关(即病毒载量与病毒转阴时间呈正相关),这与LIU 等[24]研究结果一致,因此病毒载量高是病毒清除延迟的一个重要因素;然后,高病毒载量是否影响不良预后(重症率和死亡率),目前尚无定论[25]。本研究经积极抢救治疗,无一例死亡,两组患者重症率和死亡率差异无统计学意义,高病毒载量组采用高流量湿化氧疗和糖皮质激素治疗比例更高趋势,但尚未达到统计学差异,由于本研究样本量较少,尤其是重症患者少,不排除可能造成偏倚。国内外有关病毒载量对临床分型、预后的影响已有不少的报道,YIN 等[19]研究提示轻型、重型和危重型COVID-19 患者的上呼吸道病毒载量相似;SALTOALEJANDRE 等[26]发现COVID-19 患者的病毒载量在住院期间的不利影响更高,但高病毒载量不是COVID-19 成人患者不良临床结局(入住ICU 或死亡)的独立危险因素;MOSTAFA 等[27]采用鼻咽拭子进行宏基因组测序表明,病毒载量的增加与早期阶段相关,而不是与疾病严重程度相关,上述研究与本研究结论一致。然而,亦有综述提示上呼吸道病毒载量与疾病严重程度及不良预后相关。现有研究很少关注疾病发病时间、采集核酸时间及核酸动态变化,而且不同的病毒株、样本采集部位、人口学特征及检测试剂敏感性等均可能影响病毒核酸水平,从而导致结果偏倚。从我院收治的Delta 变异株临床资料分析,疾病的发生和发展可能是宿主与病毒共同作用的结果,病情进展可能与病毒载量、宿主人口学特征、免疫损伤和炎症风暴等多因素有关,单独病毒载量预测不良预后的价值有限。
本研究具有一些局限性,(1)本研究病例数较少,尤其重症患者少,仅为广州地区、单中心病人;(2)本研究采用RT-PCR 检测病毒核酸,并非病毒培养鉴定。
总之,本研究首次分析了SARS-Cov-2 Delta 变异株早期病毒核酸水平,大多数患者病毒复制最活跃是住院前3 d,上呼吸道病毒载量与第1 周淋巴细胞、嗜酸性粒细胞呈负相关,与病毒转阴时间呈正相关,高病毒臷量是上呼吸道病毒延迟清除的重要因素;糖尿病可能影响上呼吸道病毒载量及病毒清除时间。另外,笔者未发现病毒载量与疾疾严重程度的关联性。由于本研究重症患者少,无死亡病例,病毒载量是否影响治疗及预后需要进一步临床验证。COVID-19 发生、发展可能涉及病毒载量、人口学特征、炎症风暴、免疫抑制、免疫损伤和免疫消耗等多个因素,下一步研究可探索宿主个体化炎症和免疫反应对COVID-19 病程和预后的影响,采用病毒动力学研究探讨病毒载量与机体免疫的病理生理机制。
