六味地黄丸含药血清对β-淀粉样蛋白损伤PC12细胞中FoxO3a/p-FoxO3a蛋白表达的影响*
2022-04-26宋军营王丛笑贾亚泉谢治深房红锴张振强
袁 永,宋军营,王丛笑,贾亚泉,谢治深,蔡 菊,房红锴,张振强
(河南中医药大学中医药科学院 郑州 450046)
阿尔茨海默病是一种发生于老年人中的中枢神经系统退行性疾病,是老年痴呆最常见的类型。多年来,该病发病率呈逐年上升趋势,严重危害老年人的身心健康和生活质量[1,2]。“β-淀粉样蛋白级联假说”是基于Aβ(amyloid β-protein,Aβ)异常沉积这一病理特征所建立的AD 病因假说,该假说认为,脑内Aβ 的积累具有神经毒性,过量的Aβ 会造成神经细胞的氧化应激、突触改变、Tau 蛋白磷酸化、神经递质丢失等,以及胶质细胞的增生和炎症反应[3-4]。这些改变能够进一步引起神经系统的病理损伤,如老年斑块形成、神经纤维缠结等,造成神经元功能障碍甚至变性和死亡,进而导致AD 的发生。根据AD 发生的过程,降低细胞内氧化应激,抑制神经细胞变性、凋亡,促进神经细胞修复等已成为研究热点[5]。
FoxO3a作为一种重要的叉头蛋白转录因子,能够通过与其所识别DNA元件相结合,调控靶基因的转录和翻译,在调控细胞周期、凋亡、活性氧清除、自噬、细胞稳态和氧化应激反应等方面发挥重要作用[6-7]。有研究表明,血清中FoxO3a 水平的变化可用来区分AD与轻度认知障碍(Mild Cognitive Impairment,MCI)以及AD 与正常衰老(geriatric control,GC),可能成为治疗AD 的 潜 在 新 靶 点[8-9]。 FoxO3a 和 Bim(Bcl-2 interacting mediator of cell death)在神经细胞中过表达,会导致Aβ 的产生并过度积累,进而引起神经毒性,该过程是AD的病理发展重要因素[10]。另有研究发现,在H2O2诱导的人神经母瘤细胞(SH-SY5Y)模型中,有多种药物可通过SIRT/FoxO3a 通路提升超氧化物歧化 酶(superoxide dismutase,SOD)和 过 氧 化 氢 酶(catalase,CAT)的酶活性,减少细胞内的ROS,降低氧化应激造成的细胞死亡,从而保护神经细胞不受氧化应激损伤[11,12]。磷酸化是Forkhead 转录因子家族成员重要的上游修饰途径,激活AKT(Protein Kinase B)可使FoxO3a 磷酸化,磷酸化的FoxO3a 从细胞核转运至细胞质,经过泛素化修饰而降解,失去其转录活性,从而导致细胞增殖,反之亦然[13,14]。因此,通过FoxO3a与磷酸化FoxO3a(p-FoxO3a)的转化,间接调节下游凋亡相关基因的表达,是干预神经细胞的凋亡的方式之一。
中医认为老年痴呆的病因多以内因为主,或因肾精亏耗,气血不足,痰瘀互阻,脑髓失养;或因七情内伤,久病耗损,年迈体虚,致气、血、痰、郁、瘀等病邪为患。在痴呆的辨证分型方面主要以肾虚和痰证为主,治疗也多以补肾益髓、化瘀止痰、补肾活血等为主要方法[15,16]。现代中西医结合研究证实,大脑皮质及海马区的神经细胞大量减少是其主要病理特征之一,而脑内Aβ 不断积累所造成的的神经细胞氧化应激、凋亡等是造成这一特征的重要原因。
六味地黄丸是宋代钱仲阳依据《金匮要略》所载崔氏八味丸去桂枝、附子而成,是中医填精、滋阴、补肾的经典方剂。在临床应用中发现,六味地黄丸可以通过调节内分泌、降压降脂、降血糖等来防治痴呆、高血压、糖尿病等老年疾病,在改善AD 患者的记忆、智力、精神和行为等方面具有较明显的效果,其机理可能与改善脑内代谢,抗氧化,减少神经细胞凋亡有关[17,18]。在减轻Aβ 的神经细胞毒性方面,六味地黄丸也具有显著效果[19]。有研究表明,六味地黄丸在改善AD 模型小鼠的记忆和认知功能方面有明显效果,可以不同程度地改善或延缓AD 病程的发展,甚至达到预防早期老年性痴呆的功效,但是其对AD 发挥作用的分子机理还不明确[20]。
本课题组综合文献资料,在前期应用六味地黄丸对AD 的保护作用基础上,进一步研究其对神经细胞内FoxO3a/p-FoxO3a 的影响,探讨应用六味地黄丸预防和治疗阿尔茨海默病的分子机制。
1 材料与方法
1.1 实验材料
PC12细胞由昆明理工大学医学部白洁教授赠予。SPF 级雄性SD 大鼠购自北京维通利华实验动物技术有限公司〔合格证编号:SCXK(京)2012-0001〕。六味地黄丸浓缩丸为河南省宛西制药股份有限公司产品(批号:110316)。
1.2 主要试剂
FoxO3a/p-FoxO3a抗体(美国Epitomics 公司,货号分别为3280-1,7205-1),Aβ25-35(美国SIGMA 公司,货号:A4559),兔抗鼠β-actin 抗体(Abways 公司,货号:P60709),山羊抗兔抗体(博士德生物工程有限公司,货号:BA1055),MTT〔3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝〕、RIPA 裂解液(RIPA Lysis Buffer)、蛋白酶抑制剂(北京索莱宝科技有限公司,货号分别为298-93-1,P0100,P1250),其余均为国产分析纯试剂。
1.3 主要仪器设备
多功能全波长酶标仪(美国Thermo Fisher 公司,型号:MultiskanGO);高速冷冻离心机(美国BeckmanCoulter 公司,型号:Microfuge®20R);电泳仪(美国Bio-Rad 公司,型号:JY200C);蛋白转印系统(美国BioRad 公司,型号:Mini-Protean);倒置荧光显微镜(德国Leica公司,型号:DFC450C)。
1.4 实验方法
1.4.1 六味地黄丸含药血清(MSLDP)制备
用纯水将粉碎后的六味地黄丸浓缩丸溶解,制备混悬液,将SD 大鼠适应性饲养1 周后,分为给药组和对照组,给药组以1.08 g·kg-1剂量进行灌胃,对照组以等体积的生理盐水灌胃,2 次/天,连续灌胃6 次。第7次灌胃1 h 后,以10%水合氯醛麻醉动物,打开大鼠腹腔,腹主动脉采血。所采全血在室温下静置2 h 后,3000 r·min-1离心10 min,取血清,56℃水浴灭活30 min,再用0.22 μm 无菌滤器过滤除菌,分装后-80℃保存备用。
1.4.2 Aβ25-35配制
将Aβ25-35用超纯水配制成1 mmoL·L-1的母液,吹打混匀后37℃静置“老化”5 天,分装成100 μL/管,-80℃保存备用。
1.4.3 MTT法检测PC12细胞存活率
(1) 细胞培养将RPMI 1640基础培养基中加入5%胎牛血清、10%马血清及100 U·mL-1青/链霉素双抗配制成完全培养基,在37℃、5%CO2、饱和湿度的培养箱中培养PC12 细胞,每隔24 h 换液,3-4 天传代1 次,实验中各组均取处于对数生长期的细胞。
(2) MTT 法检测细胞存活率以2×104个/孔的量将处于对数生长期的PC12细胞加入到96孔细胞培养板中,置于37℃、5%CO2培养箱中培养;将3个96孔板按以下方法处理:第1 个先用RPMI 1640 完全培养基培养24 h,再用含有0、10、20、40 μmol·L-1Aβ25-35的培养基培养24 h;第2 个分别用含有0、2.5%、5.0%、10.0%、20.0%、30.0% MSLDP 的培养基培养48 h;第3 个分为正常对照组(不加Aβ25-35和MSLDP 培养48 h)、模型组(先常规培养24 h,再用含20 μmol·L-1Aβ25-35的培养基处理24h)、MSLDP 预处理组(先用含20%MSLDP 的培养基培养24 h,再用含20 μmol·L-1Aβ25-35的培养基处理24 h);每个浓度设3个复孔。培养结束后先在倒置显微镜下观察各组PC12 细胞的形态,再向各孔加入5 mg·mL-1的MTT 20 μL,37℃静置4 h。结束后1500 r·min-1离心5 min,吸出培养基,向各孔加入150 μL 二甲基亚砜(DMSO),用移液器轻轻吹打各孔使结晶紫完全溶解后,检测各孔590 nm 波长处的吸光值。细胞存活率=实验组吸光值/对照组吸光值×100%。
1.5 Western blot法检测FoxO3a/p-FoxO3a表达水平
以5×104个/mL 的密度将处于对数生长期的PC12细胞接种于6孔细胞板中,培养24 h后,分别加入含有0、10、20、40 μmol·L-1Aβ25-35的RPMI 1640 培养基培养24 h,同时,用含有0、2.5%、5.0%、10.0%、20.0%、30.0% MSLDP 的培养基培养另一组细胞48 h;另取一个六孔板分为正常对照组、模型组、MSLDP 预处理组按(2)方法处理细胞。收集细胞至1.5 mL 离心管内,3000 r·min-1离心5 min,PBS 洗2 次,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液重悬细胞,置冰上裂解30 min 后,13000 r·min-1离心10 min,取上清即为总蛋白,采用标准曲线法测定总蛋白浓度。各组分别取10 μg 蛋白样品进行SDS-PAGE 电泳,300 mA转膜70 min。用5%的脱脂奶4℃封膜过夜;PBST洗膜3 次,加入一抗(1:1000 稀释)室温摇床上孵育2 h;PBST 洗膜3 次,再加入二抗(1:3000 稀释)孵育1 h;PBST 洗膜5 次,加入ECL 化学发光试剂显影,上机检测。
1.6 统计学分析
各组实验结果分别使用Image J1.8.0、GraghPad Prism 8.0 进行图像分析及数据处理。多组实验比较使用单因素方差分析(one-way ANOVA),组内较以最小显著性差异法进行比较。以P<0.05 为差异具有统计学意义。
2 实验结果
2.1 Aβ25-35对PC12细胞存活率的影响
用MTT 法将采用不同浓度Aβ25-35处理的PC12 细胞的存活率进行比较,结果表明,不添加Aβ25-35组的细胞存活率明显高于10、20、40 μmol·L-1Aβ25-35处理组,且随着Aβ25-35浓度的增高,细胞存活率逐渐降低,差异具有统计学意义(P<0.01)(图1)。

图1 Aβ25-35对PC12细胞存活率的影响
在倒置显微镜下观察Aβ25-35处理后PC12 细胞的形态,各组处理后的细胞与不经Aβ25-35处理细胞相比,随着Aβ25-35浓度的增高,各孔内的细胞数目逐渐减少,细胞的形态也变得不规则,并伴随有细胞碎片,凋亡/死亡细胞逐渐增多(图2)。结果表明Aβ25-35对PC12细胞毒性损伤与剂量在一定范围内呈正相关。

图2 Aβ25-35对PC12细胞形态的影响
2.2 Aβ25-35 对PC12 细胞FoxO3a/p-FoxO3a 蛋白表达的影响
将不同浓度Aβ25-35处理的PC12细胞中FoxO3a、p-FoxO3a 表达水平进行比较,低浓度(0、10 μmol·L-1)处理组的p-FoxO3a 蛋白表达量明显高于高浓度(20、40 μmol·L-1)处理组,FoxO3a 蛋白表达量则低于高浓度组,差异具有统计学意义(P<0.01)。实验结果显示,p-FoxO3a 蛋白表达明显呈剂量依赖降低,而FoxO3a的蛋白表达随Aβ25-35浓度的增加而增加(图3)。

图3 Aβ25-35对PC12细胞FoxO3a/p-FoxO3a蛋白表达的影响
2.3 不同浓度MSLDP对PC12细胞存活率的影响
将不同浓度MSLDP 处理后的PC12细胞存活率进行比较,未使用MSLDP 处理组的PC12 细胞存活率明显低于各MSLDP 处理组,差异有统计学意义(P<0.01)(图4)。
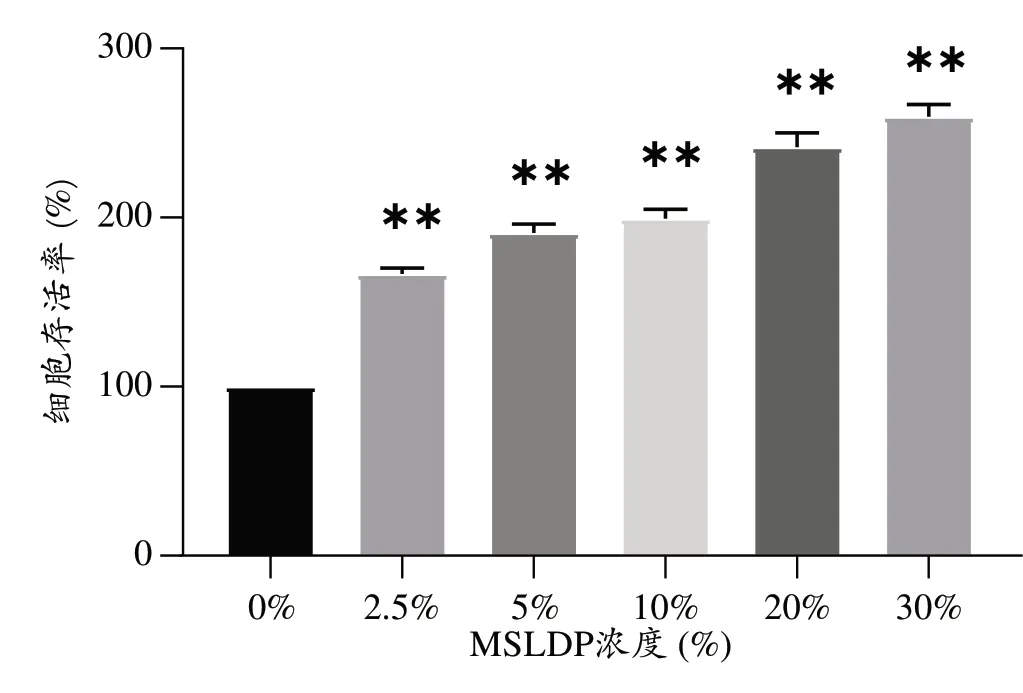
图4 MSLDP对PC12细胞活性的影响
倒置显微镜下观察各组细胞显示:未使用MSLDP处理组的PC12 细胞形态不规则,有细胞碎片出现;采用2.5%、5% MSLDP 培养PC12 细胞后,各孔内细胞量增多,细胞大小均一,形态规则;10%MSLDP组培养的细胞量进一步增加,聚集成片状生长,细胞形态有拉伸趋势;20%、30%MSLDP 组的PC12 细胞形态拉伸更加明显,并且细胞长出了小的棘突,明显形成分化趋势(图5)。实验结果表明,MSLDP 具有明显的促进PC12细胞增殖的作用

图5 MSLDP对PC12细胞形态的影响
2.4 不同浓度MSLDP 处理对PC12 细胞FoxO3a、p-FoxO3a蛋白表达影响
将采用不同浓度MSLDP 处理的PC12 细胞中FoxO3a、p-FoxO3a蛋白表达量进行比较,结果显示,低浓度MSLDP 处理组细胞内的p-FoxO3a 表达水平低于高浓度组,而FoxO3a 表达量则高于各高浓度MSLDP处理组,差异有统计学意义(P<0.01)(图6)。实验结果表明,FoxO3a、p-FoxO3a 蛋白表达量均对MSLDP 浓度呈剂量依赖性。

图6 不同浓度MSLDP对PC12细胞FoxO3a、p-FoxO3a蛋白表达的影响
2.5 MSLDP对AD模型细胞存活率的影响
参考文献资料,并综合考虑Aβ25-35和MSLDP 对PC12 细胞存活率以及二者对FoxO3a、p-FoxO3a 蛋白表 达 量 影 响,本 课 题 组 选 用20 μmol·L-1Aβ25-35和20%MSLDP 来建立试验用细胞模型。将各组采用不同方法处理的PC12 细胞进行MTT 法检测,结果表明,正常组、MSLDP 干预组的PC12细胞存活率高于AD 模型组,差异有统计学意义(P<0.05)(图7)。

图7 MSLDP预处理对PC12细胞活性的影响
倒置显微镜下观察各组细胞形态,Aβ25-35处理的模型组细胞与正常对照组相比,细胞数量减少,形态不规则,细胞膜相对不完整,细胞碎片增多。MSLDP处理组细胞与模型对照组相比,凋亡、死亡的细胞数减少,活细胞增多(图8),MSLDP 对AD 细胞模型的有明显的保护作。

图8 MSLDP预处理对PC12细胞形态的影响
2.6 MSLDP 对AD 细胞模型中FoxO3a、p-FoxO3a 蛋白表达影响
将三组采用不同方法处理的PC12 细胞中FoxO3a、p-FoxO3a 蛋白表达量进行免疫印迹检测,正常对照组细胞中p-FoxO3a 蛋白表达量高于模型组,FoxO3a蛋白表达量则低于模型组;MSLDP干预组细胞中的p-FoxO3a 蛋白表达量高于模型组细胞,而FoxO3a 蛋白表达水平低于模型组(图9)。结果表明,MSLDP 对Aβ25-35所造成的神经细胞损伤具有较好的保护作用。

图9 MSLDP对AD细胞模型的FoxO3a、p-FoxO3a蛋白表达的影响
3 讨论与结论
本课题组以Aβ25-35诱导神经细胞损伤着手,通过观察MSLDP 对细胞活力和形态及关键蛋白表达的影响,来探讨六味地黄丸对AD影响的分子机制。
3.1 六味地黄丸和Aβ25-35对神经细胞的影响
实验结果显示,不同浓度Aβ25-35处理后细胞的存活率呈剂量依赖的形式降低。这表明Aβ25-35对PC12细胞毒性损伤在一定浓度范围内与剂量呈正相关。同时观察处理后的细胞形态发现,随着Aβ25-35浓度增高,各孔内的细胞形态改变也随着Aβ25-35浓度增加而逐渐增多。这一结果与AD 患者脑内Aβ 的不断积累,毒性不断增加一致,同时,也与之前的研究结果相互验证:使用Aβ25-35诱导PC12 细胞后,会造成细胞活力下降,细胞内游离Ca2+浓度升高,形态上出现典型的凋亡特征,在一定范围内具有时间和剂量依赖性[21]。
3.2 FoxO3a与Aβ的相互关系
FoxO3a 是细胞稳态、应激反应和增殖/凋亡的核心调控因子,控制着复杂的基因表达网络。因此,它可以调节多种细胞过程,整合来自能量、生长因子和应激信号级联的输入,成为在神经系统疾病和抗衰老机制以及肿瘤等研究中较为新颖的研究热点。六味地黄丸的抗衰老作用主要与抗氧化和抗凋亡有关,Aβ积累所表现出来的毒性会造成神经细胞的氧化应激和凋亡,而体内FoxO3a的改变能够起下游基因产生抗氧化和抗凋亡的作用,本课题组结合三者的相关性,研究其发挥相互作用的具体方式。细胞内的FoxO3a蛋白经Aβ25-35的诱导后表达量升高,而p-FoxO3a 的蛋白表达量降低,这提示Aβ25-35可能通过对FoxO3a 的调节来激活细胞凋亡的级联反应。
3.3 MSLDP 对细胞内FoxO3a的影响
因为磷酸化是Forkhead 转录因子家族成员重要的上游修饰途径,FoxO3a 是PI3K/AKT 信号通路下游重要的转录因子[22,23],激活AKT 能够导致FoxO3a 磷酸化,磷酸化的FoxO3a 被降解而失去其转录活性。MSLDP能够进细胞增殖,同时还能影响细胞内FoxO3a与p-FoxO3a 的表达量,因此,其发挥作用的方式可能与AKT 激活所导致FoxO3a 磷酸化密切相关。实验结果显示,MSLDP 有明显的促进PC12 细胞增殖的作用,高浓度的MSLDP还能使细胞长出小突触,形成分化趋势。同时,MSLDP 预处理还能够明显降低Aβ25-35对细胞的毒性,减少细胞损伤。有研究发现过氧化物酶体增殖物激活受体γ 辅激活子1α(PGC-1α)能够通过下调FoxO3a 降低APP 代谢,减少Aβ 的积累,FoxO3a 对神经细胞自身APP代谢为Aβ有直接干预作用[24],这与本课题组的实验结果一致:MSLDP 干预后的PC12 细胞内p-FoxO3a 蛋白表达量升高,而FoxO3a 的蛋白表达量则降低。
综上所述,六味地黄丸对Aβ25-35所造成的神经细胞损伤具有保护作用,其作用机制可能是通过调节细胞内FoxO3a 与p-FoxO3a 的表达量,影响其下游基因的表达,进而调控细胞内的抗氧化、抗凋亡因子,促进细胞增值,从而实现其对AD 的预防及治疗。本实验为AD 的预防和治疗找出一个新思路,同时也为在临床上应用六味地黄丸改善AD 患者的病情和减缓AD病程发展提供了依据。
