补肾活血方对血管性痴呆大鼠海马神经细胞自噬的影响*
2022-04-26景佳星于文涛佘延芬
景佳星,骆 姗,杨 帆,于文涛,佘延芬
(1.河北中医学院研究生学院 石家庄 050091;2.河北中医学院针灸推拿学院 石家庄 050200;3.河北省心脑血管病中医药防治重点实验室 石家庄 050091;4.河北省中医针灸优势病症国际联合研究中心 石家庄 050091)
血管性痴呆(vascular dementia, VD)是指由一系列脑血管因素诱发的,在脑组织损害基础上产生的以认知功能障碍为主的临床综合征[1]。在我国,65 岁以上老年人轻度认知障碍总体患病率为20.8%,VD 患病率为1.5%,是仅次于阿尔兹海默症(Alzheimer's disease,AD)的常见痴呆类型[2]。由于脑血管疾病的分子机制仍不明晰,故可采取的治疗手段十分有限。甚至有研究显示,VD 与AD 的病理现象在临床患者中往往并存,这无疑也加重了治愈难度[3]。
VD 属中医学“文痴”“呆病”等疾病范畴,其主要表现为记忆力进行性减退。主要病因病机为肾虚、血瘀、痰阻,证候主要以肾精亏虚证、痰浊阻窍证、瘀血阻络证最为常见[4]。补肾活血方是依据全国名老中医、河北省十二大名中医杨牧祥教授“肾虚血瘀、痰瘀互结”学术思想创立的方药,本方在前期研究中已经证明对血管性痴呆患者有效[5],其机制与促进脑海马脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和酪氨酸激酶受体B(Tyrosine Kinase receptor B,TrkB)表达,并启动磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,AKT)信号通路有关[6]。这些检测指标与经典的自噬信号通路 PI3K/Akt/mTOR(mammalian target of rapamycin,哺乳动物雷帕霉素靶蛋白)高度重合[7],自噬是真核细胞中产生的一种细胞防御机制,在缺血引起的神经元死亡中具有调节作用。故我们推测自噬参与了VD 的发病和转归。本课题采用VD 动物模型[8],拟通过检测对比脑海马区自噬相关蛋白Beclin-1、LC3及P62蛋白及基因表达等指标变化,进一步探讨补肾活血方对自噬相关蛋白表达水平的影响,揭示补肾活血方调节VD 大鼠海马区神经元损伤的自噬机制。
1 材料
1.1 实验动物及分组
选取SPF 级52 周龄SD 雄性大鼠50 只,体质量660±40 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。按照随机数字表随机分为假手术组(Sham 组)、模型组(VD 组)、模型+补肾活血组(BSHX 组)、模型+自噬激活剂(雷帕霉素)组(Rap组)和模型+自噬抑制剂(3-甲基腺嘌呤)组(3-MA组),每组10 只大鼠。造模过程中及造模后各组大鼠均出现死亡情况,但数目不少于8 只。该实验方案经河北中医学院伦理委员会批准(批准号:DWLL2019008)。
1.2 主要药物及制备
补肾活血方组成:何首乌(产品批号:B2003001)15 g、益智仁(产品批号:B2003001)15 g、胡桃肉(产品批号:B1902001)15 g、人参(产品批号:B1912001)10 g、川芎(产品批号:B1906002)15 g、丹参(产品批号:B1909002)15 g、当归(产品批号:B2007001)15 g、郁金(产品批号:B1902002)10 g,所有中药配方颗粒均由石家庄以岭药业股份有限公司提供。按比例配制,以生成药量1.014 g·mL-1用蒸馏水充分溶解,收集在干净玻璃瓶中,4℃冰箱冷藏备用。雷帕霉素由上海源叶生物科技有限公司生产,产品批号:H03A10Y94335;规格:500 mg,用二甲基亚砜(DMSO)配至浓度8 ng·μL-1液体,-20℃冰箱冷冻备用。3-甲基腺嘌呤由上海源叶生物科技有限公司生产,产品批号:Y23O10C9933 5;规格:1g,用生理盐水配至浓度为10mmol·L-1液体,4℃冰箱冷藏备用。硫酸庆大霉素注射液由石药集团欧意药业有限公司生产,生产批准:068180304;规格:2ml:80mg(8万单位)。
1.3 主要试剂和耗材
电镜固定液(Servicebio,货号G1102);812 包埋剂(SPI,货号90529-77-4);RIPA 裂解液(碧云天生物技术有限公司,货号P0013E);发光试剂盒(Millipore,货号WBKLS0500);PVDF 膜(Pall Corporation 公司,货号T22740);山羊抗兔的二抗(北京中杉金桥,货号ZB2301);LC3 抗体(CST,货号#12741);P62 抗体(NSJ Bio,货 号F48010);Beclin1 抗 体(abcam,货 号ab210498);内参抗体GAPDH(abcam,货号ab9485);GoTaq qPCR Master Mix(Promega,货 号A6002);Eastep Super Total RNA ExtractionKit(Promega,货 号LS1040);DEPC(Sigma Aldrich,货号D5758);GoScript Reverse Transcription System(Promega,货号A5001);MicroAmp Optical 8-Cap Strip(Life technologies,货 号REF4323032);Primers(生工上海总部合成部,货号260064816);MicroAmp Fast Reactiion Tubes(Life technologies,货号REF4358293)。
1.4 主要仪器
51700 型全自动脑立体定位仪(美国Stoelting 公司);ZS-001 型Moriss 水迷宫(北京众实迪创科技公司);HM-200型电子天平(日本AND公司);DP73型数码显微镜(日本Olympus 公司);Leica UC7超薄切片机(Leica);Ultra 45°钻石切片刀(Daitome);HMIAS-2000型显微图像分析系统(武汉同济医科大学);HT7700型透射电子显微镜(hitachi);DYY-Ⅲ40B 型电泳槽,DYY-Ⅲ7B 型电泳仪(北京六一生物科技有限公司);2720 型基因扩增仪(美国Applied Biosystems 公司);756MC 型紫外可见分光光度计(上海精密科学仪器有限公司);CFX96 型实时荧光定量PCR 仪(BIO-RAD公司)。
2 方法
2.1 模型制备及给药
各组大鼠术前禁食12 h,禁水4 h。称重后,配置2%戊巴比妥钠(40 mg·kg-1)进行腹腔注射麻醉。5 min 左右察看大鼠行为,当呼吸变缓,无角膜反射时,准备造模。
依据文献建立VD 大鼠模型[8]。将麻醉好的大鼠采取仰卧位固定于手术台上。于颈部正中备皮后酒精消毒,纵向切开皮肤,钝性分离肌肉组织,暴露双侧颈总动脉和迷走神经,谨慎分离后用4 号手术线结扎颈总动脉并缝合伤口;假手术组仅分离迷走神经和颈总动脉,不结扎直接缝合;给予庆大霉素肌肉注射抗感染,放回笼中保温饲养。
Rap 组和3-MA 组于造模前30 min 通过侧脑室给药。大鼠麻醉后,将鼠头固定于立体定向仪上,切开头皮,分离皮下组织,蘸少量10%双氧水擦拭颅骨以充分暴露前囟门点(Bregma 点)的“十字交叉”骨性结构,旁开0.9 mm,向后1.5 mm,并标记。用微型牙科钻将颅骨缓缓钻透,有明显穿透感后拔出,到达硬脑膜表面即可。微量进样器抽吸药液沿钻孔缓慢进针,深3.8 mm,5 min 内分别匀速缓慢注入10 mmol·L-13-MA溶液6 μL/只或8 ng·μL-1雷帕霉素溶液4 μL/只,留针5 min后缓慢拔针,消毒后缝合伤口。
BSHX组于术后第3天按体质量进行给药干预,予以10.14g/kg 补肾活血方药灌胃治疗,1 日1 次,其余组大鼠每日给予相同体积的生理盐水灌胃。共持续28d。
2.2 大鼠Morris水迷宫检测
各组大鼠于术后4 周进行Morris 水迷宫实验,来测试其对空间定位的学习记忆能力。实验全程保持水温在22℃-25℃,加入墨水以便于准确记录白鼠的运动轨迹,实验时长共6天。第1至5天为定位航行实验。将大鼠面向池壁依次由各象限中点标记处放入水中寻找位于第三象限水平面以下2 cm 的平台。从入水开始到登上平台并停留5 s 的时间即为逃避潜伏期。未在规定时间内找到平台的大鼠记录为120 s。第6 天为空间探索实验。记录大鼠120 s 内跨越原平台位置的次数以测试大鼠空间记忆能力。
2.3 尼氏染色
各组取两只大鼠,麻醉后仰卧位固定进行心脏灌注,完成后断头取脑。将大脑固定于4%多聚甲醛溶液中。经石蜡包埋并行冠状切片后,依次浸入二甲苯、梯度乙醇以及蒸馏水中脱蜡水化。亚甲蓝染液(Methylene Blue Stain)浸染10 min,用尼氏分化液(Nissl Differentiation)分色直至镜下尼氏体清晰。将切片置入钼酸铵溶液(ammonium molybdate solution)中处理3-5 min 后,常规脱水、透明、封片。DP73 型数码显微镜下观察各组大鼠脑海马CA1 区病理形态,并记录镜下图片结果。
2.4 TEM观察海马神经元超微结构
各组大鼠麻醉后断头取脑,于冰台上剥离出海马,用手术刀切下1 mm3左右大小的组织块,2.5%的戊二醛溶液中固定2 h,磷酸缓冲液清洗3次,置于1%锇酸中固定2 h;再次用磷酸缓冲液清洗3 次后,置于梯度乙醇中脱水;丙酮置换3次后,丙酮和包埋剂1:1、1:2混合液依次浸渍渗透;812 包埋剂浸渍6h 后放入包埋板中于60℃条件下聚合;修块后于海马位置切片(厚度60 nm),醋酸铀和柠檬酸铅双重电子染色后,于TEM下观察并记录图片结果。
2.5 Western blot检测
各组大鼠麻醉后断头取脑,于冰台上分离海马组织,置于液氮中速冻,-80℃冷冻保存。将待测海马部分称重,加入RIPA裂解液后剪碎,充分研磨裂解。4℃离心机内离心10 min,取上清备用。用裂解液将蛋白调整至所需浓度。制备凝胶,固定好电泳槽和玻璃夹板。将相应体积的总蛋白样品与4×蛋白质上样缓冲液混匀,于95℃变性10 min。加入电泳液,在各凝胶孔上样。电泳仪设置成稳压状态,接通电源,电压设置为80V,90min,样品经过浓缩胶与分离胶时将电压改为120V。目的条带移动到分离胶约三分之二方位时,关闭仪器,取出玻璃板。此时凝胶上已得到分离出的蛋白条带,利用转移电泳的方法将条带转印至PVDF膜上,然后分别用按1:800 比例稀释后的特异性一抗及辣根过氧化物酶标记的二抗对其进行孵育。按1:1(v/v)混合发光试剂盒中Luminol Reagent 和Peroxide Solution 液。将PVDF 膜平放至覆有保鲜膜的暗盒中,加入混合液。根据条带的亮度适当选择曝光时间。用Quantity one 软件测定条带灰度值。计算目的蛋白和内参灰度值比值得出目的蛋白相对表达量。
2.6 RT-qPCR检测
各组大鼠麻醉后断头取脑,于冰台上分离海马组织,置于液氮中速冻,-80℃冷冻保存。称取大约50 mg 海马组织经液氮研磨后,转至1.5 mL 离心管内,根据总RNA 提取试剂盒说明依次加液离心,提取总RNA。每个样本取总RNA 2 μg,加入引物后混合于70℃5min预变性,冰上迅速冷却。再加入反转录反应液,于PCR 仪25℃5 min(退火),42℃60 min(延伸),70℃15 min(失活),冰上冷却得到cDNA。引物序列及扩增长度见表1。应用两步法反应程序:95℃10 min 预变性后,95℃15S 变性,60℃60s 退火,共进行44个循环反应。扩增结束后,得到各样本目的基因Beclin1、LC3、P62及内参基因GAPDH 的Cq值,目的基因Cq值-GAPDH 的Cq值=ΔCq,应用公式Q=2-ΔCq计算,可知各目的基因的Q 值及Q 均值,Q 值/Q 均值即为用于统计分析的目的基因表达的相对定量值(RQ值)。

表1 PCR引物序列及扩增长度
2.7 统计学方法
数据资料结果使用SPSS 25.0分析处理,数值变量以均数加减标准差(±s)表示。符合正态分布和方差齐性检验的多组数据比较采用单因素方差分析(oneway ANOVA),两组间的数据比较采用SNK(Student-Newman-Keuls)检验。所有假设检验方法均以P<0.05为差异有统计学意义。
3 结果
3.1 大鼠Morris水迷宫行为学变化的比较
定位航行实验结果:与Sham组比较,VD组大鼠逃避潜伏期延长,差异有统计学意义(P<0.05);与VD 组比较,BSHX 组大鼠逃避潜伏期明显缩短,差异有统计学意义(P<0.05)。空间探索实验结果:与Sham 组比较,VD 组大鼠穿越原平台次数显著减少(P<0.05);与VD 组比较,BSHX 组大鼠穿越原平台次数明显增多,差异具有统计学意义(P<0.05)(表2)。
表2 大鼠空间学习记忆能力的比较(±s)

表2 大鼠空间学习记忆能力的比较(±s)
注:与Sham组比较,*P<0.05;与VD组比较,△P<0.05。
组别Sham组VD组BSHX组Rap组3-MA组F p n 9 8 9 8 8———定位巡航实验逃避潜伏期19.62±4.71 56.51±27.93*27.98±13.40△63.73±20.61 44.02±23.60 7.802 0.000空间探索实验穿越平台次数9.67±2.78 2.50±2.14*8.22±4.09△1.63±1.60 5.75±2.25 13.62 0.000
3.2 大鼠脑海马病理形态观察的比较
镜下观察Sham 组大鼠海马CA1 区神经元形态、结构正常,细胞排列整齐,核仁清晰,尼氏小体数量多、体积大;VD 组和Rap 组大鼠海马CA1 区神经细胞损伤明显,排列稀疏紊乱,形状不规则,核仁固缩或缺失,尼氏小体鲜见或消失;BSHX 组和3-MA 组的细胞形态及数量较VD 组均有改善,3-MA 组细胞间隙增大,部分脱失,可观察到尼氏小体;BSHX 组细胞排列较为整齐,尼氏小体相较更多(图1)。

图1 各组大鼠海马CA1区病理形态学观察
3.3 大鼠脑海马神经元超微结构观察的比较
镜下观察Sham 组大鼠细胞形态正常,结构完整,未观察到自噬结构;VD 组和Rap 组大鼠细胞结构异常,核仁固缩变形,线粒体数量减少,内质网断裂,可观察自噬小体(图中箭头所示);BSHX组和3-MA组的细胞形态较VD 组有所改善,细胞器相对完整,染色质分布较为均匀,未发现自噬结构。整体细胞损伤程度由重到轻依次是:VD 组、Rap 组、3-MA 组、BSHX 组、Sham组(图2)。

图2 各组大鼠海马CA1区神经元损伤和自噬观察
3.4 大鼠脑海马自噬相关蛋白表达水平的比较
与Sham 组比较,VD 组Beclin-1 和LC3 的表达水平显著提升,P62的表达水平明显降低,差异有统计学意义(P<0.05);与VD组相比,BSHX组和3-MA组大鼠Beclin-1和LC3的表达水平明显下降,P62的表达水平显著上调,差异有统计学意义(P<0.05)(表3、图3-图4)。
表3 大鼠自噬相关蛋白表达水平的比较(±s)
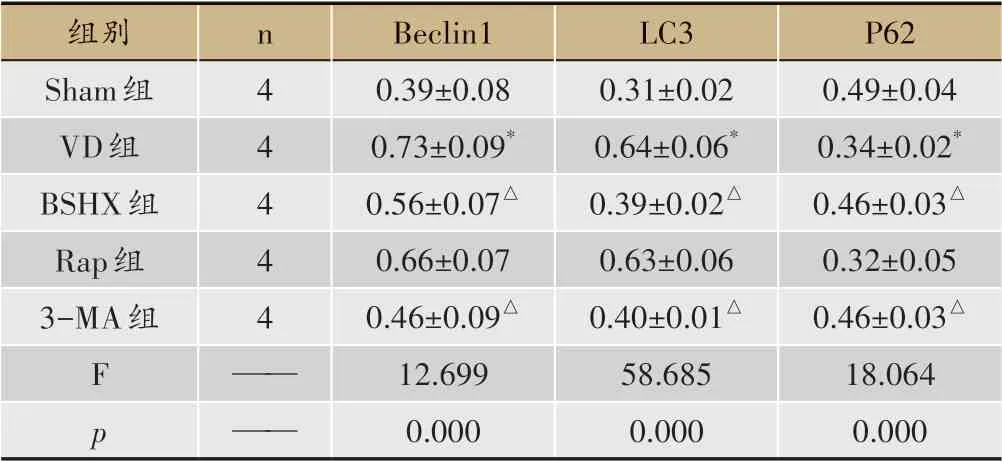
表3 大鼠自噬相关蛋白表达水平的比较(±s)
注:与Sham组比较,*P<0.05;与VD组比较,△P<0.05。
组别Sham组VD组BSHX组Rap组3-MA组F p n 4 4 4 4 4———Beclin1 0.39±0.08 0.73±0.09*0.56±0.07△0.66±0.07 0.46±0.09△12.699 0.000 LC3 0.31±0.02 0.64±0.06*0.39±0.02△0.63±0.06 0.40±0.01△58.685 0.000 P62 0.49±0.04 0.34±0.02*0.46±0.03△0.32±0.05 0.46±0.03△18.064 0.000

图3 大鼠海马自噬相关蛋白表达电泳

图4 大鼠自噬相关蛋白表达水平的比较
3.5 大鼠脑海马自噬相关蛋白mRNA 表达水平的比较
与Sham 组比较,VD 组大鼠海马组织内Beclin-1和LC3 的mRNA 表达水平显著提高,P62 的mRNA 表达水平显著降低,差异有统计学意义(P<0.05);与VD组相比,BSHX 组和3-MA 组大鼠Beclin-1 和LC3 的mRNA 表达水平明显下调,P62 的mRNA 表达水平明显上升,差异有统计学意义(P<0.05)(表4、图5)。

图5 大鼠自噬相关蛋白mRNA表达水平的比较
表4 大鼠自噬相关蛋白mRNA表达水平的比较(±s)

表4 大鼠自噬相关蛋白mRNA表达水平的比较(±s)
注:与Sham组比较,*P<0.05;与VD组比较,△P<0.05。
组别Sham组VD组BSHX组Rap组3-MA组F p n 8 8 8 8 8———Beclin1 0.76±0.22 1.33±0.32*0.94±0.15△1.09±0.07 0.88±0.14△8.22 0.001 LC3/B 0.70±0.18 1.15±0.18*0.95±0.16△1.22±0.25 0.98±0.07 7.497 0.001 P62 1.18±0.28 0.77±0.26*1.07±0.15△0.93±0.16 1.04±0.20△4.093 0.008
4 讨论
VD 被定义为在脑组织损害基础上产生的以高级神经认知功能障碍为主的临床综合征,是目前唯一具有可逆性的痴呆类型[9],VD 属于中医学“文痴”“呆病”“健忘”等疾病范畴,中医学认为,VD 的发病与肾精亏虚、瘀血阻络密切相关,清代《医学心悟》中云:“肾主智,肾虚则智不足。”《血证论》中曰:“凡心有瘀血亦令健忘。”本实验所用方剂补肾活血方,方中以人参补虚安神、大补元气,益智仁、胡桃仁温肾固精,制首乌益肾养血,川芎、郁金行气开郁、活血破瘀,加以当归、丹参活血祛瘀、补血安神。全方补而不滞、滋而不腻,寓补于散、标本兼治,在临床和前期实验中均被证实有较好疗效。
自噬是是一种涉及蛋白质和细胞器降解的细胞途径,当机体处于病理条件下,调节自噬水平能够使自身更好地耐受饥饿、缺氧、缺血等应激状态[10]。通过对大鼠行为学和脑病理形态的观察,可以确定VD 组大鼠在脑缺血发生后,学习记忆能力明显下降,神经细胞受损的同时出现了不同程度的自噬;Rap 组进一步激活自噬亦不能减轻神经元的损伤情况和大鼠的痴呆程度;BSHX 组大鼠通过中药治疗学习记忆能力明显好转,神经元得到了修复和再生;3-MA 组通过抑制自噬同样取得了相近效果。
Beclin-1 作为细胞自噬的关键因子,参与了自噬体分隔膜的生成过程。Ⅲ型PI3K 复合体联合unc-51样激酶1 复合体,共同介导跨膜蛋白Atg9 的磷酸化和聚积,推动胞质中Atg 蛋白和脂质汇集组成分隔膜[11]。同一时间,Beclin-1 作为酵母自噬基因Atg6 的同源相关蛋白,与PI3K 结合参与生成自噬体膜,并吸引其他Atg 蛋白和脂质分子在自噬体膜上标记位置,其在自噬启动过程中起正调控作用[12]。LC3 参与了自噬体膜的延长,这一环节含有两种泛素样结合作用,Atg12 与Atg5 的泛素样结合以及微管相关蛋白1 轻链3-Ⅰ(LC3-Ⅰ)与磷脂酰乙醇胺的泛素样结合[13]。当细胞内出现自噬信号时,在Atg7 和Atg3 的催化下,水溶性LC3-Ⅰ能够共价结合磷脂酰乙醇胺转化为脂溶性的LC3-Ⅱ。LC3-Ⅱ结合自噬体膜,定位在内外膜上,在自噬体膜的延长以及与其他膜结构的融合过程中扮演重要角色,故常用LC3-Ⅱ/LC3-Ⅰ比值来提示自噬活性,其蛋白水平与自噬体数量成正比[14]。泛素结合蛋白P62 是一种应激诱导蛋白,调控着多条重要信号通路,它参与细胞选择性自噬,是检测自噬的重要指标之一[15]。P62 可以通过N 端的PB1 结构域与LC3-Ⅱ形成复合体,介入自噬小体的生成后,与其他蛋白聚集物共同在溶酶体中被降解[16]。故自噬的激活会减少细胞内P62 的数量,即其蛋白表达和自噬趋势呈负相关[17]。
目前的科学研究往往通过人为干预来观察自噬变化,方法包括药物处理、自噬基因敲除、沉默或过表达。Rap 作为自噬激活剂,其作用机制是通过降低mTOR活性从而促进自噬发生;3-MA作为自噬抑制剂则是抑制Class ⅢPI3K 从而减少自噬体的形成,两种药物都是目前公认并广泛使用的自噬干预剂[18]。本研究表明,VD 组大鼠在脑缺血发生后,学习记忆能力明显下降,神经细胞受损,细胞内观察到不同程度的自噬小体,Beclin-1、LC3 的蛋白和mRNA 表达水平显著提升,P62 表达下降,这说明VD 发病过程中伴随着自噬的发生,Rap 组激活自噬未能减轻神经元的损伤情况和大鼠的痴呆程度,甚至加重了VD 大鼠的症状;BSHX 组大鼠通过中药治疗学习记忆能力明显好转,神经元得到了修复和再生,Beclin-1、LC3 的蛋白和mRNA 表达水平下降,P62 表达上升;3-MA 组通过抑制自噬同样取得了相近效果,这表示中药灌胃治疗下调了自噬水平,与3-MA 作用趋近,说明补肾活血方通过抑制自噬治疗血管性痴呆,其机制与降低海马区Beclin-1 和LC3 蛋白及mRNA 的表达、提高P62 的表达密切相关。
综上所述,本试验结果表明,VD 的发病过程伴随着自噬的发生,补肾活血方可以降低VD 大鼠海马区Beclin-1 和LC3 蛋白及mRNA 的表达,提高P62 的表达,通过抑制自噬的发生,减轻对神经细胞的损伤,改善学习记忆能力。
