藏药二十五味珊瑚丸对阿尔茨海默症小鼠肠道菌群的调节*
2022-04-26角加才仁仲格嘉李宏红胡贤达韩亚南陈茜茜吴金鹏阴慧娟
角加才仁,仲格嘉,李宏红,胡贤达,韩亚南,陈茜茜,吴金鹏**,阴慧娟
(1.中国藏学研究中心北京藏医院 北京 100029;2.中国医学科学院生物医学工程研究所激光医学实验室 天津 300192)
1 引言
阿尔茨海默病(Alzheimer’s Disease,AD),俗称老年痴呆(占所有痴呆患者的60%-80%),是一种典型的中枢神经退行性病变,患者主要表现为认知功能障碍、记忆力逐渐衰退、行为异常及社交障碍等,直至痴呆[1]。《2018年全球阿尔茨海默病报告》指出AD 是人类的问题,也是一个全球性的问题。全球每3 秒钟就将有1 例痴呆患者产生。AD 病理特征是患者大脑中出现β-淀粉样蛋白(Amyloid-β, Aβ)聚集形成的老年斑、tau 蛋白过度磷酸化形成的神经元纤维缠结、神经元及突触的功能失调以及大脑中的长期慢性炎症,最终发生退行性病变等。目前除传统的神经递质类药物如美金刚等有限改善一些表面症状外,其他药物开发无一成功,AD的治疗陷入困境。
近年来的研究表明,肠道菌群通过多种途径参与AD 的发生和发展,被认为是AD 治疗的新靶点[2]。肠道菌群主要通过神经、内分泌、代谢和免疫等途径影响AD 的发生[2-3]。老年患者肠壁变薄,肠道菌群多样性发生变化,有益菌群和有害菌群比例失调,产生诸如细菌Aβ、脂多糖、乙酰胆碱、5-羟色胺、短链脂肪酸等物质,不仅激活免疫细胞,加重神经炎症,还使肠道屏障和血脑屏障功能进一步受损[4]。研究表明肠道菌群调节(益生元、益生菌、粪菌移植等方法)对阿尔兹海默症认知能力和Aβ 淀粉样沉积有改善作用[5-7]。Wang 等发现粪菌移植可使3 月龄APPSWE/PS1ΔE9小鼠Aβ 斑块周围由小胶质细胞引起的炎症活动增强,而小胶质细胞是Aβ斑块清除的主要细胞[8]。伊朗的1项随机双盲对照实验表明AD患者服用12周益生菌和硒补充剂能有效提高患者认知能力和包括抗氧化能力等在内的代谢水平[9]。
二十五味珊瑚丸(ershiwuwei coral pill,CP25)有活血化瘀、消炎止痛、安神镇静等疗效,在藏药中被用于治疗“白脉病”,也就是中枢神经系统疾病[10],如头痛、癫痫、中风等[11-13]。CP25 含有25 种植物药材和矿物质成分,Ying等的论文中给出了CP25的配方[14]。研究发现25 种成分中,诃子(Terminalia chebula Retz)提取物具有抗氧化作用[15];红花(Carthamus tinctorius)提取物具有改善血液循环和抗血栓形成作用,同时还具有镇痛镇静作用[16];甘草(glycyrrhiza)代谢物具有抗炎、抗菌和降血脂作用,对神经[10]细胞凋亡有保护作用[17];獐牙菜(Swertia bimaculata(sieb.Et zucc.)hook.f.et thoms)能显著抑制中枢神经系统,还具有保护胃肠道、抗炎和抗菌等作用[18];沉香具有明显的降血压作用[19];藏菖蒲(Acorus calamus L.)对中枢神经有双向调节作用,既有兴奋也有抑制作用[20];红珊瑚、珍珠等矿物质含有磷酸钙,对治疗脑缺血有明显作用[21];其他矿物质含有人体必需的常量元素和微量元素,对神经保护、神经活动的调节和抗炎镇痛都有积极的作用[22-23]。
为了探索CP25 在治疗阿尔兹海默症上的可能性,本团队在前期不但对二十五味珊瑚丸的毒理学及主要指标成分的含量进行了详细的分析[24],而且对其中的神经保护作用物质进行了分析[25],同时采用网络药理学方法,对前期鉴别出的35种入血成分进行了潜在靶点预测,结果显示CP25 可通过多组分和多靶点的协同作用,共同干预阿尔兹海默症的进程[26]。虽然这些研究都表明CP25 可能是一种潜在的治疗阿尔兹海默症的良药,但还缺乏直接的实验证据。通过上述研究发现,肠道菌群紊乱通过神经、内分泌、代谢和免疫影响AD 的进展,而CP 25 具有明确的抗氧化、抗炎和神经保护作用[14-23],因此口服CP25 有可能通过改善肠道菌群紊乱造成的炎症、神经损伤和免疫异常而促进AD的恢复。为了探索该问题,本研究通过APP/PS1双转基因AD 小鼠和Aß1-42诱导的AD 小鼠两种动物模型,观察口服CP25 对AD 小鼠肠道菌群的调节,及对阿尔兹海默症的治疗作用,为民族医药对AD 的治疗提供实验证据。
本研究是北京藏医院承担的国家财政部专项拨款的十三五项目-心脑血管临床和民族医技医法传承及新药研究的重要组成部分,AD 作为心脑血管疾病的一种老年慢性疾病,已经严重影响国民的健康,在目前无有效治疗药物的困境下,二十五味珊瑚丸作为藏医治疗白脉病的一线药物,而上述分析提示二十五味珊瑚丸可能具有干预AD 的潜能。为此,本研究采用两种经典的AD 模型小鼠探索二十五味珊瑚丸是否具有干预AD 的作用,同时研究肠道菌群在这个过程中可能的作用机制。以期通过该研究,为推进CP25用于干预AD的临床进程提供数据支撑。。
2 材料与方法
2.1 材料
二十五味珊瑚丸(CP25)(金诃藏药股份有限公司生产,每丸重0.25 g,每盒两版,共24 丸,批准文号:国药准字Z63020059,生产批号:01180510),Amyloid Beta-Peptide (1-42) (human) 蛋 白(Sigma,0.1mg,A9810),Rabbit-anti-beta Amyloid1-42(英国Abcam 公司,批号ab224025),羊抗兔IgG-TRITC(美国Jackson Immuno Research 公司,批号111-025-003),Morris 水迷宫(北京众实迪创科技发展有限公司,ZS-001 moriss)。
2.2 方法
2.2.1 AD动物模型
APP/PS1双转基因AD 小鼠(Mt):60只雄性6月龄的APP/PS1 双转基因AD 小鼠购自北京华阜康生物科技股份有限公司(生产许可证:SCXK(京)2014-0004,实验动物质量合格证号:11401300093230)。双转基因APP/PS1 小鼠AD 小鼠可表达突变的人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体,双转基因APP/PS1小鼠这两个基因的表达都由小鼠朊病毒蛋白启动子启动。人类早老素基因的DeltaE9 突变是该基因的第九个外显子缺失产生的,此突变会导致早发性老年痴呆症。试验动物随机分为4 组,每组15只。
Aß1-42诱导AD 小鼠(Mi):85 只雄性12 周龄的C57BL/6N 野生型正常小鼠购自北京维通利华实验动物技术有限公司(生产许可证:SCXK(京)2016-0006,实验动物质量合格证号:1100111911000703)。C57BL/6N 小鼠 由C.C.Little 对Miss Abby Lathrop 品 系交配繁育而成,维通利华从Charles River 引入第83 代核心群,对该品系进行Cloneback,毛发为黑色(MHC单体型H2b,品系代码213)。其中70只用于Aß1-42诱导AD小鼠造模。方法:1 mg Aß1-42蛋白先用20 μL DMSO充分溶解后,用PBS 稀释10 倍,浓度为5 g·L-1,置于37℃细胞培养箱孵育4天,使其变为凝聚态,用于诱导AD 小鼠模型。小鼠麻醉后,固定于脑立体定向仪,暴露Bregrna(前囟)点,以双侧海马CA1 区为给药点,在前囟后2.3 mm,矢状缝两侧旁开1.8 mm 处,注射1 μL Aß1-42溶液(浓度5 g·L-1)。进针深度2.0 mm,速度1 mm·min-1,注射速度为0.2 μL·min-1,留针5 min。术后第8 天进行行为学检测,造模成功的Aß1-42诱导AD 小鼠随机分为4组,每组平均15只。另有15只C57BL/6J野生型正常小鼠作为空白对照组(Ctrl-B)。
所有动物实验在中国医学科学院放射医学研究所实验动物中心P2级动物饲养室进行,饲料和饮水均为清洁级。实验方法和操作符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理的相关规定,并经中国医学科学院放射医学研究所实验动物伦理委员会审核通过(伦理审批编号:IRM-DWLL-2019127)。
2.2.2 CP25给药
CP25 在热水中浸泡过夜,充分搅拌至混悬均匀,配置成浓度为20 g·L-1的母液备用。两种AD 模型小鼠(Mt 和Mi)都分为4 组,模型对照组和3 组不同剂量的CP25 给药组。CP25 给药剂量分别为每天100 mg·kg-1体重(分别为tCP25-100 和iCP25-100 组)、200 mg· kg-1体重(分别为tCP25-200 和iCP25-200 组)、400 mg· kg-1体重(分别为tCP25-400 和iCP25-400组),灌胃给药,每天1 次,每周给药5 天,间歇2 天,连续8周。对照组给予同样体积的生理盐水灌胃。
2.2.3 模型验证与行为学检测
CP25 给药前将Mt 和Mi 模型小鼠与正常小鼠各随机抽取6 只进行模型验证,采用Morris 水迷宫分别进行定位航行和空间探索实验检测AD 小鼠的学习能力和记忆能力等行为学表现。在定位航行前对AD 小鼠进行3 天的训练,帮助小鼠找到平台并在平台停留120 s 以上。定位航行:在水迷宫4 个象限中的其中一个放入平台,将小鼠从对面象限放入水中,采用数字追踪系统记录小鼠爬上平台前的潜伏期、游泳速度和游泳轨迹,软件分析搜索策略并计算评分。每天2次,连续记录6天。空间探索:将平台从水迷宫中拿走,小鼠从任意象限放入水中,记录2 min 内小鼠穿越平台象限的次数、在平台象限游泳的时间以及游泳轨迹。进行模型验证的小鼠不再纳入实验,避免因训练造成对后续效果测试的影响。以与对照组相比潜伏期有明显差异(P<0.05)为模型成功的判断标准。CP25 给药8 周结束后采用同样的方法进行AD 小鼠的学习能力和记忆能力等行为学检测。
2.2.4 病理检测
水迷宫检测结束后,小鼠在深度麻醉(按0.5 mL/100 g 剂量腹腔注射5%水合氯酸溶液)下,心腔灌注冷生理盐水20 mL,10 min 内取全脑和粪便组织等样品。脑组织用于冷冻切片制备,快速取全脑,梯度蔗糖脱水,OCT 包埋,快速冷冻,沿冠状面切片(厚度5 μm)备用。后者小心剥离海马组织,-80℃保存备用。采用制备的冷冻切片进行Aß1-42、免疫荧光染色以观察AD 小鼠在给药后淀粉样斑块的改善。Rabbit-antibeta Amyloid 1-42 稀释比例为1:100,二抗羊抗兔IgGTRITC 稀释比例为1:100,Ex/Em=550/570 nm。采用全自动扫片系统(C13210-01,日本滨松光子学株式会社)获取免疫荧光图像,采用ImageJ 软件对Aß 斑块数量进行计数。
2.2.5 肠道菌群检测
粪便组织取自结肠,小心分离结肠全段,一端切口,从另一端开始向下挤出粪便样品,-80℃保存备用。采用16S RNA 测序法进行AD 小鼠肠道菌群多样性检测。冷冻保存的新鲜粪便采用DNA 提取试剂盒提取基因组DNA,每组5 个粪便样品。琼脂糖凝胶电泳检测DNA 的纯度和浓度。取适量的样品到离心管中,在无菌水中稀释至1 ng·μL-1,以稀释后的基因组DNA 为模板,以16S V3-V4 区为测序区域,使用带Barcode 的特异引物,引物343F(5’- tacggraggcagcg -3’) 和798R(5’- AGGGTATCTAATCCT-3’),采 用Takara Ex Taq 高保真酶进行PCR(Bio-rad,CA,USA)。PCR 产物经电泳检测,磁珠纯化,并以此为模板进行二轮PCR 扩增。再次检测纯化,Qubit 定量。最后,根据PCR 产物浓度进行等量混样,并在Illumina-MiSeq(Cal.,USA)机上测序。使用Trimmomatic 软件对原始双端序列(FASTQ格式)进行去杂。当质量低于20时,截获前面高质序列。生成优质序列后,使用Vsearch软件根据序列的相似性将序列归为为多个OTUs。序列相似度大于或等于97%被归为1 个OTU 单元。使用QIIME 软件包挑选出每个OTU 的代表性序列,将所有的代表性序列与Silva(version132)数据库进行比对注释,保留置信区间大于0.7的注释结果。
2.2.6 统计分析
所有计量均用xˉ±S表示,两组间比较采用双尾t检验,两组以上比较采用单因素方差分析。P<0.05 表示显著统计学差异。Originlab2018被用于进行数据分析和图表制作。
3 结果
3.1 行为学改善与Aß斑块
我们采用水迷宫法检测了两种AD 小鼠(APP/PS1双转基因AD 小鼠Mt 和Aß1-40 诱导的AD 小鼠Mi)在CP25 给药后的行为学改变。定位航行实验检测小鼠的学习能力,如图1A 所示,在连续6 天的定位航行实验中,两种不同AD 模型小鼠—Ctrl-Mt 和Ctrl-Mi 的潜伏期(找到平台所用时间)均较高于对照组Ctrl-B(P<0.05),说明AD 小鼠的学习能力显著低于正常小鼠。给予8 周的CP25 治疗后,Mt 和Mi 小鼠的学习能力均得到明显的提升。以第6天为例,Mt小鼠CP25给药组中低剂量组(tCP25-100 and-200)的潜伏期恢复到正常小鼠水平(P<0.05),高剂量组效果不明显(P>0.05)。而Mi 小鼠中,3 个剂量组均显著改善,组间无显著差异(P>0.05)。同时我们还采用空间探索实验检测小鼠的记忆能力,Mi模型给药组中行迹路线图有明显的平台趋向性,如图1B、表1所示,统计结果也表明CP25给药可明显改善Mi 小鼠的记忆能力,但对Mt 小鼠无显著影响。

图1 CP25给药对两种AD小鼠行为学和病理学的改变
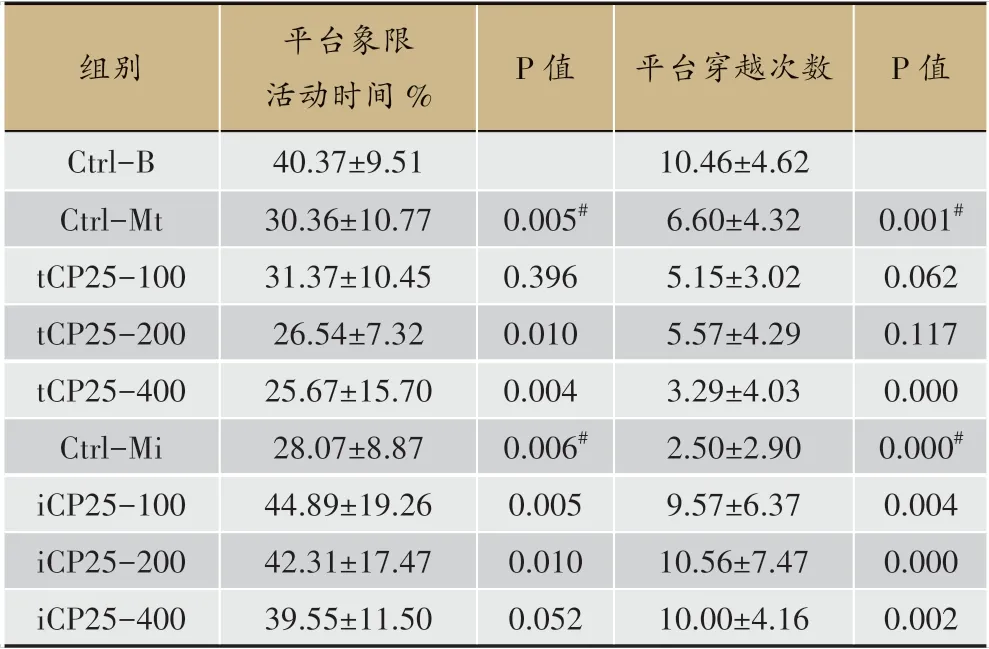
表1 两种模型小鼠空间探索能力(n=15)
Aβ 斑块是AD 重要的病理表现之一。如图1C 所示,对于基因型小鼠,与对照组相比,tCP25-200 组小鼠大脑皮质和海马区的Aβ 斑块无显著差异(P>0.05),说明CP25 给药不能消除或减轻APP/PS1 双转基因AD 小鼠即Mt 小鼠的Aβ 蛋白沉积。而对于诱导型AD 模型(Ctrl Mi),Aβ 斑块密集分布于诱导给药针头位置,如图1C 左下图所示;CP25 给药组(iCP25-200)未发现Aβ 斑块,分析可能CP25 治疗起作用,也可能是脑片未切到合适位置。
3.2 肠道菌群
本实验通过检测CP25 口服给药对肠道菌群多样性的影响,尝试解释CP25 改善AD 小鼠行为学和病理学的效应机制。为避免环境和饮食因素对肠道菌群的影响,所有实验动物均在同一饲养室进行相同食水饲养。结果如图2 所示,CP25 给药对肠道菌群门类别上的丰度有明显的影响。与正常小鼠相比(Ctrl B,图2A),两种AD模型小鼠肠道菌群在门类别上的丰度变化明显不同(图2C-J)。基因模型(Ctrl Mt,图2C 第一个饼图)小鼠厚壁菌门丰度下降,而拟杆菌门丰度上升;诱导模型(Ctrl Mi,图2G)正好相反,且变化幅度显著。CP25给药可纠正两种AD模型肠道菌群在门类别丰度上的异常。对于基因模型(Ctrl Mt)小鼠,中高浓度给药逆转厚壁菌门和拟杆菌门的相对比例效果更加明显(图2 E-F));对于诱导模型(Ctrl Mi),3 种浓度CP25 给药都显著逆转了异常的厚壁菌门和拟杆菌门比例(图2 H-J)。这些结果表明CP25 给药对肠道菌群有显著影响。一般认为厚壁菌门多为有益菌,拟杆菌门多为有害菌。CP25 给药能够显著提高基因型小鼠厚壁菌门和拟杆菌门比例,促进有益菌增加,提示可能CP25可纠正肠道菌群的紊乱。

图2 CP25给药对肠道菌群在门类别上丰度的影响
采用Kruskal-Wallis 检验分析组间Alpha 多样性指数差异是否显著。以Observe、Chao1、Shannon 和Simpson's 指数为例,组间差异分析的箱形图如图3A所示。对于基因模型小鼠,Observe、Chao1 指数显示,其与对照组有明显的差异,说明基因模型小鼠肠道菌群有明显紊乱。CP25 给药后,3 个浓度间,CP25-100与CP25-400 间差异最为显著。而诱导模型小鼠与正常小鼠肠道菌群无明显的改变,表明急性诱导AD 模型小鼠的肠道菌群没有受到显著影响,AD 患者的肠道菌群紊乱是一个长期的过程。然而,CP25-100给药对这种模型小鼠的正常肠道菌群仍然有显著的影响。

图3 CP25给药对于组间肠道菌群多样性分析
为了进行多样本间的比较,本研究进行了PCoA分析,即主坐标分析,并基于Bray-Curtis 距离矩阵进行PCoA 作图,如图3B 所示。基因模型小鼠与正常小鼠分为两个明显的分离的群,CP25-200 和CP25-400的群与正常小鼠重合,CP25-100位于基因模型小鼠与正常小鼠的群之间。表明CP25 给药,特别是中高剂量给药,能显著地纠正基因模型小鼠的肠道菌群紊乱。而诱导模型小鼠和正常小鼠的群部分重叠,表明诱导模型小鼠的肠道菌群没有受到明显的影响,CP25给药的3个剂量组的群与诱导模型小鼠和正常小鼠的群重叠,表明CP25给药对正常菌群没有负向影响。
使用R 软件DESeq2 程序包,基于wald 检验方法,进行差异菌群筛选,并以属类别P<005的前10个细菌属别进行作图,如图4 所示。对于基因模型小鼠,CP25 给药不同剂量分别对脱硫弧菌属Desulfovibrio(上调)、乳杆菌属Lactobacillus(下调)、普雷沃氏菌科PrevotellaceaeGa6A1_group(上调)、瘤胃梭菌属Ruminiclostridium_9(下调)和不可培养拟杆菌属uncultured_Bacteroidales_bacterium(下调)有纠正性调节,其中CP25-200 调节作用作为最为显著,CP25-400次之,CP25-100 作用最弱。而对于诱导模型小鼠,CP25 给药下调Acetatifactor和肠杆菌属Enterorhabdus,上调醋香肠菌属Acetitom aculum、梭菌ASF356、毛螺菌属Lachnospiraceae_NK4A136_group、脱铁杆菌属Mucispirillum、毛螺旋菌属Parasutterella、普雷沃菌属Prevotella_1、普雷沃菌属Prevotella_9、普雷沃氏菌科PrevotellaceaeGa6A1_group 等。 其 中 肠 杆 菌 属Enterorhabdus为纠正性调节。在两种模型鼠中,CP25给药均对脱铁杆菌属Mucispirillum有上调作用。

图4 两种不同AD模型中以属为类别的前10差异菌群
4 讨论
为了探索藏药CP25 对阿尔兹海默症患者肠道菌群的影响,本实验采用了两种AD 小鼠模型,APP/PS1双转基因小鼠(Mt)和Aß1-40 诱导的AD 小鼠(Mi)。Aβ1-40 诱导的AD 小鼠(Mi)是由海马CA1 区直接注射Aβ1-40蛋白,短期内形成的AD 模型。这种模型是由单一因素-beta 淀粉样斑块造成的,且成模时间短,不足以对肠道菌群形成逆向影响。APP/PS1双转基因小鼠(Mt)可表达突变的人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体[27],6-7 月龄即可在小鼠脑内形成Aβ 淀粉样斑块,如我们在实验中检测到的一样(图1),Aβ 淀粉样斑块在小鼠海马和皮层无规则散在分布。同时由于成模时间长,Mt小鼠的肠道菌群多样性与正常小鼠呈现明显的不同。本实验采用诱导性和基因型AD 小鼠模型来观察CP25 给药对肠道菌群的影响,对比分析肠道菌群在CP25 治疗AD 过程中的影响,从两个角度来验证CP25 对肠道菌群的改变与AD改善之间的关系。
通过对两种模型小鼠进行长达8 周的CP25 口服给药,我们发现CP25 能有效改善Mt 和Mi 小鼠的学习能力,但对Aß斑块无明显的清除作用,提示Aß蛋白的清除不是CP25的直接靶点。目前临床上尚无针对Aß蛋白的药物面市,但是处于研发阶段的作用于Aß 蛋白的药物很多,主要分为三类:抑制Aβ 蛋白合成(如verubecestat[28]、lanabecestat[29]和E-2609[30]等)、抑制Aß蛋 白 聚 集( 如 PBT2[31])、抗 Aβ 抗 体( 如Bapineuzumab[32])。其中抑制Aß 蛋白聚集主要应用金白的聚集[33]。CP25 含有多种矿物质,我们预期CP25可能会通过金属螯合剂清除Aß 蛋白,然而结果显示并不能有效清除Aβ 淀粉斑块,分析其原因可能是CP25 中的矿物质不能有效通过血脑屏障达到病变部位属合剂干扰Aβ 与金属离子的相互作用,从而减少毒性Aβ 蛋白的聚集[33]。CP25 含有多种矿物质,我们CP25可能会通过金属螯合剂清除Aβ蛋白,然而Aβ淀粉斑块,分析其原因CP25 中的矿物质不能有效通过血脑屏障达到病变部位。
我们在前期实验中已经对分析出的CP2535 个入血成分采用网络药理学分析法进行预测,发现了针对AD可能有78个潜在靶点,对应的生物学功能主要有3类,包括Aβ 淀粉样斑块的清除、炎症与免疫、凋亡与自噬[26]。通过Mt和Mi模型小鼠行为学和病理学结果,我们推测CP25 的入血成分很少能通过血脑屏障进入脑区,肠脑轴可能是其作用路径。
CP25为口服给药,胃肠道是其药物吸收的第一道屏障。肠道菌群通过多种途径参与AD 的发生和发展,被认为是AD 治疗的新靶点[34]。CP25 具有活血化瘀、消炎止痛的作用,对于炎症有正向调节作用,AD患者肠道菌群失调也和炎症密切相关。在长期CP25给药过程中,肠道菌群是否受到有益调节是值得关注的问题。研究表明,AD 患者的肠道菌群多样性明显下降,厚壁菌门和双歧杆菌属丰度降低,拟杆菌门丰度升高[35]。Cattaneo 等则发现,肠道促炎性大肠埃希菌/志贺氏菌丰度增加,抗炎分类菌群丰度明显减少[36]。值得注意的是,幽门螺杆菌可通过诱导产生抗炎症因子IL-10加重AD 的病理过程[37]。1项针对美国成人的回顾性队列研究也证实男性幽门螺杆菌血清阳性与AD 死亡率呈正相关[38]。有效的药物治疗应纠正肠道菌群的这种异常。我们的研究发现CP25 给药对这些菌群有纠正性调节,Mt模型小鼠中脱乳杆菌属和不可培养拟杆菌属等拟杆菌门明显下降。而在诱导模型中,由于AD 小鼠和正常小鼠的肠道菌群无明显组间差异,CP25给药造成的肠道菌群上调或下调则主要由药物成分决定。比如CP25 可明显上调梭菌ASF356、毛 螺 菌 属Lachnospiraceae_NK4A136_group、脱铁杆菌属Mucispirillum、毛螺旋菌属Parasutterella、普雷沃菌属Prevotella_1、普雷沃菌属Prevotella_9、普雷沃氏菌科PrevotellaceaeGa6A1_group 等菌群,我们认为CP25 药物成分中有类似益生元的组分。值得一提的是,在两种模型中,CP25 均显著上调Mucispirillum,但该菌属在AD 模型属中的丰度并无明显差异。CP25 对Mucispirillum的调节作用是否有利于AD 改善尚需要进一步研究。有研究表明Mucispirillum schaedleri帮助宿主抵御鼠伤寒沙门氏菌(S.Tm)引 发 的 肠 道 炎 症[39]。 同 时 本 文 发 现uncultured_Bacterodales_bacterium在AD 小鼠中的丰度明 显 高 于 正 常 小 鼠 ,ruminococcus-1 和Ruminiclostridium-9 的丰度低于正常小鼠,这些结果与Zhang等对AD小鼠肠道菌群的研究一致[40],CP25治疗可纠正这种由AD 疾病导致的肠道菌群的异常升高。这些结果提示肠道菌群Muribaculum的调节是CP25治疗AD的途径之一。目前的研究认为肠道菌群通过脑肠轴、分内泌、代谢和免疫等多种途径影响AD的发生和发展[34]。CP25 对AD 小鼠肠道菌群的调节可能通过复杂的机制网络来改善AD 的认知功能和病理表现,比如抑菌、消炎、提高免疫等,这些都有赖于进一步的深入研究。
综上所述,通过对两种AD 模型小鼠的比较研究,我们发现CP25 口服给药可正向调节肠道菌群,提示肠道菌群可能是CP25 的潜在作用靶点。本文结论将对CP25 用于阿尔兹海默症这种多病因的疾病的治疗提供理论依据和机理支持,为阿尔兹海默症的治疗提供另外一种干预手段。
