开心散与生脉散抗阿尔茨海默症“同病异治”作用机制网络药理学分析与中枢神经免疫调控效用验证*
2022-04-26楼倩颖王青青魏翀琦佘雨岩孟雪儿郑嘉妮陆韫青朱梓强
楼倩颖,曹 程,王青青,魏翀琦,佘雨岩,孟雪儿,郑嘉妮,陆韫青,朱梓强,朱 悦
(南京中医药大学药学院/江苏省方剂研究重点实验室/江苏省方剂高技术研究重点实验室/中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心 南京 210029)
1 引言
阿尔茨海默症(Alzheimer disease,AD),是老年人群高发疾病,又称老年痴呆症,临床早期最显著的症状为以记忆力受损的记忆障碍、掌握运用新知识与社交能力下降等认知障碍、并伴随有抑郁、情感淡漠或焦躁不安、注意力涣散等精神障碍。AD 发病机制极为复杂,现今获FDA 批准上市的AD 药物主要为胆碱酯酶抑制剂与NMDA 受体阻断剂,靶点单一且副作用大。而近20 年来,全球已有146 个AD 药物在研发中遭遇失败,成功率仅仅2.7%,新药研发遭遇瓶颈。而中药以其多成分、多途径、多靶点的优势,可为AD 药物研发提供全新治疗思路和研究价值[1-2]。
中医与神志有关的疾病多从“心”论治。AD 病位在脑,也与五脏之首的心密切相关。老年人日渐年老体衰,心气涣散,心阴不济,神无所依,是中医认为AD的重要病机。“同病异治”与“同病异治”是中医辨证论治的精髓与特色。“同病异治”指即使是同一病症,也会因人、因时、因地等实际情况采取不同的治疗措施。而开心散与生脉散均为中医临床辨证论治AD 的高频使用方剂[3]。开心散始载于唐代孙思邈《备急千金要方》,由人参、远志、石菖蒲、茯苓组成,功能补益心气、祛痰开窍[4]。生脉散源于张元素《医学启源》,由人参、麦冬、五味子组成,功能滋养心阴、益气生津。临床常用来治疗心血管疾病,近年来生脉散在防治神经精神系统疾病方面的研究也不断增多[5]。从方剂组成与功效不难发现,开心散偏补心气而生脉散偏补心阴,开心散攻补兼施而生脉散偏于滋补濡润[6],充分体现了“同病异治”的特点,但是其现代科学内涵尚未得到阐释。
网络药理学将中药有效成分和靶点进行网络化联结与分析,预测药物治疗疾病潜在靶点及通路从而认识药物作用机制,为阐释中药复方“同病异治”的科学内涵提供了有效途径。
因此,我们参考《网络药理学评价方法指南》中网络药理学评价的主要策略[7],拟通过网络药理学初步阐释两张方剂“同病异治”的现代科学内涵。同时结合整体动物与离体细胞实验对所揭示的生物学机制进行验证,为中药复方抗AD“同病异治”的作用机制提供更多的现代科学依据,为临床应用与相关产品开发提供更多的科学支持[8]。
2 研究思路与方法
通过构建开心散与生脉散复方成分潜在靶点网络图,寻找其抗AD 共性及优势调控靶点与通路,分析靶点与调控网络的异同。同时,通过构建Aβ 海马区注射诱导小鼠痴呆模型和LPS 诱导Bv2小胶质细胞炎性激活模型,从整体动物与离体细胞两个方面验证网络药理学分析结果,阐释开心散与生脉散调控中枢神经炎症抗AD“同病异治”的效用机制与内涵,如流程图所示(图1)。

图1 研究流程图
3 研究与分析
3.1 实验药材
五加科植物人参(Panax ginsengC.A.Mey.)干燥根和根茎、远志科植物远志(PolygalatenuifoliaWild.)干燥根、天南星科植物石菖蒲(Acorus tatarinowiiSchott)干燥根茎、多孔菌科真菌茯苓(Poriacocos(Schw.)Wolf)的 干 燥 菌 核、百 合 科 植 物 麦 冬(Ophiopogon japonicus(L.f)Ker Gael)干燥块根、木兰科植物五味子(Schisandra chinensis(Turcz.)Baill.)干燥成熟果实。上述药材饮片均购自苏州天灵中药饮片公司,经我校严辉副教授鉴定。
3.2 实验细胞及试剂
小鼠小胶质BV2 细胞购自ATCC。MEM EAGLE培养基、青霉素/链霉素/支原酶抑制剂(P/S/N)等培养试剂购自以色列Biological Industries公司,细胞培养相关耗材购自美国Corning 公司。Aβ1-42(20JW09891)购自上海诺优生物科技有限公司。石杉碱甲(H107336)购自北京伊诺凯科技有限公司。TRIzol RNA(15596-026)购自美国Thermo Fisher 公司。逆转录试剂盒(AE311)和SYBR荧光定量qPCR检测试剂盒(AQ132)购自北京全式金生物科技有限公司。小鼠肿瘤坏死因子α(TNF-α)ELISA 试剂盒(JEB-12474)、小鼠白介素6(IL-6)ELISA 试剂盒(JEB-12267)、小鼠白介素1β(IL-1β)ELISA 试剂盒(JEB-12787)购自南京金益柏生物科技有限公司。
3.3 实验动物
ICR 小鼠,雄性,六月龄,体质量22-25 g,购自上海斯莱克实验动物有限责任公司。小鼠饲养于南京中医药大学实验动物中心SPF 级屏障设施中,常规饲养(12 h光照,温度22-25℃,湿度40%-70%)。本实验已获得NJUCM 动物实验伦理委员会的批准,许可证号:CSXK(沪)2017-0005。
3.4 实验仪器
小鼠脑立体定位仪。Morris 水迷宫视频跟踪分析系统、Y 迷宫测试动物行为分析系统(Any -maze,USA)。实时定量PCR 仪(ABI 7500,USA)。超微量紫外分光光度计(DENOVIX DS-11,USA)。
3.5 实验方法
3.5.1 化学成分的收集及筛选
通 过 TCMSP (https://tcmspw.com/) 、TCM database@Taiwan(http://tcm.cmu.edu.tw/)、TCMID(http://5th.tcmspw.com/tcmsp.php)、Chemistry Database(https://www.organchem.csdb.cn)等数据库,结合文献收集复方中单味中药主要化学成分及相应CAS 号,通过化学结构数据库Pubchem(https://pubchem.ncbi.nlm.nih.gov/)下载SDF 结构,上传到SwissADME(http://www.swissadme.ch/)数据库中筛选出满足以下条件的活性成分:①胃肠道吸收GI 值high,药物相似性五个指标中满足两个及以上YES[9];②在TCMSP 数据库中“相关疾病”涉及“AD”。③文献挖掘与AD 相关的中药活性成分[10]。
3.5.2 活性成分潜在靶点预测
上传活性成分SDF 结构至小分子靶点预测数据库SwissTargetPrediction(http://www.swisstargetprediction.ch/)[11],限定物种为人源(Homo sapiens),选择高可信度的蛋白作为靶点(Probability*>0.65,不满足该条件,则选取排名前15 的靶点)。去重后通过Uniprot 数据库(https://www.uniprot.org/)矫正得到靶点标准蛋白名称和基因名称,最终得到方剂潜在靶点信息[12]。
3.5.3 复方-中药-成分-靶点网络构建
归纳分组预测所得靶点信息,通过Cytoscape 3.6.0 软件(http://www.cytoscape.org/),去除游离靶点,并通过Cytoscape3.2.0 进行拓扑学分析,计算所有节点Degree 中位值,筛选各类度值高于二倍中位值的节点,构建复方-中药-成分-靶点关键网络。其中节点(node)代表复方、中药、成分、靶点,边(edge)表示中药-成分-疾病-靶点之间的相互联系,节点大小和颜色深浅反映度值大小[13]。
3.5.4 抗阿尔茨海默症靶点的筛选
通 过TTD(http://db.idrblab.net/ttd/)、Gencards(http://www.genecards.org/)、Drugbank(https://www.drugbank.ca/)等数据库搜索获取AD 相关疾病靶点,与开心散、生脉散复方筛选得到的靶点进行对比分析,归纳总结两个复方中抗AD 潜在共性及优势调控靶点,利用VENNY 2.1(https://bioinfogp.cnb.csic.es)在线绘制韦恩图。
3.5.5 抗阿尔茨海默症靶点互作网络构建以及拓扑分析
通过STRING(https://string-db.org/)数据库对上述靶点进行蛋白互作(PPI)分析[14],限定物种为人源,选取交互分数高于0.9 的蛋白质互作关系数据,并通过Cytoscape3.2.0 进行拓扑学分析,计算所有节点Degree中位值,筛选节点度高于中位值的靶点,构建蛋白互作网。
3.5.6 KEGG通路富集分析和GO功能富集分析
利用Metascape(https://metascape.org/)对两个复方抗AD 潜在共性及优势调控靶点进行KEGG(Kyoto encyclopedia of genes and genomes)通路分析和GO(Gene ontology)功能富集分析,限定物种为人源,Pathway 选 择 KEGG pathway、GO-BP(Biological Processes)进行富集分析[15-16]。
3.5.7 药物制备
开心散提取物(KXS)的制备:按比例称取人参、远志、石菖蒲、茯苓药材(3:2:2:3)共100 g,先后加8倍、六倍量的纯水浸泡1 h,回流提取2 h,过滤,合并两次滤液,减压浓缩至约1 mL药液中含有1 g生药的浸膏[17]。
生脉散提取物(SMS)的制备:按比例称取人参、麦冬、五味子药材(五分:五分:七粒)共100 g,先后加入10 倍、6 倍、四倍量体积的纯水,浸泡1 h,回流提取1 h,过滤,最后合并三次过滤液,减压浓缩同上[18]。
3.5.8 细胞培养
小鼠BV2 小胶质细胞用含有1% PSN、1%丙酮酸钠、10%胎牛血清的MEM EAGLE 培养基,每48 h换液1 次。待细胞密度为70%即可传代,培养三代稳定后的细胞用于后续细胞实验。
3.5.9 qPCR检测炎症因子表达水平
取BV2 细胞样品,TransZol Up 提取RNA,逆转录试剂盒制备cDNA样品,依照SYBR荧光实时定量试剂盒所列步骤,利用实时荧光定量PCR 仪测定各组炎症因子IL-1β、IL-6、TNF-α 基因转录水平表达,以GAPDH 为内参,计算各组相对于空白组的基因表达百分值。实验中所用引物序列见表1。

表1 引物序列
3.5.10 Aβ海马注射拟AD小鼠模型建立及给药
将Aβ1-42溶于灭菌PBS 中,配置成1μg/μL 溶液,37℃恒温孵育一周。选取健康雄性SPF 级ICR 小鼠,适应性饲养一周后随机分组共8 组,每组8 只,分别是空白组、假手术组、模型组、KXS-L 组、KXS-H 组、SMS-L 组、SMS-H 组、石杉碱甲组。除空白组、假手术组外,小鼠异氟烷吸入麻醉,进行右侧侧脑室定位注射Aβ1-42(A:-2 mm;L:2 mm;H:-3 mm),以1 μL/1 min速度每只注射5 μL Aβ1-42,留针30s后缓慢撤针。假手术组以同样方式注射等量生理盐水。手术后小鼠常规饲养2 周给药,空白组、假手术组、模型组小鼠每日灌胃生理盐水(0.9% NaCl),阳性药组给予石杉碱甲(0.05 mg/kg/天),KXS-L 组给予开心散提取物(3 g/kg/天),KXS-H组给予开心散提取物(10 g/kg/天),SMS-L组给予生脉散提取物(3 g/kg/天),SMS-H 组给予生脉散提取物(10 g/kg/天)。
3.5.11 行为学检测
给药7 d 后进行Morris 水迷宫实验(Morris water maze,MWM),以评价小鼠空间学习记忆能力,水迷宫具体方法参照课题组已发表的研究文章进行[19]。MWM 结束后24 h后开始Y 迷宫实验(Y maze),Y 迷宫由三个相邻夹角为120°的相同臂(1:新臂,2:起始臂,3:其他臂)组成,各臂靠近中央处可装置隔板。第一阶段,隔开新臂,小鼠从起始臂进入,自由探索起始臂和其他臂,时间设置为5 min。1 h后测试阶段,移走隔板,从同一位置进入自由探索三个臂,时间设置为3 min。记录小鼠进入新臂的次数和停留时间。
3.5.12 ELISA检测
行为学测试结束后,解剖获得小鼠海马组织,液氮速冻,用PBS制备匀浆。利用ELISA试剂盒,按照所列步骤,检测海马组织中炎症因子IL-1β、IL-6、TNFα的水平。
3.5.13 统计学分析
采用SPSS19.0 软件进行统计学分析,采用单因素方差分析法(One-way ANOVA)分析,结果以均数±标准差(±s)表示,P<0.05 表示有显著差异,以P<0.01 表示有极显著差异。
3.6 结果
3.6.1 活性成分及潜在靶点的筛选与分析
通过TCMSP 等数据库收载的药材成分,并结合文献进行成分复核,筛选获得化学成分并获得下列潜在靶点:开心散活性成分234 个,预测靶点614 个(去重);生脉散活性成分215 个,预测靶点603 个(去重),两方共有成分有109 个,共有靶点490 个。其中,属于人参的活性成分有98 个,靶点425 个;非人参共有成分11 个,非人参共有靶点65 个。开心散优势活性成分136 个,优势靶点124 个;生脉散优势活性成分117个,优势靶点113 个(表2),绘制韦恩图(图2)。通过Cytoscape 3.6.0 拓扑学分析,筛选各类节点度值高于二倍中位值的关键节点,构建出的复方-中药-成分-靶点关键网络中包含256 个节点,2399 条相互作用关系(图3)[20-21]。

图2 开心散与生脉散活性成分靶点交集韦恩图

图3 复方-中药-成分-靶点关键网络
3.6.2 抗阿尔茨海默症靶点的筛选分析
通过TTD、Gencards、Drugbank 等数据库搜索获取AD 的相关疾病靶点,与开心散、生脉散复方筛选得到的靶点进行对比分析获得,开心散抗AD 潜在靶点467个,生脉散抗AD 潜在靶点465 个。两方抗AD 潜在共性调控靶点375 个,开心散抗AD 潜在优势调控靶点92 个,生脉散抗AD 潜在优势调控靶点90 个,绘制韦恩图(图4)[22]。
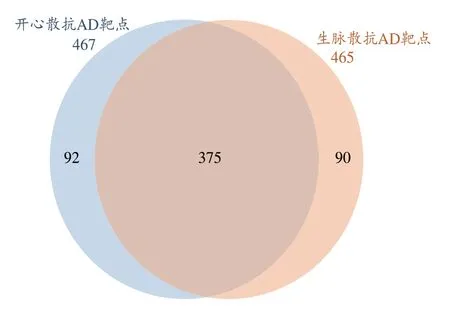
图4 开心散与生脉散抗AD靶点交集韦恩图
3.6.3 抗阿尔茨海默症靶点PPI网络构建与分析
通过STRING 数据库对上述满足交互分数高于0.9 的靶点进行PPI 分析。按条件筛选关键节点进行作网络图。得到结果如下:
开心散与生脉散复方抗AD 潜在共性调控靶点PPI 网络图,包含305 个节点、1762 条相互作用关系,度值>26(中位值)的关键节点有41 个(图5、表3)。其中,度值最高的APP 能与64 个靶点发生相互作用(图5A)[23]。

图5 开心散与生脉散抗AD潜在共性及优势调控靶点的相互作用网络

表3 开心散与生脉散抗AD潜在共性调控靶点(排列前10)
开心散抗AD潜在优势调控靶点PPI网络图,包含56 个节点、91 条相互作用关系,度值>3(中位值)的关键节点有19 个(图5、表4)。其中度值最高的PIK3R1能与15 个靶点发生相互作用(图5B)。

表4 开心散抗AD潜在优势调控靶点(排列前10)
生脉散抗AD潜在优势调控靶点PPI网络图,包含50 个节点、62 条相互作用关系,度值>2(中位值)的关键节点有24 个(表5)。其中,度值最高的SRC 能与7个靶点发生相互作用(图5C)。

表5 生脉散抗AD潜在优势调控靶点(排列前10)
3.6.4 复方抗AD 潜在共性调控靶点KEGG 通路富集分析与GO功能富集分析
利用Matescape 数据库对两方抗AD 潜在共性调控靶点进行KEGG 通路富集分析和GO 功能富集分析,根据FDR 值,各筛选出排名前20 的信号通路。两方抗AD 潜在共性调控靶点的KEGG 通路见图6A。GO 富集分析显示,生物进程(BP)涉及条目主要包含突触信号传导、神经递质调控等(图6B)。

图6 开心散与生脉散抗AD潜在共性调控靶点富集分析
3.6.5 复方抗AD 潜在优势调控靶点KEGG 通路富集分析和GO功能富集分析
利用Matescape 数据库对开心散与生脉散抗AD潜在优势调控靶点进行KEGG 富集分析和GO 功能富集分析。开心散抗AD 潜在优势调控靶点KEGG 通路主要涉及神经活性配体-受体相互作用、NF-κB 信号通路等(图7A)。GO 富集分析显示,生物进程(BP)涉及信号转导、细胞钙离子稳态等(图7B)。

图7 开心散抗AD潜在优势调控靶点富集分析
生脉散抗AD 潜在优势调控靶点KEGG 通路主要涉及钙信号通路、神经活性配体-受体相互作用等(图8A)。GO富集分析显示,生物进程(BP)涉及条目主要包含钙离子调控稳态、化学突触传递等(图8B)。

图8 生脉散抗AD潜在优势调控靶点富集分析
3.6.6 开心散与生脉散中枢神经炎症调控效用验证
基于网络药理学分析结果显示,NF-κB 信号通路是开心散抗AD 的重要信号通路,趋化因子(Chemokine)信号通路是生脉散抗AD 的重要信号通路,均提示中枢神经免疫调控是开心散与生脉散抗AD 的重要机制。为验证该效用,我们采用Aβ 海马区注射拟AD 小鼠整体动物模型与小胶质细胞BV2 离体细胞模型对该效应进行验证。
在整体动物模型上,模型组小鼠较空白组潜伏期、上台前路程均有显著增加(P<0.01)而站台穿越次数显著减少(P<0.01)(图9A),对新臂的探索次数和探索时间均显著降低(P<0.01,P<0.05)(图9B),提示海马区注射Aβ 诱导小鼠产生学习与记忆能力障碍,开心散与生脉散提取物均能提高小鼠学习和空间记忆能力。
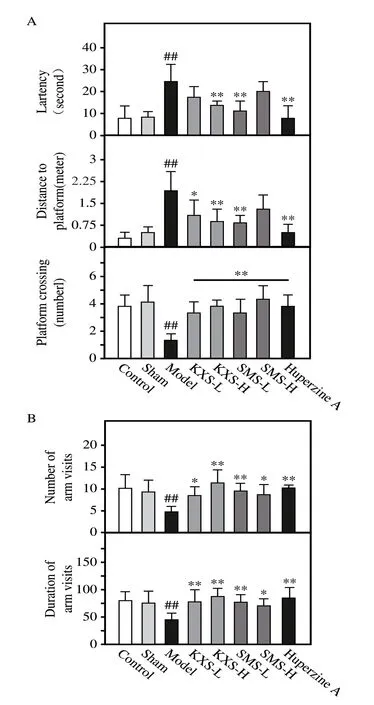
图9 开心散与生脉散对Aβ海马区注射小鼠学习与记忆能力的影响(n=8)
Aβ 沉积会激活小胶质细胞诱发中枢神经免疫反应,表现为炎性细胞因子的大量表达。采用ELISA 方法检测小鼠血清中炎性因子的水平。如图10所示,模型组小鼠海马组织炎性因子表达水平较空白组显著上升(P<0.05),开心散与生脉散提取物均能显著逆转炎性因子表达上升。

图10 开心散与生脉散对Aβ海马区注射小鼠海马组织炎性因子水平表达的影响(n=8)
基于小胶质细胞是中枢神经免疫炎性反应最重要的效应细胞之一,构建LPS 刺激诱导BV2 细胞炎症损伤模型,给以复方提取物,利用qPCR 方法检测BV2细胞中炎性因子IL-1β、IL-6、TNF-α 的mRNA 表达水平进行验证分析。结果如图11 所示,1 μg·mL-1LPS能够显著刺激BV2 细胞表达炎性因子(P<0.01),开心散与生脉散均可显著逆转上升趋势,以开心散提取物高剂量作用趋势最强。

图11 开心散与生脉散对LPS诱导损伤下BV2细胞炎性因子表达的影响
4 讨论
AD 发病机制复杂,涉及Aβ 的级联反应、tau 异常磷酸化、乙酰胆碱丢失、突触功能失调、慢性炎症、基因突变等。研究发现,开心散可显著改善APP/PS1 模型小鼠学习和记忆能力,逆转模型小鼠AchE 活性升高,对抗Aβ 诱导的神经元损伤,并具有免疫调节、抗氧化、抗炎等作用[24]。临床研究亦证实开心散是有效的治疗AD 的方剂。林丹霞等人观察口服开心联合盐酸多奈哌齐治疗AD 实验发现联用效果显著高于单一西药治疗;陈艳懂等人察发现调神益智针联合开心散疗法具有显著改善认知功能的作用[25]。生脉散在防治神经精神系统疾病也具有良好疗效,邱秉新等人临床统计限制生脉散治疗14 例老年性痴呆和17 例多发性梗塞性痴呆总有效率达74.2%[26]。实验研究也证实其具有抗应激损伤、降脂、改善脑功能等作用[27-28]。因此,我们采用网络药理学研究方法,将这两张已经临床与实验研究有效的抗AD 治疗方剂中成分和靶点进行网络化的联结与分析,建立开心散与生脉散复方-有效成分-靶点网络图,分析两个复方抗AD 潜在共性及优势调控靶点互作关系和潜在靶点作用通路,探索开心散与生脉散抗AD 的共性与个性调控机制,有利于阐明其对AD“同病异治”科学内涵。
分析发现,开心散与生脉散共有抗AD 靶点中很大部分来自与它们的共有药味-人参,涉及细胞的信号传导、存活与凋亡、炎症反应、应激适应等。其核心靶点APP 异常水解形成的Aβ 沉积是AD 最大的病理特征之一。研究发现开心散能够下调快速老化痴呆SAMP8小鼠脑内β-APP表达;生脉散能够改善三氯化铝联合D-半乳糖制备AD 模型大鼠认知障碍,抑制Aβ 毒性保护神经元;人参中多种皂苷成分能够显著改善AD 患者中枢神经症状,可以增加α-分泌酶和sAPPα的表达,同时降低β-分泌酶和Aβ的表达,人参皂苷Rg1、Rb1、Rd、Re 等具有提高学习记忆能力等作用[29]。除APP 外,网络药理学预测分析的PIK3CA、AKT1参与的PI3K-AKT信号通路显著影响细胞增殖、分化、凋亡。开心散能够上调三氯化铝联合D-半乳糖制备AD模型小鼠PI3K、p-AKT蛋白表达,改善脑组织病理损伤,促进AD 脑内源神经再生[30];生脉散中的五味子素也可转录STAT3 信号,激活PI3K-AKT 信号通路减轻小胶质细胞所致的炎症损伤。共性调控靶点富集分析结果涉及AGE-RAGE 信号通路、AMPK 通路、tau 蛋白结合、氧化还原酶活性等作用机制。韩丽君等报道开心散含药血清能够降低模型小鼠AGEs 含量,抑制AGE 与RAGE 的结合,具有延缓衰老的作用[31];石菖蒲所含的挥发油、茯苓所含的三萜酸等成分能调节氧化还原酶活性起到抗氧化的作用,增加SOD的活力等;生脉散能够激活AMPK 信号通路改善线粒体脂质代谢紊乱和形态损伤,五味子中的五味子酚等活性成分能提高机体抗氧化能力,增加脑组织内SOD活力,抑制CAT 性,对抗机体氧化应激损伤[32-33]。上述报道均显示,网络药理学的预测结果与实验报道一致,因此该方法是探讨复方功效物质基础与作用机制的有效方法。
研究表明,AD 病人脑实质中小胶质细胞过度活化转变成M1 型,趋化因子CXCL1、CXCL9、CXCL10 等表达上调,参与促炎反应,CX3CL1 则能抑制Tau 蛋白病变,具有神经信号传导和神经保护作用。炎性细胞因子和趋化因子的水平升高,共同形成神经慢性炎症反应,是AD 的重要病理机制[34,35]。本研究发现开心散抗AD 潜在核心靶点与调控网络与中枢神经炎症调控密切相关,例如RelA 是NF-κB家族的重要成员,TNF、CXCL8、CXCR2 等靶点均与炎症的调节和细胞防御应答等密切相关。KEGG 通路富集分析结果也显示NFκB 通路这一中枢神经免疫炎性反应的核心通路。曲苏晨等人发现开心散能够抑制NF-κB 入核和NF-κB磷酸化等环节发挥抗炎作用,显著下调IL-1β、IL-6、TNF-α 等炎症因子的表达水平,抑制炎症反应[36,37]。生脉散亦可降低IL-6,TNF-α 表达,减轻炎症反应及增强机体免疫力,通过应激活化蛋白激酶途径减少自噬体形成[38]。生脉散的调控通路中也涉及趋化因子信号通路。本研究中验证实验结果也显示,开心散与生脉散能够有效改善Aβ 海马区注射小鼠海马区和小胶质细胞炎性因子表达,支持了中枢神经免疫调控是开心散与生脉散抗AD 共性的调控通路与生物学事件的网络药理学预测结果。
网络药理学为研究中药复方的物质基础与作用机制提供了有力的手段,但也存在显而易见的局限性。例如,仅仅依据复方成分展开网络化的靶点连结与机制的深入分析,忽视了活性成分在复方中含量,无法体现量效关系。同时,数据库之间的算法差异也会干扰预测。因此,实验验证是保障网络药理学研究可靠性的重要手段。本研究中,我们采用整体动物与离体细胞实验结合,对网络预测的中枢神经炎症调控环节加以验证,发现开心散与生脉散确实具有改善Aβ 注入诱导痴呆模型小鼠的认知功能障碍,下调小鼠体内的炎症因子IL-1β,IL-6,TNF-α 水平,起到抗炎的作用,并在LPS 诱导炎症细胞模型上也得到了抗炎效果的验证。并且,从验证性实验中炎性因子的调控程度分析,开心散表现出较生脉散较强的作用趋势,这也与网络药理学分析中炎性调控靶点与通路为开心散优势调控靶点与通路的分析结果一致。通过网络药理学,我们发现,开心散与生脉散因其有共同的组成药味而有共性的抗AD 调控靶点与通路,也因配伍药味的不同而拥有独特的调控靶点。同时两方虽然有各自优势靶点,但也可能归结到相同的通路发挥调控作用,这可能是开心散与生脉散“同病异治”抗AD 的科学内涵。在今后的研究工作中,我们将继续对两张复方抗AD 的优势调控靶点与通路进行验证与研究,更好阐释“同病异治”这一中医辨证论治方法的科学内涵,同时为开心散与生脉散的基础研究与产品开发提供更多的现代科学证据。
5 结论
本研究通过网络药理学网络化联结与分析方法,构建了抗AD 常用中药复方开心散与生脉散成分-靶点调控网络图,发现中枢神经炎症调控是开心散与生脉散复方抗AD 的重要生物学机制。整体动物与离体细胞实验也证实,开心散与生脉散复方能显著降低小鼠海马以及炎症损伤Bv2细胞模型中的炎症因子表达水平,改善AD 模型小鼠认知功能障碍,验证了网络药理学的发现。研究结果有利于阐释开心散与生脉散复方“同病异治”抗AD 的科学内涵和作用机制,也为开心散与生脉散抗AD 产品的开发提供了科学证据与思路拓展。
