腹膜播散性平滑肌瘤病7 例诊治分析
2022-04-26许阡柳鑫王金娟
许阡,柳鑫,王金娟
腹膜播散性平滑肌瘤病(leiomyomatosis peritonealis disseminate,LPD)是一种罕见的良性疾病,其特点是多发平滑肌瘤结节弥漫分布在腹膜和腹膜下间隙[1]。其发病率低,主要发生于绝经前女性,在绝经后女性和男性中鲜有报道[2]。LPD 无特异性临床表现,多无明显症状,少数可表现为腹痛、腹部不适、阴道出血或直肠出血等症状[3]。因其缺乏特异性表现,术前误诊率和漏诊率较高,确诊主要依靠术中探查、术后病理及免疫组织化学结果。目前国内外关于LPD 的报道仅200 余例,多为个案报道,无标准化的诊疗指南。因此,本文总结了首都医科大学附属北京妇产医院(我院)经术后病理确诊的7 例LPD 患者的临床病例资料并结合文献复习,以期为该病的临床诊疗提供参考。
1 资料与方法
1.1 一般资料回顾性分析2018 年6 月—2021 年7 月我院收治的7 例LPD 患者的临床资料,所有患者病历资料完整,术后于我院定期随访。
1.2 研究方法收集7 例患者的一般资料(年龄、既往手术史)、临床表现、影像学表现、手术方式、术中探查情况、术后石蜡病理检查和免疫组织化学结果以及预后,对这些资料进行回顾性分析。
1.3 统计学方法由于病例数较少,主要为描述性分析。正态分布的定量资料采用均数±标准差()表示,定性资料采用例数(百分比)表示。
2 结果
2.1 一般情况7 例LPD 患者的年龄33~48 岁,平均(41.6±6.7)岁,均未绝经。7 例患者均有腹腔镜子宫肌瘤剔除术史,其中2 例(28.6%)患者有2 次腹腔镜下子宫肌瘤剔除术史,1 例(14.3%)患者腹腔镜肌瘤剔除术后2 年子宫肌瘤复发行开腹次全子宫切除术。7 例患者LPD 发病距既往最近腹腔镜子宫肌瘤剔除术时间为6~132 个月,平均(60.1±44.6)个月。4例(57.1%)患者既往子宫肌瘤剔除术后病理提示富于细胞型子宫平滑肌瘤。
2.2 临床表现4 例患者(57.1%)无明显症状,主诉因体检发现盆腹腔包块就诊。余3 例患者表现为间断性下腹痛1 例(14.3%),尿频1 例(14.3%),肛门坠胀感1 例(14.3%)。
2.3 影像学表现7 例患者均行盆腔超声检查,均提示盆腔内低回声实性肿物,内见条状血流信号,部分肿物分叶状或形态欠规则。7 例患者均行盆腔磁共振成像(magnetic resonance imaging,MRI)增强检查,均提示盆腔多发实性肿块,不均匀强化(见图1)。其中2 例患者MRI 提示LPD 可能,术前MRI 诊断率为28.6%,还有2 例患者MRI 提示不除外盆腹腔恶性肿瘤可能。4 例患者行盆腹腔CT 增强检查,均提示盆腹腔多发实性或囊实性肿块,显著强化,其中1 例CT 提示LPD 可能(见图2),术前CT 诊断率为25.0%,还有2 例提示恶性肿瘤种植转移不除外。
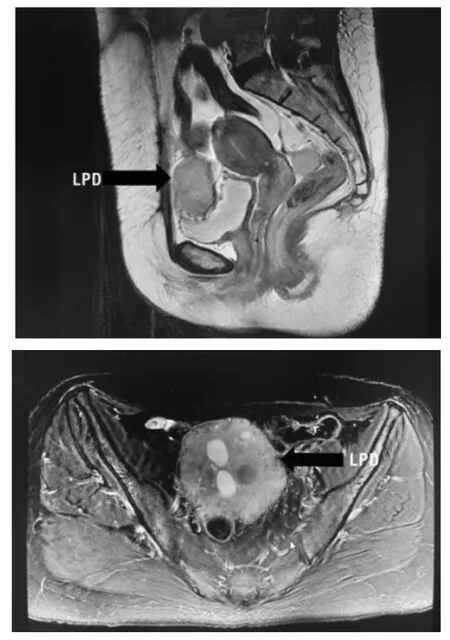
图1 MRI 增强图像
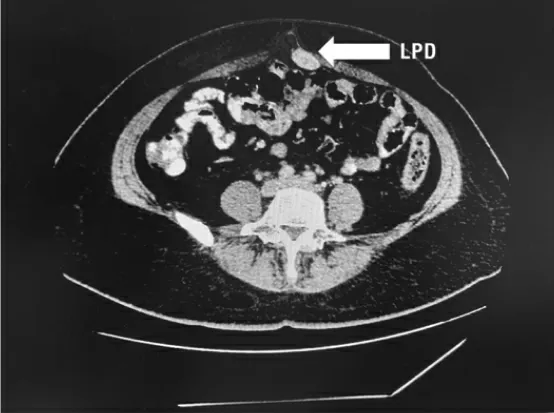
图2 CT 增强图像
2.4 术中探查及手术方式术中探查盆腹腔肿物转移情况发现,结节广泛分布在肠系膜(4 例)、腹膜(3 例)、大网膜(2 例)和子宫直肠陷凹(2 例)等处,结节大小0.4~10 cm。
手术方式包括以下4 种:①腹腔镜下全子宫+双附件切除术+LPD 结节切除术。该患者47 岁,腹腔镜下切除子宫、双侧附件及LPD 结节,脐旁肿物因位置特殊,中转开腹切除。②开腹LPD 结节切除术:2例患者行该手术,均为48 岁,建议行全子宫+双附件切除术,但患者及家属均坚决要求保留子宫及双侧附件。③腹腔镜LPD 结节切除术:3 例患者行该手术,年龄33~37 岁,术中切除所有肉眼可见的LPD结节,切除的所有LPD 结节置入取物袋中取出。④腹腔镜探查+中转开腹LPD 结节切除术:该患者44 岁,未婚未育,仅行LPD 结节切除术,术中探查发现LPD结节分布在乙状结肠肠系膜及升结肠肠系膜处,其中乙状结肠表面肿物8 cm,与乙状结肠连接处见粗大、紫蓝色、怒张的血管,不除外腹腔镜术后再次播散转移的可能,遂中转开腹。见表1。

表1 7 例LPD 患者的基本信息、手术方式及术中术后结节情况
2.5 病理学特征7 例患者的LPD 结节术中肉眼见球形或分叶状肌瘤结节,颜色灰白或灰红,多数结节实性、质韧,切面呈漩涡状,2 例患者LPD 结节局部区域呈囊性变。
7 例患者术后石蜡及免疫组织化学病理均证实结节为平滑肌瘤。7 例患者的结蛋白(Desmin)、波形蛋白(Vimentin)、平滑肌肌动蛋白(smooth muscle actin,SMA)、雌激素受体(estrogen receptor,ER)及孕激素受体(progesterone receptor,PR)均为阳性,CD34及CD117 均为阴性,Ki-67 指数均小于10%,其中5例患者Ki-67 指数小于5%。其中1 例患者石蜡及免疫组织化学病理提示平滑肌瘤局部生长活跃并呈富于细胞型平滑肌瘤改变,性质与6 年前腹腔镜剔除子宫肌瘤病理一致。此患者在对切除的直肠侧窝处的结节进行病理检查时,除发现平滑肌瘤外,同时发现子宫内膜异位病灶。
2.6 随访及预后7 例患者随访时间为1~36 个月,中位随访15 个月。随访内容包括妇科检查、盆腔超声、盆腹腔CT 或盆腔MRI 检查。7 例患者随访至今均未复发。
3 讨论
3.1 LPD 的发病机制目前LPD 的发病机制尚不明确,主要的可能机制包括以下4 种。①腹膜间充质干细胞化生学说:多数学者认为,腹膜表面弥漫性生长的LPD 结节可能是由腹膜下具有多分化潜能的间充质干细胞化生而来[4]。间充质干细胞亦可化生为子宫内膜腺体和间质细胞,形成子宫内膜异位病灶。LPD 可与子宫内膜异位病灶同时并存,也进一步支持了该学说[5-6]。本研究中1 例患者即LPD 结节同时合并子宫内膜异位病灶,考虑间充质干细胞化生可能参与了该患者LPD 的形成。②性激素学说:LPD 结节多表现为ER、PR 阳性,且LPD 大多发生在绝经前女性,在妊娠期间、合并卵巢颗粒细胞瘤或口服避孕药时,高水平雌、孕激素均可促进LPD 结节产生,并增加其大小及数量[7-8]。③医源性学说:腹腔镜子宫肌瘤剔除术中应用的肌瘤旋切器,可能产生较小的碎片组织并将其播散至腹膜,植入正常组织并形成新生血管发展为LPD[9]。有研究对6 例既往有腹腔镜肌瘤粉碎史的LPD 患者进行了基因学分析,LPD 的肿瘤结节与原始的子宫平滑肌瘤存在相同的基因突变和杂合性丢失,进一步说明了LPD 是由原始的子宫平滑肌瘤结节碎片播散种植而来[4]。此外,一些LPD 结节种植于腹腔镜穿刺孔附近也侧面证实了这一理论[10]。本研究中的7 例患者均有腹腔镜下子宫肌瘤剔除术史,其中2 例有2 次腹腔镜下子宫肌瘤剔除术史,1 例LPD 结节种植于脐部附近,结合上述文献,考虑医源性因素参与了LPD 结节的形成。④遗传学说:遗传因素可能在LPD 的发生中起作用。个别病例在家族成员中聚集,说明遗传因素可能参与了部分LPD 的发生[1]。
另有文献表明,多数LPD 患者的原始子宫肌瘤类型可能为富于细胞型平滑肌瘤。富于细胞型平滑肌瘤质地柔软,细胞丰富,增长速度快,有远处转移的潜能,旋切肌瘤过程中更易被粉碎成细小组织散布到盆腔各处[4,11]。本研究中7 例LPD 患者,其中4例患者既往子宫肌瘤剔除术后病理提示富于细胞型子宫平滑肌瘤。因此,对于可疑富于细胞型平滑肌瘤的患者,腹腔镜肌瘤旋切手术应格外留意,尽量避免医源性播散,术后应严密随访,警惕LPD 的发生。
3.2 LPD 的临床特点LPD 主要发生于绝经前女性[2]。大多数LPD 患者无明显症状,其非特异性症状可能与肿瘤结节的位置和大小有关。腹痛是LPD 的常见临床症状,其他症状包括腹部不适、腹胀、阴道或直肠出血、肠梗阻和肾绞痛,甚至腹水、急性肾功能衰竭等[3]。本研究多数患者无明显症状,1 例患者表现为间断性下腹痛,1 例表现为尿频,1 例表现为肛门坠胀,术中探查均为4~5 cm LPD 结节压迫相应脏器所致。LPD 的影像学表现亦是非特异性的,其影像学检查特征与恶性肿瘤有相似之处。超声、CT 和MRI 是术前辨别平滑肌瘤和盆腹腔其他实体瘤最有效的检查方法,但对鉴别是否为恶性肿瘤帮助甚微[12]。本研究中的7 例患者,我院在B 超考虑非典型子宫肌瘤影像学表现后均行MRI 检查,2 例患者提示LPD 可能,1 例患者盆腹腔增强CT 提示LPD 可能,与文献描述相符。
3.3 LPD 的诊断LPD 的诊断需在手术探查后,通过组织病理学及免疫组织化学明确。LPD 术中探查常为多发、实性、质硬、灰白色或白色的圆形结节,广泛分布在腹膜表面、肠系膜、大网膜及直肠子宫陷凹等处,结节数目从几个到几百个不等,直径从1 mm到30 cm 不等[3-4]。LPD 镜下特征为:梭形平滑肌细胞呈交叉或螺旋状排列,无细胞异型性、核分裂象或肿瘤细胞坏死[13]。免疫组织化学大多表现为ER 和PR高表达,且Ki-67 指数较低(小于3%)[4]。Desmin、Vimentin 和SMA 高表达,CD34 和CD117 阴性[9]。本研究7 例患者均行手术治疗,术中发现LPD 结节广泛种植于肠系膜、腹膜、大网膜和直肠子宫陷凹等处,结合文献经验总结,术中发现上述类似表现时,应及时考虑LPD 诊断的可能性,以便术中制定更为合理的诊疗方案。
3.4 LPD 的治疗与预后LPD 的治疗包括保守治疗和手术治疗。保守治疗包括内分泌治疗、停止性激素避孕和终止妊娠。对于不能耐受手术、拒绝手术、病灶分布广泛以及有生育要求的患者,内分泌治疗是最佳治疗方法,内分泌治疗亦可用于预防LPD 术后的复发或术前应用增加完全切除肿瘤的可能[14]。但目前尚无术后药物辅助治疗的统一共识[15]。术后药物治疗对于预防复发的有效性尚存争议,即使应用了药物仍有可能短时间内复发。Tan 等[15]报道了1例37 岁LPD 女性患者,术后予促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)作为辅助治疗,2 年后腹腔和盆腔LPD 复发。考虑本研究中所有患者均已将LPD 病灶完全切除,因此术后未予药物治疗,且术后短期随访均未发现复发。
手术方式的选择需制定个体化方案。对于有生育要求的女性,应尽可能切除所有种植病灶并进行网膜切除术,完全切除病灶对后续妊娠有益[5,16]。对于无生育要求的女性,应扩大切除全子宫、双侧附件以及肉眼可见病灶[12]。本研究7 例患者仅1 例47 岁患者行全子宫+双附件切除+肉眼可见的病灶切除,余6 例均行LPD 肉眼可见病灶切除,其中2 例患者建议行全子宫+双附件切除,但其家属坚决拒绝,4例因有生育要求仅行病灶切除。结合文献,后续将对这6 例患者的LPD 复发情况及妊娠情况进行严密随访,以期为其制定更合理的后续治疗及随访方案。
LPD 虽然是良性疾病,但其有复发和恶变的风险,需要长期随访。Li 等[5]对13 例LPD 患者进行了回顾性分析,发现1 例患者术后12 个月复发,1 例术后34 个月复发。本研究7 例患者随访1~36 个月,中位随访15 个月,均未发现复发,考虑患者术后随诊时间较短,后续将继续严密随访。LPD 的恶变率为2%~5%[2]。目前普遍认为,无雌激素暴露、无子宫肌瘤病史、无ER 和PR 表达、肿瘤巨大和多次复发等是LPD 恶变的高危因素[8]。因此,LPD 患者在术后第1 年至少每3 个月进行随访,对于高危患者,应行CT或MRI 筛查[3]。
LPD 的预防应引起重视。2014 年美国食品药品监督管理局(Food and Drug Administration,FDA)不建议腹腔镜肌瘤剔除中使用旋切器,避免可疑子宫肿瘤的转移种植[7]。即使在取物袋内进行旋切术,仍有肌瘤碎片渗漏和扩散的风险[17]。《实施腹腔镜下子宫(肌瘤)分碎术的中国专家共识》指出,一旦怀疑旋切肌瘤过程中取物袋破损,应用至少3 L 蒸馏水或生理盐水反复仔细的冲洗盆腹腔,避免残留组织遗漏[10]。另外,代替旋切,可以通过将肌瘤平分、切成圆形等方法,将腹腔镜剔除后的肌瘤通过阴道切口或小的腹部切口取出[17]。
综上,LPD 是一种罕见的良性疾病,好发于绝经前女性。发病机制目前尚有争议,其临床症状不典型,缺乏特征性影像学表现,确诊需依靠手术探查及组织学病理联合免疫组织化学检查。由于其发病率低,目前尚无标准化的治疗方案,主要的治疗方法有手术治疗和内分泌治疗,需根据患者的年龄、生育要求、症状的严重程度以及合并症制定个体化的治疗方案。LPD 虽为良性肿瘤,但有复发和恶变的风险,术后需严密随访。尚需大规模、大样本的研究,明确其发病机制,制定标准化的指南,以期减少LPD 的发生及改善LPD 患者的预后。
